Введение
С активным использованием в медицине методов кардиохирургического лечения ишемической болезни сердца (ИБС), приоритетной причины летальных исходов и инвалидизации населения ощутима необходимость внедрения дополнительной и актуальной диагностики кардиоваскулярной патологии. В этом отношении привлекателен анализ вариабельности сердечного ритма (ВСР). Он предназначен для идентификации регуляторных нарушений сократительной деятельности сердца и при высоком разрешении специализированной аппаратуры и программного обеспечения способен решить задачу получения в режиме on-line информации состояния вегетативной регуляции интраоперационно. С использованием метода возможно получение дополнительных симптомов при отборе больных на интервенционное вмешательство, а также для ведения пациентов после операции. За последнее десятилетие исследований применения анализа ВСР не так много, но тенденция к инновационным внедрениям в кардиохирургию вполне ощутима и, по-видимому, будет расширяться. Часть исследований посвящена сравнению интервенционных методов хирургической реваскуляризации миокарда с менее травматичными кардиохирургическими технологиями [2; 6; 9]. Более всего исследований о последствиях интервенционных вмешательств [1; 3; 4; 7]. Научная кардиохирургия озабочена выявлением предикторов жизнеопасных осложнений во время и после вмешательств [10]. И совсем мало работ, касающихся анализа ВСР во время операции [10]. К теме настоящего сообщения близка попытка Lakusic H. et al. [6], сопоставлявших показатели ВСР у пациентов после коронарного шунтирования (КШ) с применением аппарата искусственного кровообращения (АИК) и без него. Различий авторы не нашли. Негативный результат, возможно, связан с недостаточной точностью неспециализированной для ВСР аппаратно-программной техники для Холтеровского мониторирования (ХМ) с извлечением RR-интервалов. Это касается многих зарубежных работ после опубликования и широкого распространения Task Force [5], в которых рекомендована для анализа ВСР точность регистрации электрокардиосигнала (ЭКС) от 128 до 250 Гц. Для ХМ достаточен съём ЭКС с дискретизацией даже в 100-128 Гц. Между тем при исследовании актуальных изменений регуляции синаптического уровня там, где происходит передача импульсов с автономных терминалей пейсмекерным клеткам-эффекторам синоатриального узла сердца (СУ), требуется более высокая дискретизация ЭКС. Наш опыт 20-летнего анализа ВСР убеждает в необходимости значительно более точной регистрации, и хранении в оперативной памяти компьютера с той же точностью, поскольку у самых тяжёлых пациентов мы встречались неоднократно с амплитудой волн ВСР, исчисляемой единицами миллисекунд (0,001 секунды). Поэтому при недостаточной чувствительности прибора результат 3-го знака после запятой обнуляется перед передачей в память компьютера. В зарубежных публикациях при анализе ВСР оцениваются лишь 2 фактора автономной регуляции – симпатический и парасимпатический. Они облигатно регулируют ионные токи через мембрану пейсмекеров, что и формирует медленные потенциалы действия в пейсмекерной автоматии. Невозможно игнорировать влияние на них ионного состояния внеклеточной среды, зависимой от метаболизма и концентрации активных веществ в гуморальных субстанциях.
Целью представляемого исследования было изучение возможности использования в кардиохирургии высокоточного метода ритмокардиографии (РКГ) для периоперационного применения анализа ВСР при коронарном шунтировании у больных стабильной стенокардией (СтСт) для выявления дополнительных РКГ-симптомов ИБС и СтСт и послеоперационного ведения пациентов, а также для интраоперационного контроля состояния оперируемых больных. Предпосылками для исследования было высокоточное (регистрация ЭКС с точностью 1000±3 Гц) аппаратно-программное обеспечение КАП-РК-01-«Микор» (Регистрационное удостоверение Федеральной службы по надзору в здравоохранении № ФС 02262005/ 2447-06, патенты РФ №№ 2099004, 2068650, 2076628, 2069531, 2199945, 71530 и свидетельство РосАПО № 950230), недостаточная предсказуемость кардиохирургического результата и необходимость актуальной инструментальной оценки кардиоваскулярного статуса у пациентов. Тактически предусматривалось РКГ-исследование больных СтСт до операции, во время и после операции.
Материалы и методы. По специальным критериям включения и исключения были отобраны 256 пациентов с СтСт для дооперационного обследования (из них 133 человек направлены на стентирование) и 123 послеоперационного и интраоперационного РКГ-исследования. Контролем служили ВСР данные 47 здоровых индивидов, сопоставимых по возрасту и полу. Помимо стандартных кардиологических обследований, им проводилась РКГ для регистрации, статистического временного и спектрального анализа ВСР. Выделялись показатели: RR – средний интервал в анализируемой выборке, SDNN – среднее стандартное отклонение интервалов от среднего статистического значения, σl, σm, σs –среднеквадратичные отклонения гуморально-метаболических, симпатических и парасимпатических флуктуаций ВСР. В спектральном анализе оценивалось соотношение долей каждого из факторов регуляции – VLF%, LF%, HF% соответственно [8]. До и после операции РКГ-исследование проводилось в покое и 4-х нагрузочных пробах: Вальсальвы (Vm), Ашнера (pA), активной ортостатической (Aop), нагрузочной на тредмиле (PWC120). Для интраоперационного исследования был создан по гранту Челябинского министерства экономического развития аппаратно-программный комплекс с мониторной записью ритмокардиограммы во время КШ. При записи через каждые 300 интервалов выдавался результат математического анализа с выведением данных на экран (по решению врача) и занесением в архив. Для оценки реакции ритма на стимулы в пробах применялся простой математический анализ и выделялись: DRR-максимальная реакция на стимул, время её достижения – tAB и время восстановления после стимула – tr. Рассчитывались нормированные по «закону исходного уровня» (Wielder) показатели. В статье представлены совпадающие с нормированием данные ВСР.
Статистический анализ результатов исследования проводили с использованием программы STATISTICA 6.0, а также пакета Microsoft Excel 5.0. Все показатели, представленные в интервальной шкале измерения (например, показатели ВСР в покое (Ph) и пробах Вальсальвы-Бюркера, Ашнера, ортостатической и нагрузочной на тредмиле (Vm, Pa, Aop, PWC120)), были изучены на предмет нормальности распределений с помощью критерия Хи-квадрат Пирсона. Эмпирические распределения параметров отклонялись от нормального распределения, что ограничивало возможность применения параметрических методов проверки статистических гипотез (в частности, критерия Стъюдента). Однако в выборках, где объемы были достаточно большими, для сравнительного анализа использовали аналог критерия Стъюдента – Z-критерий сравнения средних значений для независимых выборок большого объема, поскольку этот критерий применим для распределений, отличающихся от нормального. Динамику изменения параметров (при сравнительном анализе параметров до и после КШ) исследовали с использованием параметрического критерия Стъюдента (критерий сравнения зависимых выборок).
Результаты исследования и их обсуждение. Данные сопоставления ВСР в контроле и 256 больных, направленных для интервенционного вмешательства, представлены в таблице 1.
Таблица 1 – Временные статистические ВСР-показатели у больных ИБС до коронарного шунтирования (ИБС1, верхняя строка, n=256) и у здоровых лиц (К, нижняя строка, n=47)
|
РКГ показатели (M ±s) в секундах (с) |
Ph, исходный фон в позе лёжа |
Vm, маневр Вальсальвы-Бюркера |
рА, проба Ашнера-Даньини |
Aор, активная ортостатическая проба |
PWC120 тред-мил-тест до ЧСС120 в мин. |
|
RRс cредний интервал |
0,966±0,172 0,980±0,042 Z=1,19 |
0,979±0,166 0,862±0,007 Z=11,36 |
0,985±0,160 0,996±0,042 Z=0,95 |
0,835±0,158 0,780±0,036 Z=5,5 |
0,985±0,184 0,933±0,044 Z=4,0 |
|
SDNN c, cреднекв. откл-е всех волн ВСР |
0,022±0,011 0,052±0,006 Z=2,94 |
0,025±0,013 0,047±0,006 Z=2,44 |
0,025±0,014 0,070±0,008 Z=32,6 |
0,019±0,010 0,050±0,004 Z=31,0 |
0,022±0,010 0,066±0,044 Z=7,3 |
|
σl, средне-квадр. откл-е гуморальных волн ВСР |
0,016±0,008 0,031±0,004 Z=19,4 |
0,019±0,010 0,026±0,003 Z=9,7 |
0,019±0,011 0,050±0,006 Z=10,3 |
0,015±0,007 0,032±0,004 Z=2,43 |
0,015±0,006 0,039±0,006 Z=8,88 |
|
σm, средне-квадр. откл-е симпатич. волн ВСР |
0,009±0,004 0,024±0,003 Z=2,77 |
0,009±0,005 0,019±0,003 Z=5,1 |
0,009±0,006 0,031±0,005 Z=16,06 |
0,007±0,004 0,030±0,003 Z=14,3 |
0,009±0,004 0,028±0,004 Z=10,1 |
|
σs, средне квадр. откл-е парасимпатич. волн ВСР |
0,011±0,008 0,032±0,004 Z=11,6 |
0,010±0,008 0,031±0,004 Z=11,5 |
0,011±0,009 0,033±0,005 Z=2,71 |
0,007±0,007 0,021±0,002 Z=8,86 |
0,013±0,008 0,036±0,004 Z=9,58 |
Примечание: здесь и в других таблицах принят аналог критерия Стьюдента-Z при сравнении средних значений для независимых выборок большого объёма. Уровень значимости различий между 1,96 и 2,3 с 5% и 1% ошибкой соответственно. Здесь и в других ритмокардиограммах, спектрах и таблицах: RR (NN) – средний межсистолический интервал; sRR (SDNN) – общее среднеквадратическое отклонение всех колебаний ВСР; sl – среднеквадратическое отклонение гуморально-метаболических волн ВСР; sm – среднеквадратическое отклонение симпатических волн ВСР; ss – среднеквадратическое отклонение парасимпатических волн ВСР.
По большинству временных показателей ВСР больные ИБС существенно отличались от здоровых лиц в гр. К, отбор пациентов на КШ был вполне рациональным, их кардиоваскулярный статус соответствовал основному диагнозу. Отсутствие достоверных различий RR в позициях Ph и pA можно считать несущественным, поскольку средний RR-интервал является интегральным, идентифицирующим утилитарно фон нормокардии, бради- или тахикардии, на котором разыгрывается вся ВСР с более тонкими и клинически значимыми подробностями нарушений регуляции хронотропной функции сердца. SDNN была снижена относительно гр. К более чем в 2 раза в Ph, Vm, Aop и в 3 раза в pA и PWC120. Результат подтверждал аналогичные данные многих авторов, работающих в направлении исследования клинического значения ВСР.
Показатели парасимпатических флуктуаций (σs), симпатических (σm), и даже гуморально-метаболических (σl) волн были достоверно снижены во всех пробах. Поэтому трактовка снижения ВСР, как следствие автономной денервации, вероятно не точна. Однонаправленность изменений гуморально-метаболического фактора и автономной регуляции, функционирующей через специфические медиаторы из нервных терминалей, предполагает не только и не столько именно денервацию в СУ, а какую-то обобщённую причину за пределами синаптического взаимодействия нервных окончаний и пейсмекерных автоматически возбудимых клеток СУ. В условиях хронического ишемического процесса такая причина может быть связана с состоянием самих пейсмекерных клеток СУ. Это и объясняет снижение всех составляющих ВСР. Обращает внимание амплитуда изменений показателей ВСР в пробах. У больных ИБС она существенно меньше. Автономные же показатели – симпатический (σm) и парасимпатический (σs), судя по характеристикам волновой структуры ВСР, вообще не отреагировали на воздействие стимулов в пробах, что подтверждает нарушения в самих клетках СУ, возможно, необратимые, поскольку направленность стимулов в пробах тоже была различной. Автономная кардионейропатия с предельно выраженным угнетением симпато-парасимпатической регуляции была выявлена у 29 (11,32%) пациентов. К моменту принятия решения об интервенционном вмешательстве, вероятно, сформировались патологические паттерны реагирования по принципу «что возможно» в ответ на стимулы. В отличие от показателей здорового контроля значения RR, SDNN, σl, σm в Vm изменились разнонаправленно, то же самое произошло с гуморальным показателем – σl в активном ортостазе и при нагрузке (Аор и PWC120). Показатели ВСР были не только снижены, но и гипореактивны и патологичны. Это подтверждается и результатами анализа периодов стимуляции в пробах (табл. 2, показатели ΔRR%, tAB, tr). Максимальная реакция в Vm, pA, Aop, PWC120 была ниже контрольной, а время её достижения и восстановления после стимула больше, чем в гр. К. Различия почти во всех позициях были достоверные (Z<0,05-0,001).
В спектральном соотношении регулирующих факторов в СУ (табл. 2) также явно патологической оказалась дизрегуляция в СУ. У здоровых лиц доля влияния гуморально-метаболического фактора в СУ должна быть минимальной, поскольку в филогенезе живых существ это воздействие замедленное, недостаточное и, иногда, парадоксальное. Автономное же влияние должно преобладать, поскольку оно быстрое и адекватное у высокоразвитых существ. В сравнении с гр. К у больных ИБС, наоборот, соотношение регулирующих факторов патологически изменилось в сторону стабильно усилившегося гуморально-метаболического влияния на пейсмекеры СУ (VLF%) за счёт снижения в тотальном спектре доли воздействия на «Р» клетки СУ симпатического и парасимпатического факторов.
Таблица 2 – Спектральные показатели соотношения факторов, регулирующих пейсмекерную активность синоатриального узла сердца, и результаты анализа периодов стимуляции у больных ИБС до коронарного шунтирования – (ИБС1, верхняя строка, n=256) и у здоровых лиц (К, нижняя строка, n=47)
|
РКГ показатели (M ±s) в сек.(с) и %, критерии t-сравнение К и ИБС1 |
Ph, исходный фон в позе лёжа |
Vm, маневр Вальсальвы-Бюркера |
рА, проба Ашнера-Даньини |
Aор, активная ортостати-ческая проба |
PWC120 тред-мил-тест до ЧСС120 в мин. |
|
σl%, спектр. доля гуморальн. волн VLF% |
55,76±16,51 36,81±4,92 Z=13.06 |
66,41±19,46 32,21±3,21 Z=25.6 |
63,93±20,01 51,68±5,07 Z=8.39 |
66,10±17,05 41,94±5,09 Z=18.6 |
49,31±20,78 40,45±5,77 Z= 5.72 |
|
σm%, cпектр. доля симпатич. волн – LF% |
18,33±10,37 23,76±3,6 Z=6,5 |
15,30±8,40 24,3±2,8 Z=13,5 |
15,91±13,99 23,92±4,49 Z=7,33 |
19,50±15,19 38,65±4,99 Z=16,0 |
17,32± 10,43 23,75±5,09 Z=6,51 |
|
σs%, спектр. доля парасимпат. волн – HF% |
25,90±15,83 39,41±4,8 Z=11,1 |
20,83±17,65 41,8±2,4 Z=13,3 |
20,14±14,8624,4±3,81 Z=3,94 |
14,39±13,03 19,41±3,04 Z=10,4 |
33,36±19,38 35,79±5,4 Z=1,68 |
|
∆ RR % макс. реакция относительно исхода |
- |
10,68± 9,97 12,1±2,41 Z=1,84 |
8,45± 9,88 13,2±1,52 Z=6,95 |
20,90±7,00 30,0±1,91 Z=17,6 |
16,81±10,01 39,01±5,41 Z=12,1 |
|
tAB,c время достижения макс. реакции |
- |
7,26±2,51 2,006± 0,001 Z=13.5 |
6,11±2,77 4,215±0,002 Z=10,9 |
16,93± 8,8 5,121±0,005 Z=11,3 |
47,97±13,45 15,87±1,23 Z=17,2 |
|
tr,c время восстановле-ния © |
- |
15,19±13,56 20,3±2,2 Z=5,64 |
20,31±25,06 4,038±0,001 Z=10,4 |
20,31±13,6 7,015±0,003 Z=15,6 |
84,11±29,04 56,81±10,7 Z=11,4 |
Примечание: здесь и в других таблицах принят аналог критерия Стьюдента–Z для сравнения средних значений для независимых выборок большого объёма. Уровень значимости различий между 1,96 и 2,3 с 5% и 1% ошибкой соответственно.
Выявлен РКГ симптом ишемического эпизода в виде предельно выраженного угнетения симпато-парасимпатической регуляции в СУ и участка стабилизации сердечного ритма (рис. 1), когда визуально на ритмокардиограмме регистрируется участок без волн ВСР, обычно коррелирующий по продолжительности с клиническими признаками стенокардии и/или депрессией ST (r= 0,387-0,472, то есть – значимо). При существующей ныне недостаточной чувствительности экранов мониторов эти участки ишемии так и выглядят. Это та часть ритмокардиограммы, в которой разница между соседними интервалами находится в пределах 3,55±1,02 миллисекунды.
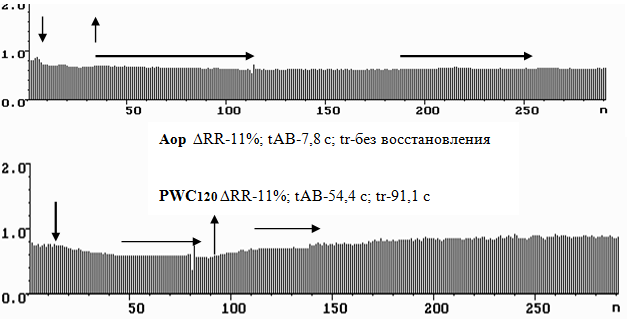
VLF% LF% HF%
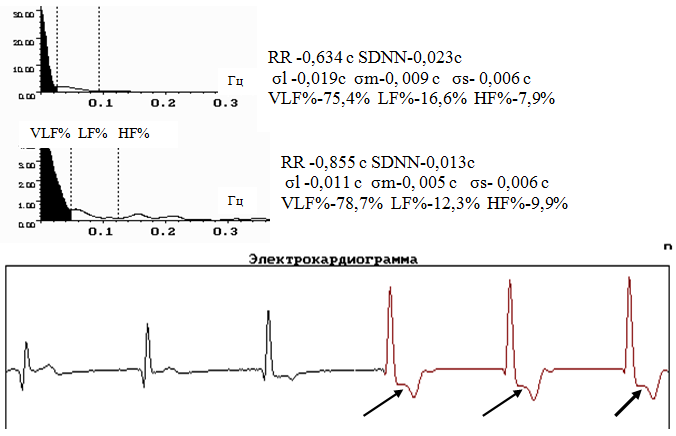
Рис. 1. Ритмокардиограммы, спектрограммы и цифровые значения показателей ВСР больного ИБС с СтСт II ФК в пробах Aop и PWC120. Видна сниженная амплитуда волн ВСР ( при норме SDNN =0,050±0,004 с; σl=0,032±0,004 c; σm= 0,03±0,003 c; σs=0,021±0,002 c). Патологически изменённое соотношение спектральных долей влияния факторов регуляции в СУ с угнетением симпато-парасимпатической регуляции пейсмекерной активности и значительным увеличением гуморально-метаболического воздействия, неадекватного и недостаточного (при норме: VLF%=41,94 ±5,09%; LF%=38,65± 4,99%; HF%=19,41± 3,04%). Снижена реакция на переход в Аор, увеличено время её достижения и время восстановления (DRR, tAB, tr). Вертикальными стрелками отмечены начало и конец периода стимуляции в пробе. Горизонтальные стрелки показывают ишемические эпизоды стабилизации ВСР, сопровождающиеся депрессией ST. От 140 до 170 интервалов в PWC миграция водителя ритма по СУ и предсердиям в виде нерегулярных единичных удлинений RR.
Патогенетически такая ситуация обусловлена ухудшением перфузии СУ в момент вазоконстрикции над атеросклеротической бляшкой из-за эндотелина-1, доводящего окклюзию венечных сосудов до критического 70-80%-ного уровня. Особенно если эта окклюзия прямо или опосредованно касается правой огибающей ветви венечной артерии, от которой отходит артерия синусового узла. Возникает оглушённость пейсмекерных клеток, не отвечающих на симпато-парасимпатические импульсы, физиологически ответственные за флуктуации продолжительности межсистолических интервалов.
У каждого пациента на РКГ были зарегистрированы выше описанные участки значительно сниженной ВСР, сопровождавшиеся у 230 (89,8%) больных либо депрессией ST, либо клиническими проявлениями приступа стенокардии, либо и тем и другим, вместе взятыми. Результат совпадал с данными исследования М.В. Миронова (2003). Ни у одного из лиц контрольной группы таких изменений не было найдено. Подсчитана суммарная величина таких эпизодов ишемии. Она составила в среднем 4,83± 2,33 минуты на 1 пациента у 80 больных со СтСт II ФК. Ишемические эпизоды возникали у 68 больных в Аор и при нагрузке на тредмиле, а у 12 ещё и в рА сразу после прекращения стимуляции глазо-сердечного рефлекса. У 154 пациентов со СтСт III ФК ишемические эпизоды в среднем были продолжительнее до 13,34±8,73 мин, и возникали они хаотично в любых позициях. Особенно сложно было распознать названные участки у 72 пациентов со СтСт IV ФК, когда исходно вся РКГ представляла собой график интервалов с ровным, без флуктуаций верхним краем. Компьютерный подсчёт спектральных долей и амплитуд l, m, s – волн ВСР относится к высокоточному компьютерному определению колебаний уровня РКГ с патогенетически понятным перевесом в сторону гуморально-метаболических волн. Визуально же при существующей чувствительности экранов мониторов такие колебания не различимы. У всех больных со СтСт IV ФК была автономная кардионейропатия. Фактически у названной категории пациентов ишемические эпизоды можно было распознать по комплексу клинических, ЭКГ и РКГ признаков. Суммарно они составили 17,11±5,43 минуты на каждого пациента в среднем. Показатель высокий с учётом 25-минутной записи РКГ в разных пробах. Нагрузочная проба была сокращена из-за исходного состояния пациентов, а также из-за исходного учащения ритма до 0,500-0,600 с. Дозированный по ЧСС уровень достигался быстро, через 4-6 шагов на тредмиле, и ходьбу приходилось прекращать. В подгруппе больных со СтСт II ФК у 18 (60%) пациентов эпизоды ишемической стабилизации ритма на РКГ сочетались с депрессией ST и клиническими проявлениями стенокардии. В 25 случаях порог ишемии был фиксированным, в 5 он был вариабельным. На РКГ эпизоды стабилизации были зарегистрированы после нагрузки в PWC120 и в Аор после перехода в активный ортостаз, но в 5 случаях в Vm и pA были зарегистрированы короткие эпизоды стабилизированной РКГ без ЭКГ и клинических симптомов стенокардии. При СтСт III ФК во всех 154 случаях ишемический порог был вариабельным и участки стабилизации были зарегистрированы во всех позициях. СтСт IV ФК сопровождалась автономной кардионейропатией с продолжительными приступами стенокардии, депрессией ST и клиническими симптомами ишемических эпизодов. Вазоспастическая форма ишемических эпизодов манифестировалась появлением низкоамплитудных симпатических флуктуаций перед участками или после участков стабилизации, сочетающихся с депрессией ST и загрудинными болями в 4-х случаях СтСт II ФК, при 102 (66%) случаях – со СтСт III ФК стенокардии, когда хоть какая-то волновая структура ВСР была ещё различима, хотя и сниженная. В условиях хронического ишемического процесса такая стабилизация ритма может быть связана с состоянием самих пейсмекерных клеток СУ. Это и объясняет снижение всех составляющих ВСР. Обращала внимание амплитуда изменений показателей ВСР в пробах. У больных ИБС она существенно меньше. Автономные же показатели – симпатический – σm и парасимпатический – σs, судя по характеристикам волновой структуры ВСР, вообще не отреагировали на воздействие стимулов в пробах, что подтверждает нарушения в самих клетках СУ, возможно, необратимые, поскольку направленность стимулов в пробах была различной. В подгруппе СтСт II ФК у 18 (60%) пациентов эпизоды ишемической стабилизации ритма на РКГ сочетались с депрессией ST и/или клиническими проявлениями стенокардии. В 25 случаях порог ишемии был фиксированным, в 5 он был вариабельным. На РКГ эпизоды ишемии были зарегистрированы после нагрузки в PWC120 и в Аор после перехода в активный ортостаз, но в 5 случаях в Vm и pA были зарегистрированы короткие эпизоды стабилизации РКГ без специфических ЭКГ изменений и клинических симптомов стенокардии.
У больных со СтСт III ФК во всех 154 случаях ишемический порог был вариабельным и участки стабилизации были зарегистрированы во всех позициях. Изменения РКГ у больных СтСт IV ФК сопровождались автономной кардионейропатией с продолжительными приступами стенокардии, депрессией ST и клиническими симптомами ишемических эпизодов. Вазоспастическая форма ишемических эпизодов манифестировалась появлением низкоамплитудных симпатических флуктуаций перед или после участков стабилизации, сочетающихся с депрессией ST и загрудинными болями в 4-х случаях СтСт II ФК, при 102 (66%) случаях со СтСт III ФК, когда хоть какая-то волновая низкоамплитудная структура ВСР была ещё различима.
Выделены характерные для ИБС симптомы РКГ, которые могут быть учтены при диагностике хронического ишемического процесса в сердце, а также при отборе больных на КШ. Ими были: снижение амплитуды всех волн ВСР, снижение реакции сердечного ритма на переход в активной ортостатической пробе параллельно снижению коронарного резерва сердца, снижение реакций ритма в ответ на действие стимулов во всех пробах (ΔRR), увеличение времени достижения максимальной реакции в пробах (tAB), а также восстановления после действия стимула (tr), изменение спектрального соотношения регулирующих факторов в СУ с увеличением влияния гуморального фактора (VLF%) за счёт снижения симпато-парасимпатического действия (LF%, HF%), а также увеличение частоты и продолжительности ишемических эпизодов на РКГ в соответствии с увеличением ФК стенокардии, снижение ишемического порога, переход фиксированного порога ишемии в вариабельный, появление вазоспастических форм стенокардии по данным ВСР.
Проведён анализ состояния пациентов, перенёсших КШ, до и через неделю после реваскуляризации (табл. 3 и 4), когда РКГ-исследование стало возможным с использованием нагрузки на тредмиле, дозированной, как и до КШ, по ЧСС120. Названный уровень достигался значительно быстрее, чем до КШ, но зато полученные данные были сравнимы, а мощность нагрузки соответствовала состоянию пациентов. В этот анализ включены показатели ВСР вегетативного статуса в пяти позициях, а также продолжающегося восстановления исходной длительности межсистолических интервалов после нагрузки – PWC120. В этом сравнении зависимых парных выборок получены достоверные различия показателей ВСР до КШ и через неделю после КШ по всем показателям и во всех позициях исследования РКГ. Снизилось среднее значение RR (ЧСС увеличилась, что и объясняло быстрое, иногда через 3-4 шага, достижение искомой ЧСС во время нагрузки). Это снижение стойко сохранялось в пробах. Колебания значений среднего RR от пробы к пробе были существенно меньше, чем в норме, и даже до КШ, свидетельствуя о снижении адаптационных возможностей кардиоваскулярной системы после операции. Это подтверждалось и достоверным снижением значений средних отклонений показателя общей колеблемости волн ВСР – SDNN. До КШ исходно низкий, этот показатель снизился в 2 и более раз, стойко и достоверно по всем позициям. По принадлежности к конкретным факторам регуляции в СУ результаты анализа ВСР показали значительное снижение амплитуды флуктуаций после КШ (рис. 2 и 3). Это приближало ситуацию к автономной кардионейропатии (АКН). У каждого из трёх показателей (σl, σm, σs) после КШ среднеквадратическое отклонение исчислялось единицами миллисекунд, почему и требовалось высокое разрешение аппаратно-программного обеспечения. Снижение значений показателей было стойким во всех постстимульных периодах проб, манифестируя патологическую ареактивность с высокой достоверностью.
Таблица 3 – Временные статистические ВСР-показатели у больных ИБС до коронарного шунтирования (верхняя строка, n=123) и после коронарного шунтирования (нижняя строка, n=123)
|
РКГ показатели (M ± s) в секундах (с)
|
Ph, исходный фон в позе лёжа |
Vm, маневр Вальсальвы-Бюркера |
рА, проба Ашнера- Даньини |
Aор, активная ортостати-ческая проба |
PWC120 тред- мил-тест до ЧСС120 в мин. |
PWC120 восстанови-тельный период |
|
RRс cредний интервал |
0,984±0,144 0,768±0,114 T=12,0 |
1,007±0,137 0,780±0,112 T=15,1 |
1,012±0,139 0,777±0,107 T=19,6 |
0,852±0,137 0,698±0,095 T=12,8 |
1,017±0,157 0,783±0,124 T=13,24 |
1,031±0,142 0,791±0,114 T=20,0 |
|
SDNN c, cреднекв. откл-е всех волн ВСР |
0,024±0,009 0,012±0,006 T=17,21 |
0,027±0,013 0,011±0,005 T=36,3 |
0,027±0,016 0,011±0,006 T=36,3 |
0,019±0,008 0,009±0,004 T=14,2 |
0,023±0,010 0,013±0,005 T=12,5 |
0,026±0,010 0,011±0,005 T=15,0 |
|
σl, средне-квадр. откл-е гуморальных волн ВСР |
0,018±0,008 0,008±0,004 T=14,2 |
0,022±0,011 0,008±0,004 T=17,5 |
0,022±0,015 0,008±0,004 T=14,0 |
0,015±0,005 0,007±0,003 T=26,6 |
0,015±0,006 0,008±0,003 T=10,0 |
0,020±0,009 0,008±0,003 T=17,1 |
|
σm, средне-квадр. откл-е симпатич. волн ВСР |
0,009±0,004 0,004±0,002 T=16,6 |
0,009±0,006 0,004±0,002 T=12,5 |
0,009±0,005 0,004±0,002 T=16,6 |
0,008±0,006 0,003±0,002 T= 12,5 |
0,008±0,004 0,005±0,003 T=6,8 |
0,010±0,004 0,004±0,002 T=20,0 |
|
σs, средне квадр. откл-е парасимпатич. волн ВСР |
0,011±0,005 0,007±0,006 T=12,9 |
0,011±0,005 0,006±0,003 T=20,0 |
0,011±0,006 0,006±0,004 T=12,0 |
0,007±0,003 0,004±0,003 T=2,54 |
0,014±0,009 0,007±0,005 T=8,75 |
0,012±0,006 0,006±0,004 T=12,0 |
Примечание: здесь принят критерий Стьюдента–Т при сравнении средних значений для зависимых выборок большого объёма. Выделенные жирным шрифтом значения значимо отвергают гипотезу равенства сравниваемых вариационных рядов.
АКН была у 51 (41,46%) пациента после КШ (p<0,01), то есть чаще, чем до КШ – у 29 (11,3%) лиц. При анализе периодов стимуляции выявлено ещё большее, чем до КШ, снижение реагирования на все пробы. Эти реакции часто не были визуально заметными при существующем разрешении экранов. Величина отклонений показателей ВСР была высокой, что предполагало наличие в выборке случаев без реагирования в пробах. Такие случаи после КШ можно было отнести к сформированной АКН с высоким риском, по данным большинства исследователей, летального исхода. В постуральном переходе Аор и PWC120, до и после КШ, tAB был значительно больше нормы. До КШ у больных ИБС максимум реагирования при нагрузке достигался в 3 раза медленнее нормы, после же КШ ещё медленнее. Это тоже было ожидаемо, поскольку клинически в раннем периоде после КШ состояние прооперированных лиц оставалось тяжелым. Восстановление после действия стимулов в пробах (tr) замедлилось значимо с высокой достоверностью (p<0,01-0,001). В спектральном же соотношении значений показателей ВСР регулирующих факторов в СУ после КШ (табл. 4) были выявлены некоторые положительные сдвиги. Показатели спектрального анализа отличались от статистических показателей. В 1981 году он был предложен для анализа ВСР специалистом, далёким от клинической медицины – астрономом по специальности профессором Тель-Авивского университета С. Аксельрод для разделения волн ВСР на периодические составляющие.
Таблица 4 – Спектральные показатели соотношения факторов, регулирующих пейсмекерную активность синоатриального узла сердца, и результаты анализа периодов стимуляции у больных ИБС до коронарного шунтирования (верхняя строка, n=123) и после коронарного шунтирования (нижняя строка, n=123)
|
РКГ показатели (M ±s) в сек. (с) и %, критерии t |
Ph, исходный фон в позе лёжа |
Vm, маневр Вальсальвы-Бюркера |
рА, проба Ашнера-Даньини |
Aор, активная ортоста- тическая проба |
PWC120 тредмил-тест до ЧСС120 в мин. |
тредмил- тест, восстанови-тельный период |
|
σl%, спектр. доля гуморальн. волн – VLF% |
56,39±14,89 55,10±21,33 Т= 1,12 |
67,26±16,30 54,64±18,34 T=3,49 |
65,31±16,42 60,19±19,98 T=5,66 |
65,36±16,23 59,20±19,64 T=6,37 |
47,87±19,35 46,46±24,39 T= 0,87 |
38,80±19,46 53,94±24,54 T= 11,5 |
|
σm%, cпектр. доля симпатических волн – LF% |
17,84±10,83 12,33±7,03 T=6,15 |
11,60±5,82 15,77±13,99 T=11,2 |
13,75± 10,0 12,98±10,88 T=0,85 |
18,91±14,22 12,89±12,32 T=5,65 |
14,64± 7,79 17,87±11,98 T=6,61 |
17,55±10,95 13,85±9,22 T = 4,52 |
|
σs%, спектр. доля парасимпат. волн – HF% |
25,76±12,53 32,56±21,97 T=6,0 |
21,12±16,18 29,58±17,84 T=5,8 |
20,93±12,7526,88±17,61 T=5,2 |
15,72±11,24 27,90±21,31 T=11,3 |
37,48±19,12 35,66±24,11 T=1,05 |
23,64±16,41 32,19±24,63 T=9,17 |
|
∆ RR % макс. реакция относительно исхода |
- |
11,59± 9,96 6,48±6,13 T =5,8 |
7,95± 6,87 4,12±3,60 T=6,41 |
21,69±8,07 12,31±6,78 T =13,0 |
19,23±11,26 9,62±7,21 T =9,58 |
- |
|
tAB,c время достижения макс. реакции |
- |
7,78±2,58 6,22 ± 2,56 T = 7,09 |
6,38±2,47 5, 55±2,38 T =4,16 |
17,61± 6,39 41,99±30,82 T =57,2 |
43,85 ±12,96 50,0±12,16 T =12,6 |
- |
|
tr,c время восстановления (c) |
- |
7,48±4,71 12,73± 8,61 T =6,9 |
14,47±11,98 20,61±7,85 T = 8,8 |
15,05±15,74 12,03±6,26 T =5,5 |
79,06±37,71 92,06±42,21 T =11,8 |
- |
Примечание: здесь принят критерий Стьюдента–Т при сравнении средних значений для зависимых выборок большого объёма. Выделенные жирным шрифтом значения значимо отвергают гипотезу равенства сравниваемых вариационных рядов.
Предложение было гениальным, поскольку к тому времени не было математического решения для соблюдения закона «акцентированного антагонизма» в соотношении двух отделов автономной системы, физиологически зависимых друг от друга. Введение в анализ спектральных показателей предоставило возможность не только дифференцированной оценки двух отделов ВС, но и нивелировало значимость названного закона, что потребовало совмещения в единой математической обработке двух видов анализа во временной статистической и частотной областях. Зато чувствительность спектральных характеристик оказалась более высока, чем при применении одного лишь статистического анализа. В представляемом исследовании все статистические ВСР-показатели манифестировали однонаправленное ухудшение состояния вегетативной регуляции после КШ. По результатам же частотного анализа во всех позициях доля влияния в СУ гуморально-метаболической среды снизилось за счёт усиления протектирующего парасимпатического. Достоверность таких сдвигов была высокой в нагрузочных пробах Aop и PWC2. Это считается положительным в распределении влияния регулирующих факторов в СУ и объясняет отсутствие ишемических изменений ЭКГ и клинических проявлений стенокардии во всех случаях, даже при выполнении Аор и PWC, хотя дизрегуляция пейсмекерной активности СУ была выраженной после КШ по сравнению со всеми анализируемыми показателями ВСР.
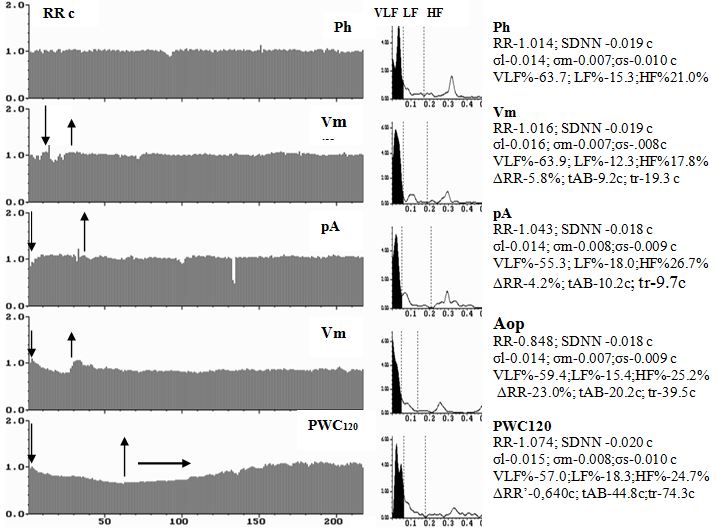
Рис. 2. Ритмокардиограммы, спектрограммы, средние значения показателей ВСР, спектральных данных и периодов стимуляции у пациента М.со стабильной стенокардией 2ФК до коронарного шунтирования. Видна ВСР со сниженной амплитудой, сниженные реакции на стимулы в пробах (начало и конец стимулов отмечены вертикальными стрелками). В нагрузочной пробе PWC120 сразу после ходьбы на тредмиле участок стабилизации ритма – отмечен горизонтальной стрелкой, соответствующий эпизоду ишемии с типичными загрудинными болями и депрессией ST на ЭКГ. В спектральном распределении влияния регулирующих факторов в СУ наибольшая доля принадлежит гуморально-метаболическому (VLF%) руководству ритмом, медленному и неадекватному.

Рис. 3. Ритмокардиограммы, спектрограммы и средние значения показателей ВСР того же больного М. после КШ. Выраженная стабилизация ВСР на фоне умеренной тахикардии, амплитуды симпатических (σm), парасимпатических( σs) и даже гуморальных волн ВСР(σl) исчисляются единицами миллисекунд, отсутствуют реакции на стимулы, на спектрограммах, и в спектральных значениях ВСР преобладает гуморально-метаболическая периодика (VLF% – чёрный цвет на спектрограмме) – регуляция в СУ соответствует автономной кардионейропатии с повышением риска летального исхода.
Спустя неделю после КШ пациенты чувствовали себя хуже, однако ни одного из них не беспокоили загрудинные боли. На момент повторного исследования РКГ пациенты переживали ранний послеоперационный период, что формализованным образом нашло отражение на РКГ. Через 1 неделю при повторной РКГ были зарегистрированы положительные сдвиги, хотя общее самочувствие в виде слабости, астении, недостаточной кардиоваскулярной адаптации субъективно были выраженными. Позитивные сдвиги в послеоперационной группе проявились в изменении соотношения регулирующих факторов в СУ. Доля гуморально-метаболического влияния (VLF%) во всех позициях РКГ стойко снизилась, увеличилось парасимпатическое воздействие (HF%), которое исследователи ВСР обоснованно из-за особенностей взаимоотношений пейсмекерных клеток СУ и вагусной регуляции считают протективным [8].
Обследовано 123 пациента интраоперационно во время проведения КШ на открытом сердце, с применением аппарата искусственного кровообращения (АИК) с остановкой сердечной деятельности. Исследование проводилось после премедикации без проведения вегетативных нагрузочных проб. Для оценки состояния вегетативных дизрегуляций во время этапов операции, исключая период остановки сердца, проводилось мониторирование вариабельности сердечного ритма методом ритмокардиографии с использованием КАП РК-02 «Микор» (Челябинск), предназначенным специально для регистрации и оценки вариабельности межсистолических интервалов с высоким разрешением (1000 ± 5 мс). Эпизоды записей по 300 кардиокомплексов автоматически регистрировались, накапливаясь в файл с компьютерным анализом, сохранением мониторной записи ЭКГ в архиве, результаты которого выводились на экран монитора, продолжая одновременно мониторную запись с выведением каждого интервала в виде вертикальных отрезков, последовательно выстраиваемых в ритмокардиограмму (рис. 1). Весь ход операции с отметкой времени этапов анестезиологического и хирургического вмешательств, указанием вводимых препаратов и врачебных манипуляций можно проследить в сопоставлении с изменением межсистолических интервалов в графическом режиме и с анализом 300 интервальных фрагментов после автоматической программной и ручной коррекции артефактов, обусловленных электрическим воздействием электроножа, прямых манипуляций с сердцем. Регистрировались эпизоды развития остановки сердца под влиянием введения медикаментов в ходе подготовки к переводу на ИК, восстановления сердечной деятельности после окончания шунтирования.
Осуществлялся мониторинг РКГ на фоне стандартных премедикации и наркоза. Из-за возникновения артефактов исключалась запись во время работы электроножа. Во время остановки работы сердца РКГ также не проводилась. РКГ проводилась интраоперационно в период ввода в наркоз, интубации, канюляции аорты и полых вен, введения кардиоплегической смеси и гипотермии вплоть до остановки сердца и перевода на АИК. Во время проведения КШ трепетание предсердий (ТП), как вариант предсердной тахикардии, возникало чаще других нарушений сердечного ритма (НСР) – у 106 (86,1%) оперированных пациентов. ТП достоверно регистрировалось при проведении канюляции предсердия с целью подготовки к кардиоплегии. Ему предшествовали ЭКГ изменения в виде снижения амплитуды зубца Р, нарушения (замедления) межпредсердной проводимости, предсердная экстрасистолия, суправентрикулярная пароксизмальная тахикардия, связанная с манипуляциями в области предсердий. Отсутствие снижения амплитуды зубца Р на ЭКГ, нарушений межпредсердной проводимости перед операцией КШ снижало вероятность интраоперационного развития ТП у больных с СтСт. Желудочковые нарушения сердечного ритма встречались чаще во время манипуляций с желудочками сердца, при пережатии аорты, и зарегистрированы у 96 (77%) пациентов. Желудочковая тахикардия, фибрилляция желудочков возникали чаще перед искусственной остановкой сердца непосредственно перед проведением КШ. Если полная остановка не состоялась, операция продолжалась на фоне низкоамплитудных желудочковой тахикардии (ЖТ) или фибрилляции желудочков (ФЖ). Идиовентрикулярный ритм зарегистрирован у 97 (80,5%) больных, чаще у тех, кто в предоперационном имели значительное снижение ВСР и склонность к брадикардии, замедлению функции проводимости. Во время же проведения кардиохирургического вмешательства эпизоды идиовентрикулярного, чаще ускоренного, ритма были зарегистрированы во время введения кардиоплегического раствора.
Перед началом ИК проводилось болюсное введение фентанила 0,2-0,4 мг. Адекватность анестезии оценивалась на основании мониторирования неинвазивных и инвазивных интегральных показателей гемодинамики АД, ЧСС, ЦВД, динамики показателей глюкозы, лактата и газов крови, кислотно-основного равновесия, поддержки гематокрита, диуреза. Регистрация РКГ перед остановкой сердца и непосредственным проведением шунтирования целесообразна с точки зрения регистрации нарушений сердечного ритма, поскольку их интраоперационное развитие связано с исходным аритмогенным фоном (степенью снижения общей вариабельности всех волн ритма, исходными эпизодами ишемической вегетативной денервации, изменениями ЭКГ – межпредсердная блокада, снижение амплитуды зубцов предсердного комплекса).
Обратимая ишемическая дисфункция миокарда играла одну из ключевых ролей в развитии нарушений ритма сердца при хирургической реваскуляризации у больных, оперированных по поводу СтСт коронарным шунтированием. Частота возникновения аритмий возрастала у пациентов со сниженной сократительной способностью миокарда. Для проведения ИК проводилась канюляция полых вен и аорты. В состав перфузата, помимо белковых препаратов, глюкозы, солевых растворов, входил калий для остановки кровообращения. Перемещение перфузата в кровеносное русло осуществлялось под контролем ЦВД, АД, ЭКГ и РКГ. Начало ИК сопровождалось быстрым снижением АД, ЦВД с преобладанием венозного депонирования крови над поступлением её в аорту, снижением гемодилюции, непульсирующим потоком. Анестезия во время ИК поддерживалась барбитуратами, нейролептаналгезией, недеполяризующими миорелаксантами (тиопентал натрия, фентанил, ардуан). Для защиты миокарда от ишемического повреждения применялась нормотермическая или гипотермическая кардиоплегия. После достижения необходимой температуры накладывался зажим на аорту, после чего прекращалась сердечная деятельность. В период окончания операции КШ выполнялось постепенное согревание. Если не происходило самостоятельного восстановления сердечной деятельности после снятия зажима с аорты, на ЭКГ и РКГ регистрировалась ФЖ, выполнялась электрическая дефибрилляция сердца. При развитии асистолии проводился прямой массаж сердца, подключался электрокардиостимулятор. Исследование РКГ включало регистрацию ритмокардиограммы на этапах подготовки и проведения интубации, наркоза, канюляции, подключения к АИК, восстановления сердечной деятельности после операции, завершения операции.
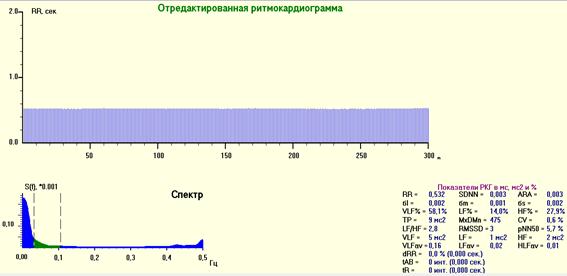
Рис. 4. РКГ, спектрограмма и средние значения показателей ВСР после премедикации. Выраженная стабилизация ритма. На спектрограмме переход сердечного ритма на гуморальную регуляцию – увеличение очень низкочастотных волн (VLF%) в спектре ВСР наибольшая спектральная плотность в диапазоне 0-0.003 Гц, 58,1% (норма – <40%).
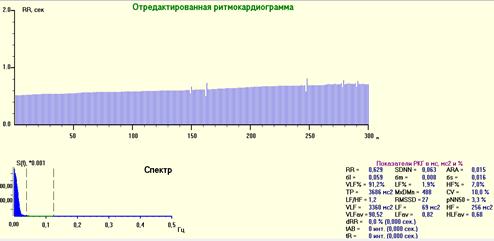
Рис. 5. РКГ, спектрограмма и средние значения показателей ВСР при вводном наркозе. Парасимпатические высокочастотные (HF%) и симпатические волны (LF%) значительно снижены. Визуально они отсутствуют. Дифферент начала и окончания Ркг регистрируется программой, как часть гуморальной флуктуации большого периода. Видны редкие поздние экстрасистолы с разными преэкстрасистолическими интервалами.
ULF
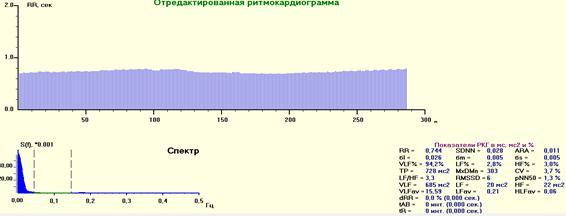
Рис. 6. РКГ, спектрограмма и средние значения показателей ВСР при интубации. Видно отчётливое увеличение амплитуды и длины волны очень большого периода (> 60 сек.) – ULF(Ultra Low Frequency).
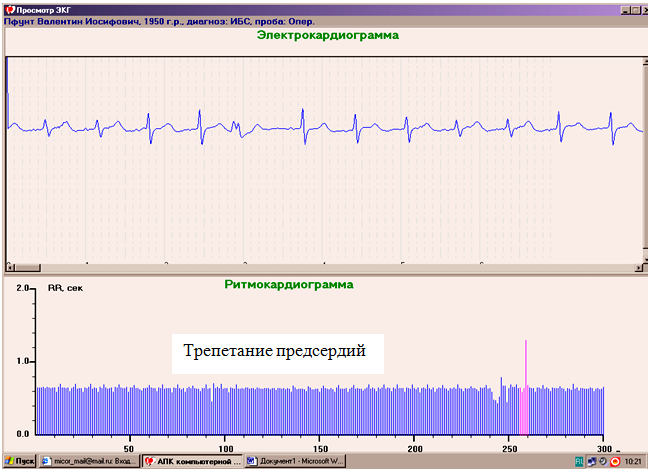
Рис. 7. РКГ и ЭКГ при канюляции сосудов. На мониторной ЭКГ снизилась амплитуда предсердных зубцов, изменялась их форма и направленность, отмечены признаки электрической альтернации, изменилась высота зубцов желудочкового комплекса. На РКГ зарегистрированы элементы миграции водителя ритма по предсердиям в виде низкоамплитудных удлинений и укорочений межсистолических интервалов.
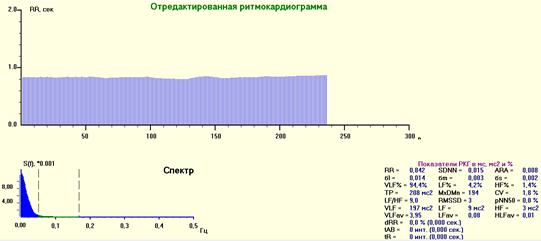
Рис. 8. РКГ, спектрограмма, средние значения показателей ВСР при введении в интубационный наркоз. Увеличение амплитуды и количества гуморальных VLF-волн, что отражало полное отсутствие собственной регуляторной активности.
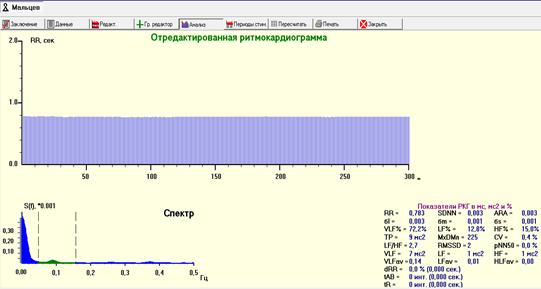
Рис. 9. РКГ, спектрограмма и средние значения показателей ВСР во время интубационного наркоза. Продолжение наркоза сопровождалось полной утратой контроля, включая и гуморально-метаболический в виде отсутствия любых волн ВСР.
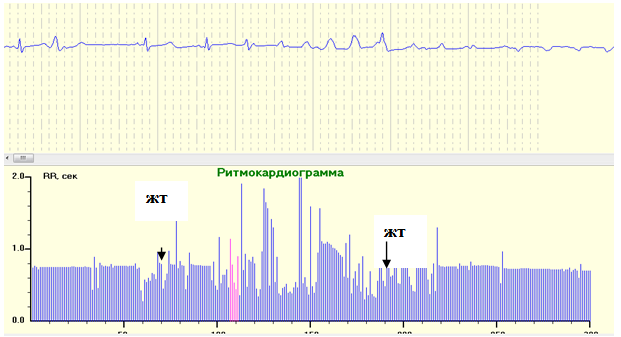
Рис. 10. РКГ и ЭКГ во время установки зажима на аорте. Установка зажима на аорте прекращает поступление крови в аорту из полости левого желудочка с одновременным подключением крови из АИК и введением кардиоплегической смеси. Манипуляции с желудочками сердца вызывают желудочковые нарушения сердечного ритма в виде множественных полифокусных желудочковых экстрасистол и заместительных ритмов, эпизодов желудочковых тахикардий (ЖТ).
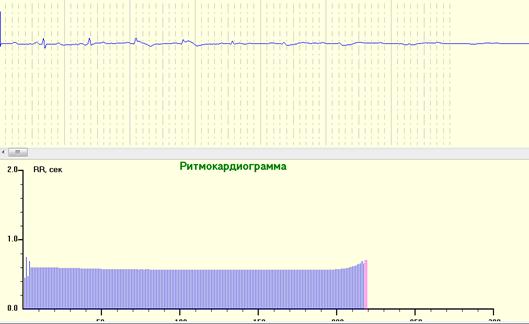
Рис. 11. РКГ и ЭКГ во время остановки сердца. Постепенное сокращение межсистолических интервалов параллельно снижению амплитуды желудочковых ЭКГ-комплексов, хотя минимальную сердечную деятельность можно было наблюдать по мониторной ЭКГ в виде неэффективных низкоамплитудных желудочковых сокращений с последующим развитием полной асистолии. ВСР свидетельствовала об отсутствии вегетативного и гуморального влияния на регуляцию сердечной деятельности.
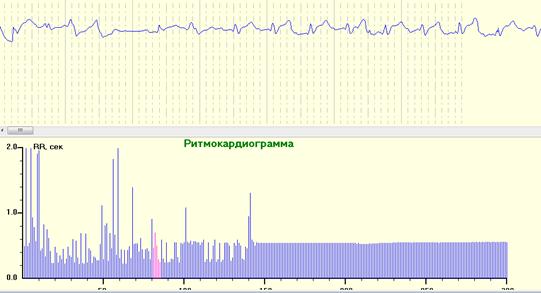
Рис. 12. РКГ и ЭКГ во время снятия зажима с аорты. Снятие зажима с аорты и прямой массаж сердца восстановили сердечную деятельность с постепенным формированием нормальной ЭКГ, одновременно с восстановлением низковариабельной РКГ.
В рисунках 4-12 представлены основные этапы КШ на открытом сердце, как примеры применения РКГ при кардиохирургическом вмешательстве.
При скомпрометированных предсердиях при обследовании перед КШ (на ЭКГ альтернация размеров, направленности, двухфазность зубцов Р, изменения продолжительности интервалов PQ, а также высоты зубца R) возникали нарушения ритма сердца, как правило, у пациентов на фоне выраженного снижения или стабилизации ВСР и при отсутствии или снижении реакций в пробах с медленным достижением максимальной реакции и медленным восстановлением (что соответствовало характерным РКГ-симптомам ИБС) в предоперационном периоде и до остановки сердца и подключения к АИК. Выраженное снижение ВСР и отсутствие реакций в пробах перед КШ были предикторами нарушений ритма во время вмешательства, в том числе гемодинамически значимых в настоящем исследовании. Все периоды – введение в наркоз, канюляция вен и аорты, гипотермия, введение кардиоплегической смеси с калием имели характерное в большинстве случаев визуально узнаваемое отражение на ритмокардиограмме.
До остановки сердца, а также при запуске его сократительной деятельности возникало истинное трепетание предсердий (ТП) 1:2, 1:3, 1:4 по механизму macro re-entry вокруг трёхстворчатого клапана на фоне наркоза у 86 (69,9%) больных (рис. 10). В вопросе о дифференцированном отношении к ТП и инцизионной тахикардии, патофизиологически различных вариантах аритмии, к истмус-зависимости ТП, как главному отличию от инцизионной тахикардии, в обсуждаемых случаях можно добавить исходно связанные с предсердиями ЭКГ-изменения, а также явную связь возникновения ТП с локализацией хирургических манипуляций, а именно в предсердиях.
После канюляции вен и аорты, введении кардиоплегической смеси (КПС) и гипотермии, регистрировалась ФЖ с последующим развитием асистолии (рис. 5 и 13). С исходно низкого уровня ВСР во время наркоза амплитуда волн ВСР ещё больше снижалась, первыми исчезали волны быстрой регуляции – сначала протективные парасимпатические колебания, затем симпатические, и в последнюю очередь гуморальные. Предсердные и желудочковые экстрасистолы предшествовали полному исчезновению ВСР (n-48, p<0,001). Регуляция ВСР переключалась на гуморально-метаболический низкоамплитудный уровень (VLF%=67,1-85,4%), затем ритм полностью стабилизировался, что соответствовало полному наркозу. В 38 (30,9%) случаях возникали пробежки учащения ритма, регистрировались признаки нарушений межпредсердной проводимости из-за блокады пучка Бахмана, миграция водителя ритма по предсердиям и узловые комплексы, асистолия предсердий в виде снижения высоты зубца Р, его удлинения и двухфазности, увеличение индекса Макруза. При введении КПС на фоне угнетения амплитуды ВСР снижался охват возбуждением желудочков сердца, на ЭКГ снижалась амплитуда зубцов R, но ещё некоторое время сохранялись зубцы Р с постепенным снижением высоты и увеличением их продолжительности, которые можно оценивать, как предикторы ТП. Чем сохраннее были исходная ВСР и её реакции в пробах на этапе отбора больных для операции, зубец Р и интервал PQ, ниже индекс Макруза, тем меньше была вероятность развития гемодинамически значимого ТП (r=-0,397-0,456), более положителен был конечный результат хирургического вмешательства в отношении аритмий. Высокоточный компьютерный анализ ВСР, определяющий актуальное состояние автономной и гуморально-метаболической регуляции пейсмекерной активности СУ сердца, является информативным методом анестезиологического ведения больных при интервенционных кардиохирургических вмешательствах. Изменения волновой структуры ВСР перед операциями и во время этапов интервенционного вмешательства, так же как и кардиоаритмии, имели характерные особенности. Если при исследовании РКГ регистрировалась автономная кардионейропатия со стабилизацией ВСР с предельно выраженным угнетением симпато-парасимпатической волновой структуры ВСР, отсутствием какого-либо реагирования на любые стимулы в пробах, то риск возникновения ТП и других аритмий во время шунтирования повышался. В анализируемой группе пациентов ТП зарегистрировано в 86 (69,9%) случаях.
Таким образом, в проведённом периоперационном исследовании с оценкой периферической вегетативной регуляции синусового узла сердца при кардиохирургической реваскуляризации миокарда коронарным шунтированием выявлено достаточно полезных для кардиохирургии данных, которые, не претендуя на окончательный результат, позволяют, тем не менее, предположить перспективность применения ритмокардиографии при интервенционных вмешательствах.
Выводы
1. Ритмокардиография высокого разрешения с анализом вариабельности сердечного ритма (ВСР) является методом актуальной оценки нарушений автономной и гуморально-метаболической регуляции пейсмекерной активности синоатриального узла сердца, ассоциирующейся с кардиоваскулярным статусом пациентов, предназначенных и перенёсших реваскуляризацию миокарда с помощью коронарного шунтирования, что является перспективным для кардиохирургии.
2. В предоперационном периоде анализ ВСР содержит дополнительные симптомы интранозологической диагностики, характерные для ишемической болезни сердца и стенокардии, а также предикторы гемодинамически значимых кардиоаритмий в интраоперационном периоде коронарного шунтирования.
3. Интраоперационная ритмокардиография при коронарном шунтировании позволяет зарегистрировать ВСР, характерную для каждого этапа операции, а также кардиоаритмии, патогенетически связанные с аритмическими предвестниками предоперационной ВСР и локализацией хирургических манипуляций во время шунтирования.
4. В раннем послеоперационном периоде коронарного шунтирования данные ВСР свидетельствуют об ухудшении вегетативной регуляции кардиоваскулярной системы, однако при высоком разрешении ритмокардиографии возможно выявить уже в раннем периоде не только отрицательную, но и положительную динамику послеоперационного состояния пациентов.
Рецензенты:
Шамуров Юрий Степанович, доктор медицинских наук, профессор, заведующий кафедрой нервных болезней ГБОУ ВПО «Челябинская государственная медицинская академия» Министерства здравоохранения России, научный руководитель лаборатории нейрокардиологии Челябинской областной клинической больницы, г. Челябинск.
Фокин Алексей Анатольевич, доктор медицинских наук, профессор, проректор по лечебной работе, заведующий кафедрой хирургии факультета постдипломного дополнительного профессионального образования ГБОУ ВПО «Челябинская государственная медицинская академия» Министерства здравоохранения России, г. Челябинск.
Библиографическая ссылка
Миронова Т.Ф., Миронов В.А., Куватов В.А., Приходько В.П. ПЕРИОПЕРАЦИОННАЯ РИТМОКАРДИОГРАФИЯ ВЫСОКОГО РАЗРЕШЕНИЯ В КАРДИОХИРУРГИИ // Современные проблемы науки и образования. 2013. № 1. ;URL: https://science-education.ru/ru/article/view?id=8241 (дата обращения: 09.03.2026).



