Введение
Из крови вырабатывают пищевые, технические, кормовые продукты и лечебные препараты. Из пищевых продуктов следует отметить пищевой альбумин светлый и черный; пищевую сыворотку и плазму [1]. Пищевую сыворотку и плазму крови применяют главным образом в производстве вареных колбас, рубленых полуфабрикатов, замороженных полуфабрикатов в тесте. Светлый пищевой альбумин можно применять для тех же целей, что сыворотку и плазму крови; темный для производства детского гематогена, пентагематогена, препарата гемоглобина [2; 3].
Известны многочисленные методы гидролиза крови с помощью химических и биохимических методов с целью получения смесей аминокислот и пептидов, предназначенных для различных целей [4; 5]. При этом в качестве реагентов гидролиза используют неорганические кислоты и ферментные препараты. Каждый из способов имеет свои особенности, характеризующие преимущества и недостатки. Для получения железосодержащего продукта из крови сельскохозяйственных животных, представляющего собой смесь свободного железа и аминопептидных комплексов, необходимо применять гидролиз кислотой. Использование кислоты при гидролизе обусловливает значительные потери аминного азота. По данным Р.М. Кудрявцевой и других исследователей, потери аминного азота на стадиях технологического процесса составляют: при гидролизе белка соляной кислотой 35÷42%, при нейтрализации смеси – до 12%, при отделении гуминовых веществ – до 19%, при осветлении гидролизата – до 5,7%. Именно поэтому очень важно при ведении гидролиза осуществлять контроль выхода аминного азота.
Ввиду главной направленности использования конечного продукта в качестве железосодержащей пищевой добавки в питании людей, в качестве гидролизующих кислот использовали пищевые: лимонную и уксусную. При этом конечный продукт должен представлять собой смесь свободного гемового железа и аминопептидных комплексов, полученных в результате воздействия кислоты на белок. Поэтому при подборе параметров гидролиза необходимо контролировать содержание аминного азота и свободного гемового железа.
Цель исследования
В данном исследовании целью является подбор оптимальных параметров кислотного гидролиза эритроцитарной массы крови КРС и свиней.
Материалы и методы исследования
В качестве исходного сырья использовали цельную кровь крупного рогатого скота и свиней, полученную в соответствии с СанПиН 2.3.2.1078-01, из которой методом центрифугирования выделяли железосодержащую фракцию – эритроцитарную массу (ЭМ).
Массовую долю железа определяли по ГОСТ 30648.3-99. Для определения содержания железа 1,0÷1,2 г пробы осторожно обугливали в фарфоровом тигле в муфельной печи до красного каления. Золу растворяли в 10 мл соляной кислоты, разведенной в отношении 1:1, и полученный раствор выпаривали досуха на водяной бане. Сухой остаток вновь растворяли в 20 мл соляной кислоты (1:1) и переводили в коническую колбу емкостью на 250 мл, смывая тигель 10–15 мл дистиллированной воды. Затем добавляли 1,5 г йодистого калия, колбу закрывали стеклянной пробкой и оставляли стоять 5 мин, после чего добавляли 70 мл дистиллированной воды и титровали 0,1 н. раствором тиосульфата натрия (1 мл 0,1 н. раствора тиосульфата натрия соответствует 5,58 мг железа). Содержание железа (в %) определяли по формуле 1,
Х = 5,58 ∙ а ∙ К ∙ 100 / b (1)
где а – количество миллилитров тиосульфата натрия, израсходованное на титрование навески препарата;
К – коэффициент поправки к 0,1 н. раствору тиосульфата натрия;
b – навеска препарата, мг.
Для количественного определения массовой доли аминного азота использовали метод Лоури. В данном методе сочетаются две реакции. Первая – биуретовая реакция. Во второй реакции (собственно реакция Фолина) задействован реактив Фолина-Чокальтеу. В ней образуются окрашенные в синий цвет комплексы фосфорно-вольфрамовой и фосфорно-молибденовой кислоты под действием тирозина и триптофана, входящих в состав белков.
Первоначально гидролиз проводили при следующих концентрациях: 1%-ный раствор лимонной кислоты (Л1%), 1%-ный раствор уксусной кислоты (У1%), 5%-ный раствор лимонной кислоты (Л5%), 5%-ный раствор уксусной кислоты (У5%), 10%-ный раствор лимонной кислоты (Л10%), 10%-ный раствор уксусной кислоты (У10%).
Результаты и их обсуждение
Динамика выхода аминного азота при ведении гидролиза с выбранными концентрациями представлена на рис. 1.
а)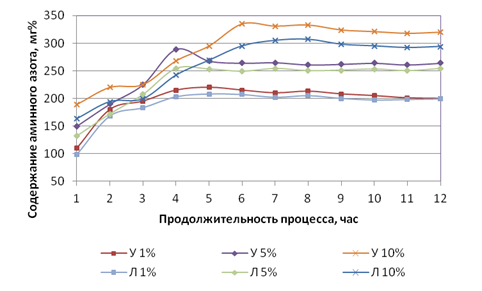
б)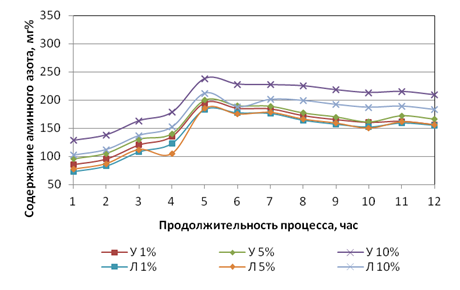
Рис. 1. Динамика выхода аминного азота при ведении гидролиза с выбранными концентрациями: а) свиная кровь; б) кровь КРС.
Анализируя данные рис. 1, можно сделать следующие заключения. Кривые содержания аминного азота при гидролизе кислотами различных концентраций как для крови КРС, так и для свиной крови имеют общий характер, который выражен двумя характерными зонами: зоной активного увеличения содержания аминного азота и зоной относительно стабильного его содержания в течение 6 ÷ 8 часов для свиной крови и 7 часов для крови КРС. Однако в динамике выхода аминного азота по группам животных имеется и ярко выраженное отличие. При гидролизе крови КРС наблюдается более выраженный пик при продолжительности пять часов, с последующим спадом, при этом наибольший пик имеет гидролизат, полученный гидролизом кислотами Л10% – 212 мг% и У10% – 238 мг%, а к окончанию процесса гидролиза (12 часов) содержание аминного азота находится на уровне 183 мг% для Л10% (падение аминного азота составляет 13,6%) и 209 мг% для У10% (падение аминного азота составляет 12,2%). Т.е. получается, что для крови КРС проведение гидролиза продолжительностью более пяти часов приводит к снижению количества аминного азота, что нежелательно. Для свиной крови наибольший пик выхода аминного азота характерен также для кислот Л10% – 307мг% при 8 часах гидролиза и для У10% – 335мг% при 6 часах гидролиза. Затем происходит небольшой спад содержания аминного азота, при 12 часах для Л10% он находится на уровне 294 мг% (падение аминного азота составляет 4,2%) и для У10% на уровне 320 мг% (падение аминного азота составляет 4,5%). Такие потери содержания аминного азота, характерные для свиной крови, можно считать некритическими. Результаты по выходу аминного азота, полученные при гидролизе Л1%, Л5%, У1% и У5%, можно считать менее эффективными.
Также были проведены исследования на содержание свободного гемового железа при гидролизе выше описанными вариантами кислот: Л1%, Л5%, Л 10%, У1%, У5% и У10%. Результаты исследований приведены в таблице 1 для свиной крови и таблице 2 для крови КРС.
Таблица 1 – Содержание свободного гемового железа, % к массе гидролизата, при различных вариантах гидролиза для свиной крови
|
Продолжительность процесса, час |
Содержание свободного гемового железа, % к массе гидролизата |
|||||
|
У 1% |
У 5% |
У 10% |
Л 1% |
Л 5% |
Л 10% |
|
|
2 |
0,07 |
0,09 |
0,12 |
0,06 |
0,07 |
0,09 |
|
4 |
0,11 |
0,13 |
0,16 |
0,1 |
0,11 |
0,13 |
|
6 |
0,19 |
0,23 |
0,26 |
0,17 |
0,19 |
0,21 |
|
8 |
0,23 |
0,27 |
0,3 |
0,21 |
0,21 |
0,23 |
|
10 |
0,28 |
0,32 |
0,35 |
0,26 |
0,27 |
0,29 |
|
12 |
0,29 |
0,33 |
0,35 |
0,27 |
0,28 |
0,3 |
По содержанию свободного гемового железа картина несколько иная как для свиной крови, так и для крови КРС. Количество освободившегося железа имеет для всех вариантов гидролиза положительную возрастающую динамику в течение всей продолжительности гидролиза. При этом период продолжительности 10÷12 часов имеет относительно стабильный характер, изменения в количестве железа незначительны, что дает право говорить об отсутствии смысла увеличения продолжительности процесса более 12 часов. При гидролизе ЭМ свиной крови наибольший выход железа наблюдается при использовании кислот У5% – 0,33%, У10% – 0,35%, а также Л10% – 0,30%. При гидролизе ЭМ крови КРС наибольший выход железа наблюдается у тех же вариантов кислот, что и для ЭМ свиной крови: У5% – 0,29%, У10% – 0,31% и Л10% – 0,26%. Таким образом, после исследования динамики выхода аминного азота и динамики высвобождения гемового железа при гидролизе шестью вариантами кислот определено, что продолжительность процесса целесообразно вести в течение 12 часов, наиболее приемлемые концентрации кислот: Л10%, У5% и У10%.
Таблица 2 – Содержание свободного гемового железа, % к массе гидролизата, при различных вариантах гидролиза для крови КРС
|
Продолжительность процесса, час |
Содержание свободного гемового железа, % к массе гидролизата |
|||||
|
У 1% |
У 5% |
У 10% |
Л 1% |
Л 5% |
Л 10% |
|
|
2 |
0,05 |
0,07 |
0,1 |
0,04 |
0,05 |
0,07 |
|
4 |
0,09 |
0,11 |
0,14 |
0,08 |
0,09 |
0,11 |
|
6 |
0,13 |
0,17 |
0,2 |
0,11 |
0,13 |
0,15 |
|
8 |
0,18 |
0,22 |
0,25 |
0,16 |
0,16 |
0,18 |
|
10 |
0,22 |
0,26 |
0,29 |
0,2 |
0,21 |
0,23 |
|
12 |
0,25 |
0,29 |
0,31 |
0,23 |
0,24 |
0,26 |
Из проделанной работы можно сделать следующие выводы.
1. Для ведения гидролиза эритроцитарной массы крови свиньи и КРС можно использовать следующие варианты кислот: уксусная кислота концентрацией 5%, лимонная кислота концентрацией 10% и уксусная кислота концентрацией 10%. Все варианты имеют положительный эффект гидролиза.
2. Продолжительность гидролиза должна составлять не более 12 часов.
3. Конечный продукт гидролиза эритроцитарной массы крови свиньи имеет определенные различия по физико-химическим показателям с конечным продуктом гидролиза эритроцитарной массы крови КРС. Различия по содержанию аминного азота, свободного гемового железа зависят, в первую очередь, от изначально различных физико-химических показателей крови КРС и свиньи.
Работа выполнена в рамках ФЦП «Научные и научно-педагогические кадры инновационной России на 2009-2013 годы» по теме «Разработка высокоэффективной технологии получения противоанемических продуктов на основе крови убойных животных», соглашение №14.132.21.1763.
Рецензенты:
Попов Анатолий Михайлович, доктор технических наук, профессор, проректор по НИР ФГБОУ ВПО «Кемеровский технологический институт пищевой промышленности», г. Кемерово.
Просеков Александр Юрьевич, доктор технических наук, профессор, заведующий кафедрой «Бионанотехнология» ФГБОУ ВПО «Кемеровский технологический институт пищевой промышленности», г. Кемерово.
Библиографическая ссылка
Изгарышев А.В., Кригер О.В., Лапин А.П. ПОДБОР ПАРАМЕТРОВ КИСЛОТНОГО ГИДРОЛИЗА ЭРИТРОЦИТАРНОЙ МАССЫ КРОВИ КРС И СВИНЬИ // Современные проблемы науки и образования. 2013. № 1. ;URL: https://science-education.ru/ru/article/view?id=8217 (дата обращения: 09.03.2026).



