Введение
Астатичность температуры окружающей среды обитания – один из экологических факторов, который определяет выживаемость, формирование и изменение показателей нормы реакции, темпов роста и развития организмов, интенсивность обмена веществ. Астатичность для гидробионтов усугубляется их постоянным перемещением в термоградиентном поле и является экологической нормой существования, обеспечивает реализацию потребности организмов в температурном разнообразии колебательных режимов, т.к. статичность условий обитания определяет снижение эффективности аккумуляции энергии и окисления органических веществ [3; 4]. Нередко перегревание организма может происходить и в естественных условиях обитания. Особенно актуальным становится изучение этого вопроса в свете глобального потепления климата. По этой причине экспериментальное изучение влияния высокой температуры на организм имеет адекватную физиологическую (климато-географическая миграция, условия высокотемпературных технологий) и клиническую актуальность. При этом особое значение приобретает состояние органов, непосредственно участвующих в поддержании гомеостаза организма. Одним из таких органов является печень. Сложность структуры, полифункциональность, быстрота вовлечения в патологические и компенсаторно-приспособительные процессы – все это определяет неослабевающий интерес исследователей к проблемам регенерации печени: источники, масштабы, механизмы. Учитывая, что действие высокой температуры определяет состояние функционального напряжения организма, именно первичные реакции, возникающие непосредственно после перегревания, требуют исследования таких компенсаторно-приспособительных реакций, которые отражают мобилизацию в короткий срок динамичных, срочно возникающих, реализуемых в неадекватных условиях среды биологических потенций печени рыб.
Вызываемый температурным фактором каскад структурно-функциональных компенсаций на фоне развития как деструктивных, так и репаративных процессов метаболической модуляции и пролиферативной активности во многом обеспечивается реорганизацией хроматина [1; 9; 10].
В связи с этим целью нашего исследования явилось выявить характерные проявления раннего этапа репаративной регенерации в период неспецифической реакции на субклеточном уровне печени рыб вида Carassius auratus gibilio Bloch, 1782 (карась серебряный).
Материал и методы исследования. Перегревание проводили при температуре 32 °С в условиях свободного плавания в термоградиентном лотке с дополнительной аэрацией в течение 30 минут, что определяло развитие теплового удара средней тяжести [8]. Эксперимент поставлен на 30 животных (15 служили контролем).
После перегревания на отпечатках печени методом оптико-структурного анализа (ОСА) ДНК определяли долю гепатоцитов по фазам клеточного цикла – G0, S, G2+M, гиподиплоидные. Мазки печени окрашивали по Фёльгену в модификации G. Olson, в реактиве Шиффа. На препаратах определяли состояние обеих фракций хроматина (F – конденсированного, D – деконденсированного): интегральную плотность – (DI, FI), общую интегральную плотность (TI), площадь распределения (DP, FP), площадь ядра (ТР), оптическую плотность (DM, FM), среднюю оптическую плотность (T_SR), периметр (DL, FL), коэффициент округлости хроматина (DK, FK). Количество ДНК было измерено в 200 ядрах (одноядерные) [2]. Фотографирование и обработка препаратов проводилась на автоматизированном морфометрическом комплексе Axioplan (Сarl Zeiss, Германия).
Статистическую обработку полученного материала осуществляли с помощью пакета прикладных программ Statistica 6. Различия между независимыми выборками определяли с помощью критерия Стьюдента (t), значимыми считались различия при Р≤0,05 [5]. Для выявления степени сопряженности исследуемых показателей использовался многофакторный дисперсный анализ MANOVА (Multivariative ANalysis Of VAriance) n-waj analysis ofvariance.
Результаты исследования и их обсуждение
У интактных животных выявлены видовые особенности в количестве, топографии хроматина гепатоцитов. Так, распределение хроматина представлено: мелкозернистыми фракциями с равномерным распределением по всей площади ядра; сетчато-крупноглыбчатыми зонами, локализованными либо в центре ядра, либо диффузно и в области ядерной ламины; пикнотичными ядрами (сверхкомпактизация).
Согласно оптико-структурному цитофотометрическому анализу параметров Фельген - позитивного ДНК хроматина гепатоцитов у интактных животных DL хроматина на 8,6% превышает FL, а DK выше у конденсированного (61,4 и 38,6% соответственно). Пространственно-топографически в ядре деконденсированный хроматин имеет большую площадь распределения (69,7 и 30,3% соответственно), следовательно, и большую интегральную оптическую плотность (55,8 и 44,2% соответственно). Средняя оптическая плотность как показатель уровня конденсации выше у ДНК гетерохроматина (63,6%) в сравнении с ДНК эухроматина (36,4%). Согласно частотному анализу, проводимому по общей интегральной и оптической плотности хроматина, выявлено, что 92% гепатоцитов находятся в G0-G1 стадии клеточного цикла (2n2с); 6,5% – в S стадии (2n4с); 0,8% – в конечной стадии дифференцировки – гиподиплоидные гепатоциты; 0,7% – в G2-M стадии (рис. 1, 2).
Анализ соотношения «митотической активности/количества гиподиплоидных гепатоцитов» интактных животных (G2-M/D) выявил, что количество митотически делящихся гепатоцитов меньше, чем гиподиплоидных. Соотношение «полиплоидизации/пролиферации» (S/G2-M) таково, что из гепатоцитов, находящихся в S-стадии, только 10% гепатоцитов вступают в G2-M-стадию.
После перегревания интегральная плотность деконденсированного хроматина не проявляет значимых отличий от контрольных показателей. Интегральная плотность гетерохроматина увеличиваются на 11% и общая интегральная плотность на 6%. В связи с этим отмечается уменьшение площади распределения эу- и гетерохроматина на 12 и 5% соответственно. Вследствие увеличения показателей средней оптической плотности конденсированного и деконденсированного хроматина на 12,5 и 11% соответственно уменьшается общая площадь ядер на 9%.
Известно, что тепловая пластичность проявляется в наличии биофизических ограничений – размер ядер гепатоцитов. Увеличение в эволюции размера генома, соответственно, увеличение объема ядер, вовлечено в регулирование метаболизма клетки, с параллельным замедлением жизненного цикла, морфогенеза, устойчивостью к гипоксии, это обеспечивает реализацию более разнообразных метаболических путей при адаптации к изменениям температуры [6; 7]. Это подтверждается выбором различных стратегий метаболической адаптации у животных с большим размером генома – Carassius auratus gibilio. В свою очередь увеличение размера генома по пути полиплоидизации связано с энергетической емкостью клетки, с первичной устойчивостью, способностью к репарации, увеличению биоэлектрического заряда ядра с изменением физического состояния таких крупномасштабных структур, как хроматин.
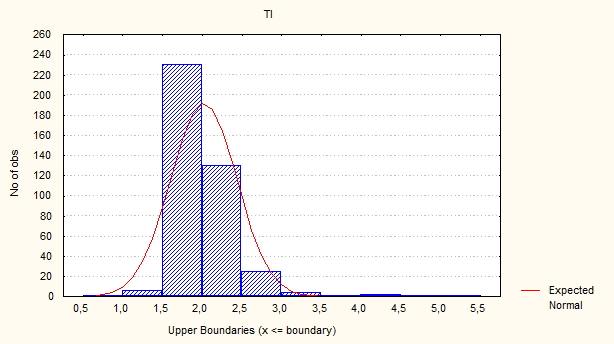
Рис. 1. Гистограмма распределения гепатоцитов по клеточному циклу рыб вида Carassius auratus gibilio. Контроль. TI – интегральная оптическая плотность хроматина.
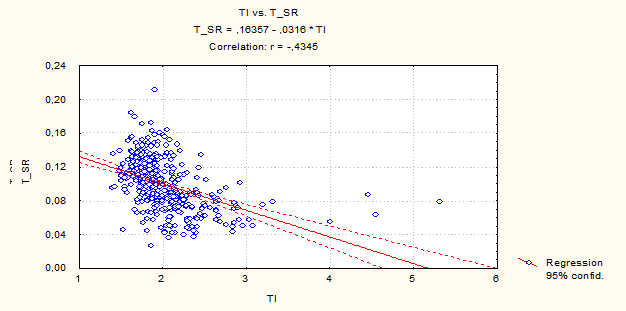
Рис. 2. Двумерное распределение ядер по TI – интегральной оптической плотности ДНК и T_RS – средней оптической плотности ДНК гепатоцитов рыб вида Carassius auratus gibilio. Контроль. Многофакторный дисперсный анализ MANOVА.
Выявленная конденсация/деконденсация хроматина ядер гепатоцитов и изменение ядерного размера являются ключевыми параметрами, которые приспосабливают размер генома к метаболической интенсивности организма [9].
После перегревания уменьшается количество гепатоцитов в G2-M-стадии, увеличивается количество гиподиплоидных гепатоцитов и гепатоцитов в S-стадии клеточного цикла. При этом проявляется снижение соотношения количества пролиферирующих и гиподиплоидных гепатоцитов (G2-M/D).
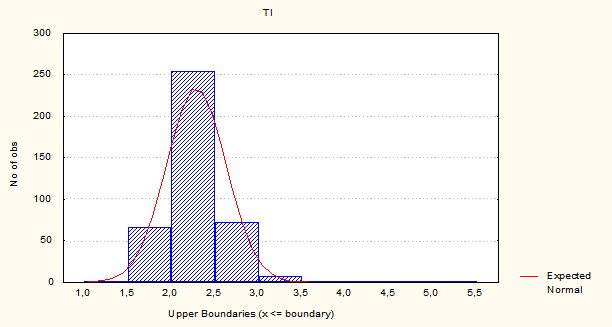
Рис. 3. Гистограмма распределения популяции гепатоцитов по клеточному циклу рыб вида Carassius auratus gibilio. Перегревание. TI – интегральная оптическая плотность хроматина.
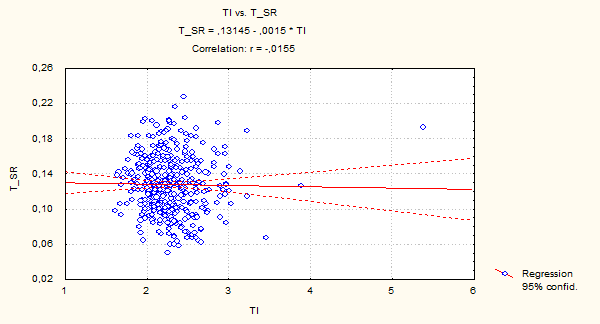
Рис. 4. Двумерное распределение ядер по TI – интегральной оптической плотности ДНК и T_RS – средней оптической плотности ДНК гепатоцитов рыб вида Carassius auratus gibilio. Перегревание. Многофакторный дисперсный анализ MANOVА.
Таким образом, структура хроматина ядер проявляет адаптивную реорганизацию в соответствии с потребностями в синтезе РНК и белка, обеспечивая, таким образом, согласование между уровнем транскрипции и трансляции.
На основании полученных данных можно сделать заключение о том, что в период неспецифической реакции на клеточном уровне печени рыб проявления раннего этапа репаративной регенерации осуществляются посредством реорганизации хроматина и увеличения количества гиподиплоидных гепатоцитов и гепатоцитов в S-стадию клеточного цикла.
Рецензенты:
Григорьев А.И., д.б.н., профессор кафедры экологии и природопользования ОмГПУ, г. Омск.
Богданов И.И., д.б.н., профессор кафедры экологии и природопользования ОмГПУ, г. Омск.
Библиографическая ссылка
Антонова Е.И., Мкртчан О.З., Калиненко Н.А., Хамитова Л.Е., Омарова Д.И., Шпак О.Ю. ОСОБЕННОСТИ РЕОРГАНИЗАЦИИ ХРОМАТИНА ЯДЕР И ПОКАЗАТЕЛЕЙ КЛЕТОЧНОГО ЦИКЛА ГЕПАТОЦИТОВ ПЕЧЕНИ РЫБ ПОСЛЕ ВОЗДЕЙСТВИЯ ВЫСОКОЙ ВНЕШНЕЙ ТЕМПЕРАТУРЫ // Современные проблемы науки и образования. 2012. № 6. ;URL: https://science-education.ru/ru/article/view?id=7469 (дата обращения: 28.01.2026).



