GFP (Green Fluorescent Protein, зеленый флуоресцентный белок) был выделен из люминесцентной медузы Aequorea victoria ещё в 1962 г. [13]. Однако в то время он не вызывал особого интереса у ученых. Настоящий переворот произошел после клонирования гена белка в 1992 г. [10], когда стало возможным использование GFP в качестве генетически кодируемой флуоресцентной метки. Впервые GFP был использован в качестве маркера генной экспрессии в 1994 г. [3]. За несколько последующих лет область применения GFP существенно расширилась. На основе GFP были получены различные варианты, с эмиссией от синего до желтого света, что позволило использовать флуоресцентные белки для изучения взаимодействий биомолекул с использованием безизлучательного переноса энергии между флуоресцентными метками (FRET - fluorescence resonance energy transfer) [15].
Открытие GFP-подобных белков из коралловых полипов класса Anthozoa в 1999 г. [7] позволило существенно расширить палитру флуоресцентных белков. Эти белки имеют степень гомологии с GFP около 30 %, а один из клонированных белков - DsRed имел яркую флуоресценцию в красной области спектра (583 нм). Позже число GFP-подобных белков расширилось до нескольких десятков. Некоторые из белков коралловых полипов обладали уникальными свойствами, нехарактерными для GFP. В частности, asCP оказался способным к обратимой фотоактивации из хромо- (нефлуоресцентного) состояния во флуоресцентное, а ряд белков (mcavFP, rfloFP, DendFP, Kaede, EosFP) оказались способными к необратимой фотоконверсии из зеленой формы в красную. Такая особенность новых белков позволила получить генетически кодируемые флуоресцентные метки для прицельного фотомечения белков in vivo [9]. Разнообразие свойств и применений GFP-подобных белков обусловлено их необычной структурой и, в особенности, структурой хромофора и его аминокислотным окружением.
Пространственная структура GFP-подобных белков
К настоящему времени установлена пространственная структура целого ряда GFP-подобных белков. Все они имеют упаковку β-бочки (рис. 1), 11 β-листов образуют полый цилиндр с диаметром около 30 Å и длиной около 40 Å, внутри которого проходит сильно деформированная α-спираль, несущая хромофор. Небольшие α-спиральные участки находятся также на торцах цилиндра [17]. В итоге формируется довольно компактная структура, внутри которой "спрятан" хромофор.
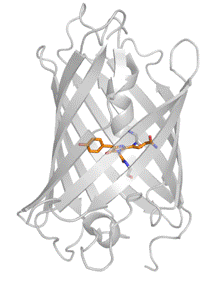
Рис. 1. Структура β-бочки GFP-подобных белков. Хромофор внутри белка выделен оранжевым цветом и представлен в виде скелетной модели
Структура хромофора GFP-подобных белков
К настоящему времени основной классификацией GFP-подобных белков является классификация по цвету испускаемого ими света: от синего до красного. Особо можно выделить хромобелки, которые не имеют собственной флуоресценции, однако характеризуются интенсивным поглощением в красной области спектра. Следует отметить, что все хромобелки превращаются во флуоресцентные с помощью мутагенеза при небольшом числе замен и имеют максимум эмиссии в дальне-красной области спектра (больше 600 нм) [5]. Таким образом, хромобелки, исходя из классификации по положению максимумов поглощения/эмиссии, могут быть отнесены к дальне-красным белкам.
GFP-подобные белки, как и большинство других биомолекул, окрашены за счёт присутствия хромофора. Однако, в отличие от других, хромофор автокаталитически образуется внутри белка без воздействия внешних агентов. Единственным существенным фактором является наличие молекулярного кислорода, необходимого на стадии окисления при синтезе хромофора.
Прежде всего следует отметить, что у всех GFP-подобных белков образование хромофора происходит из инвариантных аминокислотных остатков (а.к.о.) Tyr66-Gly67 (нумерация по GFP), а также из а.к.о., находящегося в 65-й позиции. В результате реакции конденсации между амидной группой Gly67 и карбонильным углеродом Ser65, сопровождающейся дегидратацией, в GFP образуется имидазолиноновый гетероцикл. Затем в результате дегидрогенирования Cα-Cβ связи Tyr66 образуется 4-(p-гидроксибензилилиден)-5-имидазолон как основа хромофора (рис. 2) [6].
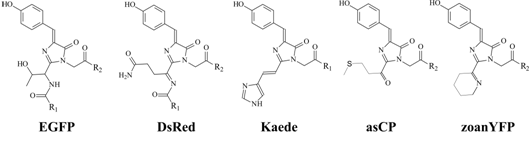
Рис. 2. Структура хромофора некоторых представителей белков GFP-семейства
Дополнительное окисление хромофора в белке DsRed превращает его из зелёного в красный (максимум эмиссии 583 нм) (рис. 2). В результате этой реакции образуется высокореакционная ацилиминная группа, которая впоследствии может претерпевать различные дополнительные модификации. Одной из таких модификаций является гидролитическая фрагментация хромофора в хромобелке asCP (рис. 2). В желтом флуоресцентном белке zoanYFP фрагментация хромофора происходит внутримолекулярно с участием боковой цепи хромофоробразующего остатка лизина (рис. 2). Во флуоресцентном белке Kaede при образовании "красного" хромофора также происходит его фрагментация, в результате чего π-система хромофора расширяется за счет боковой цепи остатка гистидина (рис. 2).
Аминокислотное окружение хромофора
Для обеспечения флуоресценции GFP необходимо как присутствие полностью сформированного хромофора, так и правильно свёрнутого белка. Спектральные свойства флуоресцентных белков также в значительной степени зависят от аминокислотного окружения хромофора. В разных белках одной и той же цветовой группы положение максимума эмиссии может меняться в пределах нескольких десятков нанометров в зависимости от аминокислотного окружения. Более того, меняя аминокислотное окружение, порой удается перевести белки из одной цветовой группы в другую.
Ярким примером является получение жёлтого флуоресцентного белка (YFP, максимум эмиссии 527 нм) при помощи мутагенеза GFP. YFP содержит мутацию T203Y, причем фенольное кольцо введенного остатка тирозина располагается параллельно π-системе хромофора. Считается, что π - π электронные взаимодействия между Tyr203 и фенольным кольцом хромофора уменьшают энергию возбуждения хромофора, тем самым увеличивая длину волны поглощаемого/испускаемого света [16]. Также стекинг-взаимодействия были обнаружены также в ряде красных и зеленых флуоресцентных белков из коралловых полипов. В GFP-подобных белках eqFP611 и Rtms5 хромофор вовлекается в стекинг-взаимодействия с His197 и Arg197, соответственно (рис. 3).
А Б
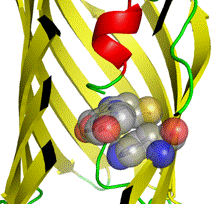
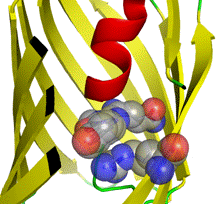
Рис. 3. Стекинг-взаимодействия в eqFP611 между хромофором и His197 (А), а также в Rtms5 между хромофором и Arg197 (Б)
Другим важным фактором, влияющим на спектральные свойства GFP-подобных белков, является ионизация или протонирование/депротонирование хромофоробразующего тирозина. Известно, что avGFP-WT имеет два максимума поглощения, при 396 и 476 нм. Первый соответствует протонированной форме, которая не флуоресцирует, а второй - депротонированной (ионизованной) флуоресцентной форме. Важную роль в процессе протонирования-депротонирования играет Glu222, который взаимодействует с фенольным гидроксилом хромофора через сеть водородных связей (рис. 4). Замена в GFP Ser65 на Thr приводит к возникновению стерических препятствий и реорганизации водородных связей, в результате чего хромофор переходит в ионизованное состояние. В желтом флуоресцентном белке phiYFP в результате нарушения цепи водородных связей между фенольным кольцом хромофора и Glu222 возникает дополнительный батохромный сдвиг [9].
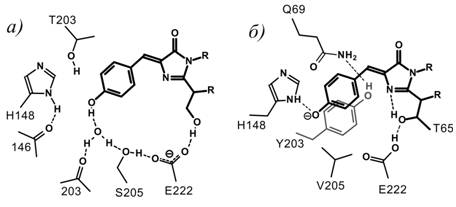
Рис. 4. Цепь водородных связей хромофора с окружающими а.к.о. в GFP (а) и phiYFP (б)
Процесс протонирования/депротонирования хромофора имеет большое значение при фотоактивации флуоресцентного белка Dronpa [1]. Изначально флуоресцентный белок под действием света с длиной волны около 490 нм теряет способность к флуоресценции за счёт протонирования хромофора. Данное состояние белка является термодинамически стабильным и при 20 °С белок восстанавливает менее 1 % от исходной флуоресценции за 10 мин. Однако под действием света ~ 400 нм белок довольно быстро возвращается в исходное флуоресцентное состояние. Как показали исследования кристаллической структуры Dronpa, данный процесс обусловлен существенными структурными изменениями. Предполагается, что протонирование происходит в результате цис-транс изомеризации хромофора относительно Сα=Сβ связи хромофоробразующего Tyr63, приводящей к изменению локального окружения фенольной группы.
Конформационное состояние хромофора
Важным аспектом, влияющим на спектральные характеристики GFP-подобных белков, является конформационное состояние хромофора. Возможны несколько вариантов изомерии. Во-первых, хромофор может существовать как в цис-, так и в транс-конформации относительно Сα=Сβ связи ароматического а.к.о (рис. 5). Как правило, все флуоресцентные белки имеют цис-, а хромобелки транс- ориентацию хромофора, однако это правило не абсолютно. Было показано, что процесс цис-транс-изомеризации играет ключевую роль при фотоактивации белка asFP595 [12]. А.к.о. в 148-ой, 165-ой и 203-ой позициях в ближайшем окружении Tyr66 играют ключевую роль в стабилизации цис и транс-состояний хромофора (нумерация по GFP).
Детальные исследования структуры исходного нефлуоресцентного и "разожженого" состояний показали, что они имеют транс- и цис-конформации, соответственно. Однако оставалось не совсем понятным, почему белок, содержащий хромофор в транс-ориентации, является нефлуоресцентным. Более того, был найден белок (eqFP611), характеризующийся яркой флуоресценцией в красной области спектра и имеющий транс-конформацию хромофора. Оказалось, что за флуоресцентные свойства отвечает не столько цис-транс-изомеризация хромофора, сколько его планарность.
Впервые хромофор с нарушенной планарностью был обнаружен в ходе кристаллографических исследований хромобелка Rtms5 [11] (рис. 19). В настоящее время считается, что такое состояние хромофора является основной причиной потери флуоресцентных свойств в хромобелках.
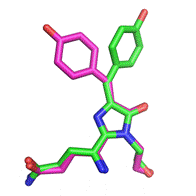
Рис. 5. Транс- непланарный хромофор Rtms5 (зеленым цветом), наложенный на цис- планарный хромофор DsRed (сиреневым цветом)
Хромобелки отличаются от флуоресцентных белков квантовым выходом флуоресценции. Тогда как GFP имеет квантовый выход 0.79, квантовый выход asFP595 в исходном "неразожженом" состоянии составляет лишь <0.001. Влияние планарности на квантовый выход флуоресценции чётко прослеживается в серии мутантных вариантов mRFP1 (табл. 2) [14]. Нарушение планарности хромофора приводит к значительному падению квантового выхода.
С помощью нефлуоресцентных вариантов GFP было показано, что наибольшее влияние на флуоресценцию GFP оказывают 145-й и 148-й а.к.о. При введении мутации Y145W происходило падение флуоресценции на 98 %, а при введении мутации H148V - на 82 %. Двойной мутант EYFP с заменами Y145W и H148V (REACh - Resonance Energy-Accepting Chromoprotein - хромобелок, акцептирующий резонансную энергию в FRET) был использован как неизлучающий акцептор во FRET взаимодействиях с CFP [4]. Введение приведенных мутаций вызывает стерически вынужденное отклонение фенольного кольца относительно исходной плоскости хромофора.
Таблица 1. Связь квантового выхода с планарностью хромофора в mFruits
|
Белок |
Квантовый выход |
Угол поворота |
Угол наклона |
|
GFP |
0.79 |
0.0 |
3.7 |
|
DsRed |
0.79 |
0.9 |
0.2 |
|
mOrange |
0.69 |
1.5 |
10.3 |
|
mStrawberry (pH9.5) |
0.31 |
5.9 |
17.9 |
|
mStrawberry (pH10.5) |
0.36 |
0.4 |
4.6 |
|
mCherry |
0.22 |
11.3 |
13.7 |
Таким образом, очевидно, что конформационное состояние хромофора имеет значительное влияние на его спектральные свойства. При помощи сайт-направленного мутагенеза заместителей, находящихся в ближайшем окружении хромофора, удалось достичь значительного успеха в изменении спектральных свойств GFP-подобных белков. Так при замене а.к.о. 148 (нумерация по GFP) в хромобелках на Ser приводит к существенному увеличению квантового выхода [5]. Известно, что Ser148 в красном флуоресцентном белке DsRed стабилизирует цис-планарное флуоресцентное состояние хромофора. С другой стороны, DsRed при небольшом числе замен (S148C, I165N, K167M, S203A) удалось превратить в хромобелок [2], индуцируя транс-непланарное состояние хромофора.
В заключение, спектральные свойства GFP-подобных белков определяются целым рядом факторов. Во-первых, все они имеют упаковку β-бочки, защищающей хромофор от воздействия "внешней среды". Во-вторых, цветовое разнообразие достигается, в основном, за счет вариации химической структуры хромофора. И в-третьих, значительную роль имеет аминокислотное окружение хромофора, которое отвечает за его формирование, конформационое состояние, ионизацию и другие параметры.
Работа выполнена при финансовой поддержке Российского Фонда Фундаментальных Исследований (12-04-33188) и гранта министерства образования и науки в рамках ФЦП «Научные и научно-педагогические кадры инновационной России на 2009-2013 годы».
Рецензенты:
Шуваева Т. М., д.х.н., в.н.с., Федеральное государственное бюджетное учреждение науки Институт биоорганической химии им. академиков М. М. Шемякина и Ю. А. Овчинникова Российской академии наук, г. Москва.
Шахпаронов М. И., д.х.н., рук. группы, Федеральное государственное бюджетное учреждение науки Институт биоорганической химии им. академиков М. М. Шемякина и Ю. А. Овчинникова Российской академии наук, г. Москва.
Библиографическая ссылка
Пахомов А.А., Мартынов В.И. ВЛИЯНИЕ ОКРУЖЕНИЯ ХРОМОФОРА НА СПЕКТРАЛЬНЫЕ СВОЙСТВА GFP – ПОДОБНЫХ БЕЛКОВ // Современные проблемы науки и образования. 2012. № 5. ;URL: https://science-education.ru/ru/article/view?id=7318 (дата обращения: 01.01.2026).



