Ранее нами получены гетариламиды 2-(2-гидроксифенил)-2-оксоэтановой кислоты (4а-г) на основе дециклизации 2,3-дигидробензо[b]фуран-2,3-диона (3) гетероциклическими аминами в среде толуола безводного при комнатной температуре и выбраны перспективные соединения с сочетанным флоголитическим и актоанальгетическим действием для дальнейшего фармакологического изучения [7].
Актуальными исследованиями является синтез 4-арил-2-гидрокси-4-оксобутеноатов гетариламмония (5а-д), содержащими в своей структуре два фармакофорных фрагмента - ароилпирувата и гетероциклического фрагмента с двумя или тремя гетероатомами [2,4,6]. Практический интерес представляет их растворимость в воде, что повышает биологическую доступность химических соединений и в перспективе расширяет технологические возможности создания лекарственных форм и практического медицинского применения.
Высокая противовоспалительная и анальгетическая активность выявлена нами также у замещенных 2-метиленгидразино-4-арил-4-оксо-2-бутеновых кислот (8а,б) и их гетариламидов (9а-в) [3,5,6]. Производные 8 получены взаимодействием 4-арил-2-гидрокси-4-оксо-2-бутеновых кислот (2а-г) с гидразоном монобензила в среде спирта этилового при комнатной температуре. Гидразинопроизводные 9 синтезированы на основе гетариламидов 7а-в среде безводного толуола при нагревании реакционной смеси [3,5].
Целью работы явилось изучение жаропонижающей активности наиболее перспективных соединений в ряду производных α-оксокарбоновых кислот.
Объекты исследования синтезированы по стандартным методикам, согласно схеме 1:
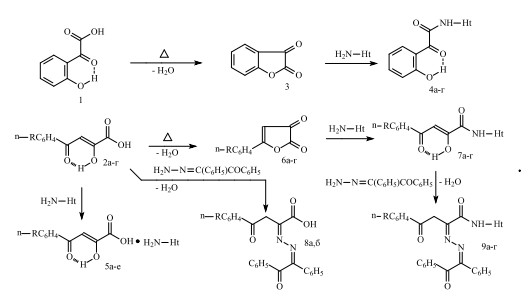
2,6: R=H (а), CH3 (б), CH3O (в), Cl (г). 4: Ht=4-пиридил (а), 2-(5-метил-1,3,4-тиадиазолил) (б), 2-(5-этил-1,3,4-тиадиазолил) (в), 2-бензимидазолил (г). 5: Ht=2-тиазолинил, R=H (а), СH3 (б), CH3O (в), Cl (г); Ht=2-(5-этил-1,3,4-тиадиазолил), R=CH3 (д); Ht=2-бензимидазолил, R=CH3 (е). 7,9: Ht=2-тиазолил, R=H (а), Cl (б); Ht=2-(5-метил-1,3,4-тиадиазолил) (в), R= Cl (г); 8: R= CH3 (а), CH3O (б).
Спектры ИК-излучения записаны на приборе ФСМ-1201 (Россия) в пасте в вазелиновом масле. Спектры ЯМР¹Н записаны на приборе ЯМР BS-567А (100МГц), внутренний стандарт - ГМДС, растворитель ДМСО-d6. Данные элементного анализа, проведенного на приборе LECO-CNH(S)932, удовлетворяют вычисленным значениям. Химическую чистоту соединений и протекание реакции контролировали методом ТСХ на пластинках «Silufol UV-254» в системах эфир-бензол-ацетон, 10:9:1, бензол-эфир, 1:1. Пятна детектировали парами йода и УФ-излучением.
Острая токсичность синтезированных соединений изучена на белых нелинейных мышах обоего пола с определением DL50. Каждое соединение испытывали на 6 животных. Соединения вводили перорально в виде взвеси в 2 % крахмальном растворе из расчета 0,1 мл/10 г, однократно, после чего животные находились под наблюдением 24 часа. Контрольным животным вводили эквиобъемное количество 2 % крахмального раствора [8].
Лихорадочную реакцию у белых нелинейных крыс вызывали внутривенным введением пирогенала. Изменение температуры тела животных регистрировали ректально. Жаропонижающее действие исследуемых веществ оценивали по уменьшению гипотермии через 1 и 2 часа после введения пирогенала. Изучаемые соединения в дозе 50 мг/кг вводили перорально в виде взвеси в 2 % крахмальном растворе. Контрольным животным вводили эквиобъемное количество 2 % крахмального раствора. В качестве препарата сравнения использовали диклофенак в дозе 10 мг/кг. Препарат-эталон также вводили перорально в виде взвеси в 2 % крахмальном растворе. Результаты биологических испытаний обработаны статистически с определением критерия Стьюдента на компьютере с помощью статистических программ Windows XP (Excel) и приведены на рисунке 1.
Результаты изучения острой токсичности показали, что исследуемые соединения 4,5,8,9 могут быть отнесены к 4 и 5 классу опасности, согласно ГОСТу Р 53856-2010 [1]. В частности, для гетариламида 4в DL50 составляет 3800 мг/кг, а для гидразинопроизводного 8б - 3200 мг/кг, что свидетельствует о высоком профиле безопасности полученных соединений.
Выявлено, что соединения 4а,в,г, 5а,е, 8а,б, 9б,в во все сроки наблюдения оказали жаропонижающее действие. В ряду гетариламидов 2-(2-гидроксифенил)-2-оксоэтановой кислоты 4 лидирующую позицию занял гетариламид 4в, который тормозил лихорадочную реакцию у животных на уровне диклофенака. Уменьшение алкильной цепи в 5 положении 1,3,4-тиадиазола (у соединения 4б) приводит к существенному снижению активности. Замена гетероциклического фрагмента на 4-пиридил или 2-бензимидазолил приводит к некоторому росту жаропонижающего действия у соединений 4а,г.
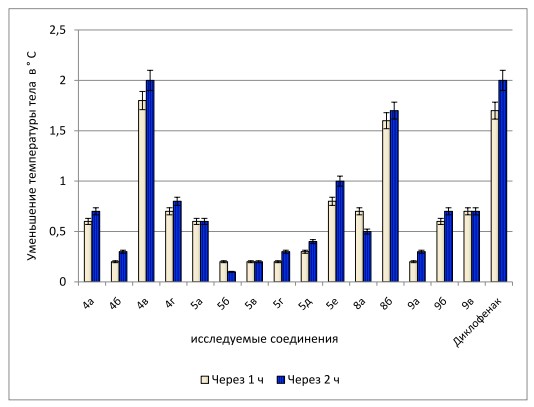
Рис. 1. Сравнительная характеристика жаропонижающей активности изученных производных α-оксокарбоновых кислот и диклофенака
Среди бутеноатов 5 наибольшая активность была выявлена у 4-(4-метилфенил)-2-гидрокси-4-оксо-2-бутеноата бензимидазолиламмония (5е). В ряду производных тиазолина установлено, что введение заместителя в п-положение бензольного кольца ароилпирувоильного кольца, независимо от его природы, приводит к снижению жаропонижающего действия (у соединений 5б-г), тогда как у незамещенного аналога 5а обнаружен изучаемый фармакологический эффект.
Высокую активность на уровне диклофенака проявила 2-(1,2-дифенил-2-окоэтилиденгидразино)-4-(4-метоксифенил)-4-оксо-2-бутено-вая кислота (8б). Введение электроноакцепторного заместителя в гидразинопроизводные 9 (у соединений 9б,в) приводит к росту жаропонижающего действия, по сравнению с незамещенным аналогом 9а.
Таким образом, выявлены два высокоактивных жаропонижающих производных α-оксокарбоновых кислот, обладающих также выраженной противовоспалительной, анальгетической активностью и низкой токсичностью, что создает предпосылки к дальнейшему изучению данных соединений как потенциальных нестероидных противовоспалительных средств.
Работа выполнена при финансовой поддержке РФФИ (проект № 11-03-00882-а).
Рецензенты:
Сыропятов Б.Я. д.м.н., профессор, заведующий кафедрой физиологии и патологии ГБОУ ВПО «Пермская государственная фармацевтическая академия» Минздравсоцразвития, г. Пермь.
Вихарева Е.В. д.ф.н., профессор, заведующий кафедрой аналитической химии, ГБОУ ВПО «Пермская государственная фармацевтическая академия» Минздравсоцразвития, г. Пермь
Библиографическая ссылка
Пулина Н.А., Собин Ф.В., Махмудов Р.Р. ИЗУЧЕНИЕ ЖАРОПОНИЖАЮЩЕЙ АКТИВНОСТИ ПРОИЗВОДНЫХ α-ОКСОКАРБОНОВЫХ КИСЛОТ // Современные проблемы науки и образования. 2012. № 1. ;URL: https://science-education.ru/ru/article/view?id=5433 (дата обращения: 12.01.2026).



