Важнейшей составляющей борьбы с лейкозом является разработка эффективных методов своевременной диагностики данного заболевания. В настоящее время для выявления лейкоза крупного рогатого скота используют серологические, молекулярно-биологические, гематологический, клинический, патоморфологический, биопробный методы. Наиболее широко и успешно применяются серологические [2; 3] и молекулярно-генетические [4] методы диагностики: радиальная иммунодиффузия (РИД), иммуноферментный анализ (ИФА), полимеразная цепная реакция (ПЦР). Для ИФА характерна более высокая эффективность по сравнению с РИД [5], но оба метода по чувствительности уступают ПЦР. Это связано с тем, что ПЦР, в отличие от серологических методов, выявляет изменения, происходящие на генетическом уровне (наличие провирусной ДНК), а не на уровне продуктов экспрессии генов (наличие вирусоспецифических белков), которые являются маркерами более поздних стадий заболевания. Однако повсеместному применению полимеразной цепной реакции для ранней диагностики лейкоза крупного рогатого скота препятствует высокая стоимость проведения анализа. Решением данной проблемы может стать разработка новых эффективных молекулярно-генетических методов диагностики, не требующих использования дорогостоящего оборудования.
Целью данной работы явился поиск новых молекулярно-генетических маркеров лейкоза крупного рогатого скота и проверка возможности использования метода рестрикционного анализа для диагностики данного заболевания.
Материалы и методы
В работе использовали препараты цельной крови, полученные от больных лейкозом, а также здоровых (контрольных) коров черно-пестрой породы из хозяйств юга Тюменской области. У больных животных лейкоз был выявлен методом радиальной иммунодиффузии. Все исследованные особи были самками и принадлежали к одной возрастной группе (1-1,5 года).
Из препаратов крови выделяли тотальную ДНК. Для этого к 200 мкл крови добавляли 1200 мкл лизирующего раствора № 1 (320 мМ сахароза, 8 мМ ЭДТА (pH=8,0), 1% Triton X-100, 5 мМ трис-HCl (pH=7,6) и 5 мМ MgCl2) и инкубировали при 0 °С в течение 1 часа. Затем клеточные ядра осаждали центрифугированием при 4 °С в течение 15 минут при 15000 g. После чего удаляли супернатант и суспендировали полученный осадок в 180 мкл лизирующего раствора № 2 (25 мМ ЭДТА (pH=8,0), 75 мМ NaCl и 1% ДСН). Затем добавляли 10 мкг Протеиназы K и инкубировали образцы при 37 °С в течение ночи. Для дополнительной очистки [6] препаратов нуклеиновых кислот проводили фенольную депротеинизацию с последующим их спиртовым осаждением.
ДНК в полученных препаратах обрабатывали эндонуклеазами рестрикции (EcoRI и PstI фирмы Fermentas) при 37 °С в течение 2 часов. Фермент добавляли из расчета 5 единиц активности на 1 мкг ДНК. Реакционная смесь для EcoRI содержалала 50 мМ трис-HCl (pH=7,5), 10 мМ MgCl2, 100 мМ NaCl, 0,02% Triton X-100, 0,01% БСА; для PstI - 50 мМ трис-HCl (pH=7,5), 10 мМ MgCl2, 100 мМ NaCl, 0,01% БСА.
Анализ полученных фрагментов ДНК проводили при помощи электрофореза в агарозном геле [7] при напряженности поля 10 В/см в течение одного часа в камере фирмы Helicon. ДНК визуализировали после обработки геля раствором бромистого этидия (2 мкг/мл) по флуоресценции в ультрафиолетовом свете.
В качестве маркеров молекулярной массы (длины) линейной ДНК использовали смесь фрагментов, получаемых в результате расщепления ДНК фага λ рестриктазой HindIII. Длины этих фрагментов: 27491, 9416, 6682, 2322, 2027, 564 пар нуклеотидов.
Результаты и обсуждение
Последовательность ДНК-копии геномной РНК ВЛКРС длиной 8419 пар нуклеотидов [8] содержит три сайта узнавания PstI и один сайт узнавания EcoRI. Исходя из расположения этих сайтов, теоретически рассчитано, что расщепление данной молекулы рестриктазой PstI (рис. 1А) приводит к образованию четырех фрагментов длиной 5242, 1436, 1343 и 398 пар нуклеотидов, а в результате расщепления рестриктазой EcoRI (рис. 1Б) образуется два фрагмента длиной 7719 и 700 пар нуклеотидов.
Электрофоретический анализ фрагментов, полученных в результате расщепления тотальной ДНК из крови больных лейкозом и здоровых (контрольных) животных эндонуклеазами рестрикции (рис. 2), показал следующее. При обработке тотальной ДНК, выделенной из крови больных лейкозом животных, действительно образуется четыре дополнительных (отсутствующих в контроле) PstI-фрагмента и два дополнительных EcoRI-фрагмента. Причем размеры указанных фрагментов ДНК совпадают с теоретически рассчитанными. Это свидетельствует о том, что данные фрагменты являются продуктами эндонуклеазного расщепления ДНК-копии геномной РНК ВЛКРС, присутствующей в клетках крови больных животных.
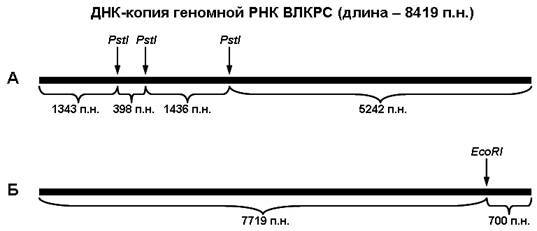
Рис. 1. Схема расщепления ДНК-копии геномной РНК ВЛКРС эндонуклеазами рестрикции PstI (А) и EcoRI (Б). Стрелками показано расположение сайтов узнавания эндонуклеаз рестрикции. Числами обозначены длины фрагментов ДНК, образующихся в результате расщепления.
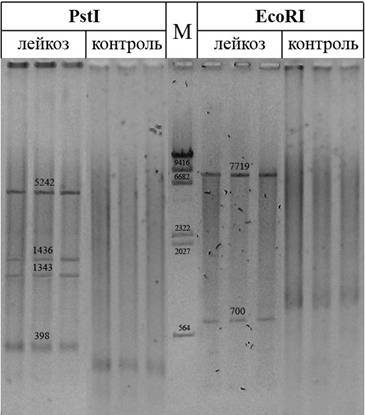
Рис. 2. Препараты ДНК после обработки эндонуклеазами рестрикции. М - маркер молекулярной массы. Электрофорез в 0,8% агарозном геле. Окрашено бромистым этидием. Числами обозначены длины фрагментов ДНК (в парах нуклеотидов).
Заключение
Таким образом, набор получаемых с помощь рестриктаз PstI и EcoRI фрагментов ДНК (их количество и размеры) высокоспецифичен для лейкоза крупного рогатого скота и является диагностическим признаком данного заболевания. В целом же метод рестрикционного анализа может с успехом применяться для молекулярной диагностики лейкоза и выступать в качестве эффективной и в то же время недорогой альтернативы ПЦР.
Рецензенты:
Мухачёв И.С., д.б.н., профессор кафедры аквакультуры ФГОУ ВПО «Тюменская государственная сельскохозяйственная академия», г. Тюмень.
Соловьёва С.В., д.м.н., доцент кафедры внутренних болезней, поликлинической терапии и семейной медицины ГОУ ВПО «Тюменская государственная медицинская академия», г. Тюмень.
Библиографическая ссылка
Трофимов О.В. ПРОДУКТЫ ЭНДОНУКЛЕАЗНОГО РАСЩЕПЛЕНИЯ ДНК КАК МОЛЕКУЛЯРНЫЕ МАРКЕРЫ ЛЕЙКОЗА КРУПНОГО РОГАТОГО СКОТА // Современные проблемы науки и образования. 2012. № 1. ;URL: https://science-education.ru/ru/article/view?id=5427 (дата обращения: 27.01.2026).



