Не ослабевает интерес промышленности к разработке новых способов производства титана взамен метода Кролля, разработанного еще в 40-х годах XX века [5]. Значительное число публикаций посвящено электролизу TiO2 в расплавах хлоридов или фторидов щелочных металлов, однако из-за низкой растворимости диоксида титана в различных расплавах 0,02-0,07% этот метод не позволяет использовать его для промышленного получения титана [2-4]. Большой интерес представляет процесс электролиза из хлоридных соединений титана. Наиболее доступным является TiCl4, технология получения которого освоена давно и осуществляется в промышленных масштабах. Растворимость тетрахлорида титана составляет до 2% масс при 800 °С, что также не позволяет достичь высокой производительности. Хлоридные расплавы обычно приводят к порошкообразным или дендритным осадкам [3] из-за существования трех нестабильных степеней окисления титана и реакций диспропорционирования. Во фторидных расплавах существуют только два состояния окисления. Ряд публикаций посвящен изучению электролиза из K2TiF6 из фторидных и фторидно-хлоридных электролитов [4]. В ходе проведения процесса состав электролита значительно меняется, что требует частой корректировки.
Таким образом, для внедрения в промышленность электролизного способа получения титана необходимо выполнение нескольких условий: доступное и недорогое сырье, неизменность состава электролита, низкие температуры проведения процесса. Технология получения гексафтортитаната аммония из ильменитовых концентратов апробирована на полупромышленной установке и готова к внедрению в промышленность. В данной работе приводятся результаты изучения процесса получения металлического титана методом электролиза.
Выбор и обоснование объекта исследования
Выбор электролита на основе фторидов щелочных металлов LiF-KF-NaF (46,5-42,0-11,5% моль) нами выбран по нескольким причинам. Это и невысокая температура плавления эвтектики 454 °С и неизменность состава в ходе проведения процесса, а также высокие потенциалы восстановления щелочных металлов на катоде. Для определения формы введения соединений титана в расплав электролита методом ДТА была исследована зависимость изменения массы смеси 10% (NH4)2TiF6 + электролит. Подготовка электролита проводилась согласно [1]. При нагревании смеси до температуры 350 °С наблюдалось разложение и полное улетучивание титана в виде TiF4. Соответственно, данное соединение нельзя использовать в качестве источника титана. Трифторид титана имеет температуру сублимации 1230 °С, что позволяет предположить о его полном взаимодействии с расплавом при рабочей температуре электролита 700 °С. Поэтому в качестве исходного компонента нами был выбран (NH4)3TiF6. Данные анализа ДТА приведены на рис. 1. Технология перевода Ti4+ в Ti3+ легко реализуется с помощью водного электролиза [8]. Ранее нами было показано, что выход (NH4)3TiF6 в готовый продукт составляет 85-88% и имеет состав по трехвалентному титану не ниже 95% (согласно рентгенографическим данным). По данным ДТА при нагреве смеси 10% (NH4)3TiF6 + электролит происходит уменьшение массы практически на величину потери NH4F. Таким образом, вводимый нами в электролит титан имеет валентность 3+ и полностью растворяется в объеме.
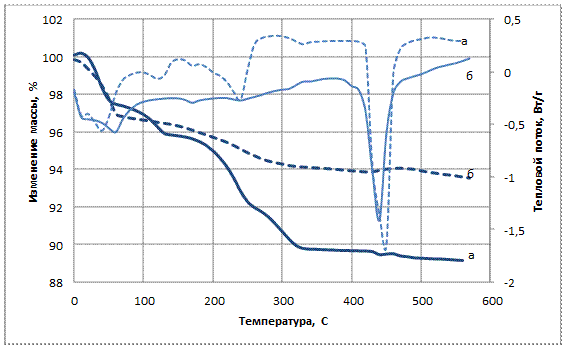
Рис. 1. Изменение массы смесей при нагреве: а) 10% (NH4)2TiF6+ электролит; б) 10% (NH4)3TiF6+ электролит.
Для определения оптимального количества вводимого компонента в электролит использовали визуально-политермический метод и метод ДТА. График зависимости приведен на рис. 2.
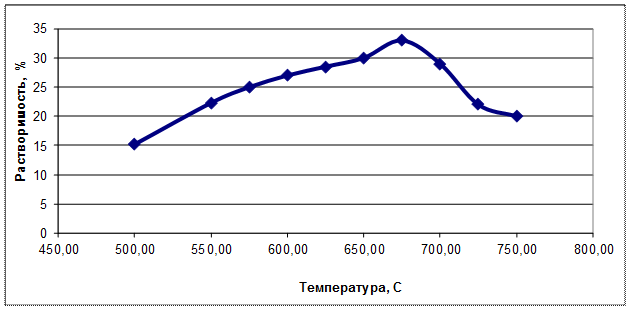
Рис. 2. Растворимость TiF3 в расплаве FLINAK от температуры.
Из анализа данных ДТА установлено, что, несмотря на достаточно большое количество вводимого (NH4)3TiF6 (до 20 % по TiF3), температура плавления смеси повышается всего на 5÷8 °С.
В результате нагревания смеси исходной соли (NH4)3TiF6 с фторидами щелочных металлов может происходить взаимодействие по реакциям:
3KF+(NH4)3TiF6= K3TiF6 +NH3↑+HF ↑ (1)
3NaF+(NH4)3TiF6= Na3TiF6 +NH3↑+HF ↑ (2)
3LiF+(NH4)3TiF6= Li3TiF6 +NH3↑+HF↑ (3)
А также образование более сложных соединений
2KF+NaF+(NH4)3TiF6= K2NaTiF6 +NH3↑+HF↑ (4)
Поскольку в результате растворения (NH4)3TiF6 в расплаве LiF-KF-NaF образуется смесь комплексных фтортитанатов калия, натрия и лития, теоретически рассчитать, по какому механизму будет происходить восстановление титана, крайне затруднительно.
Возможные реакции на катоде:
К+ +е = К0 Е = 2,8В (5)
TiF63- + 6е = Ti0 +6F- Е = 1,75В (6)
3К++ TiF63- = TiF3 +3KF (7)
Образующийся на катоде по реакции (7) трифторид титана восстанавливается до металлического Ti:
Ti3+ +3e = Ti0 Е = 1,65В (8)
Экспериментальная часть
Для проведения экспериментальных исследований по изучению процесса электролитического получения титана из (NH4)3TiF6 была собрана экспериментальная установка (рис. 3). Она состоит из герметичного электролизера: корпус - алундовый тигель, сверху - охлаждаемая водой металлическая крышка. На крышке закреплена фторопластовая пластина с отверстиями для ввода термопары, анода и катода. На крышке также размещены патрубки для подвода аргона и отвода реакционных газов, входа и выхода охлаждающей воды. Анодом служит размещенный внутри установки стеклографитовый тигель объемом 50 мл, катод выполнен из прутка Ni Д = 4 мм.
- Корпус.
- Стеклографитовый тигель.
- Като.
- Нагреватель.
- Баллон с аргоном.
- Узел загрузки.
- Питатель.
- Адсорбер газов.
- Вакуумный насос.
- Источник питания.
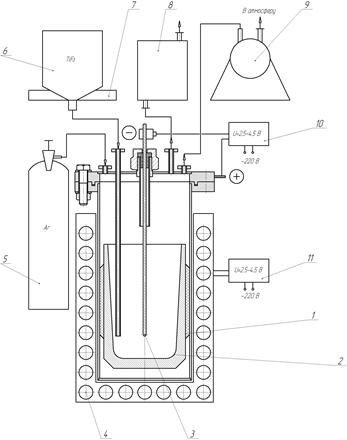
Рис. 3. Схема лабораторного электролизера.
Методика эксперимента
Навеску предварительно подготовленного электролита в количестве 50 г смешивали с 10 г (NH4)3TiF6. После гомогенизирования порошок помещали в стеклографитовый тигель. Для всех опытов состав смеси был одинаков и содержал после улетучивания аммиака и фтороводорода примерно 7,5% масс. по TiF3. Собранный и загруженный смесью электролизер после предварительной продувки аргоном нагревали до Т = 550 °С. Время нагрева составляло в среднем 30 минут. Далее следовала выдержка 1 час для удаления аммиака и фтористого водорода. После этого выставляли начальные условия и проводили процесс электролиза в течение 4 часов. Полученный катодный осадок измельчали и анализировали на содержание Ti. Результаты опытов приведены в таблице 1.
Таблица 1 - Результаты опытов по электролизу титана в расплаве FLINAK
|
Опыт |
Темпе-ратура |
Ток |
U ср, В |
Осадок, г |
Содерж. Ti, г в пробе |
% Ti в осадке |
Теорет., выход Ti по току, г |
% выхода по току |
|
1 |
530 |
1.0 |
2,8 |
0.18 |
0.03 |
16,6 |
2,387 |
1,6 |
|
2 |
580 |
1,0 |
2,66 |
1,8 |
0,38 |
21,1 |
2,387 |
15,9 |
|
3 |
630 |
1,0 |
2,4 |
2,04 |
0,46 |
22,6 |
2,387 |
19,3 |
|
4 |
680 |
1,0 |
2,33 |
1,86 |
0,43 |
23,1 |
2,387 |
18,0 |
|
5 |
730 |
1,0 |
2,0 |
1,82 |
0,41 |
22,5 |
2,387 |
17,1 |
|
6 |
630 |
0,5 |
3,0 |
0,15 |
0,03 |
20,0 |
1,194 |
2,5 |
|
7 |
680 |
0,5 |
2,27 |
0,58 |
0,12 |
20,6 |
1,194 |
10,0 |
|
8 |
730 |
0,5 |
1,7 |
0,57 |
0,11 |
19,3 |
1,194 |
9,2 |
|
9 |
630 |
0,25 |
2,3 |
0,1 |
0,01 |
10 |
0,597 |
1,6 |
Исследования проводили в гальваностатическом режиме. Используемый источник питания постоянного тока PSH-2035 позволял записывать изменения напряжения на электродах во время всего эксперимента. Установившийся потенциал находился в пределах от 1,7 до 2,8 В (в зависимости от условий опыта). Фотография образующегося катодного осадка после проведения процесса электролиза показана на рис. 4.

Рис. 4. Фотография катодного осадка, полученная при Т = 630 °С, I = 1 А.
Обсуждение результатов
Полученные данные свидетельствуют о возможности получения металлического титана из (NH4)3TiF6 электролизом в расплаве щелочных металлов. Из результатов опытов установлено, что оптимально вести процесс в интервале температур 650÷700 °С. При этом удельная плотность тока составила 0,3 А/см2 и достигнуто максимальное выделение титана в катодный осадок -23,1% масс. Полученный в ходе опытов металлический титан имеет мелкокристаллическую структуру и сильно загрязнен материалом электролита. После отмывки от электролита были проведены измерения размеров частиц порошка Ti с помощью сканирующего электронного микроскопа. Они составили 30-50 мкм. Отмытый порошок серого цвета подвергали отжигу в вакуумной печи в течение часа при Т = 1500 °С, после чего сплавляли в среде аргона в электродуговой печи. Полученный королек металлического титана анализировали на сканирующем электронном микроскопе Hitachi S-3400N с приставкой для микроанализа. На срезе образца (рис. 4) видно, что внутри королек имеет сплошную структуру с небольшим количеством пор. Для получения титана монолитного вида требуется вторая переплавка. Результаты микроанализа приведены на рис. 5.
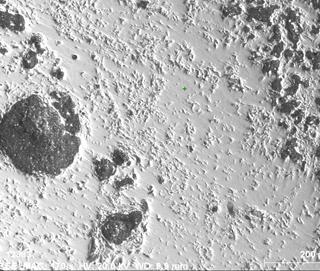
Рис. 4. Микрофотография сплавленного порошка титана в среде аргона.
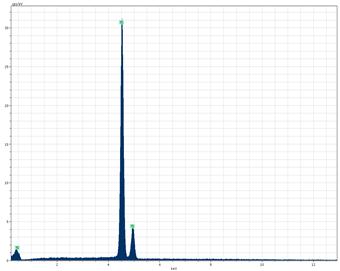
Рис. 5. Спектральный анализ спеченного титана, полученного методом электролиза.Заключение
В процессе электролитического получения титана из (NH4)3TiF6 в расплаве фторидов щелочных металлов образуется мелкокристаллический порошок металла с размерами 30÷50 мкм. Содержание Ti в катодном осадке составляет 20÷30%. Дальнейшей задачей является поиск эффективного способа отделения получаемого порошка титана от электролита для обеспечения возврата электролита в электролизер. Растворение в воде приводит к образованию больших объемов из-за низкой растворимости LiF, что нельзя рекомендовать для промышленности. Полученный нами королек титана имеет показатели по примесям на уровне сплава ВТ-1. Это позволяет отправлять порошок после вакуумной дистилляции либо на стадию прессования титановых изделий методом порошковой металлургии, либо на стадию изготовления прессованных электродов для дальнейшей переплавки.
Рецензенты:
- Буйновский А.С., д.т.н., профессор, Северный технологический институт Национального исследовательского ядерного университета МИФИ (СТИ НИЯУ МИФИ), г. Томск.
- Козик В.В., д.т.н., профессор, зав. кафедрой неорганической химии Томского государственного университета, г. Томск.
Работа получена 14.11.2011
cellpadding=6Библиографическая ссылка
Ворошилов Ф.А., Дьяченко А.Н. ИССЛЕДОВАНИЕ ПРОЦЕССА ЭЛЕКТРОЛИЗА (NH4)3TIF6 В РАСПЛАВЕ LIF-NAF-KF // Современные проблемы науки и образования. 2011. № 5. ;URL: https://science-education.ru/ru/article/view?id=4953 (дата обращения: 23.02.2026).



