Бобовые растения во многих странах, в том числе в нашей республике Азербайджане, являются ценными сельскохозяйственными культурами и важными продуцентами белка. Одним из основных факторов, определяющих их урожайность, является эффективная защита от вредителей и болезней. Природно-климатические условия многих регионов Азербайджана благоприятны для нормального развития и перезимовки основных вредителей и возбудителей болезней этих растений. Здесь циркулируют вирусы растений, поражающие важные в экономическом плане культуры: овощные, злаковые, бобовые, декоративные [1,4]. Одним из распространенных и вредоносных заболеваний бобовых культур является некроз бобовых, вызываемый нановирусами. Быстрая продукция активных форм кислорода, связанная с окислительным взрывом, выступает одной из наиболее ранних ответных реакций растительных клеток на заражение патогеном [2]. АФК сами по себе токсичны для патогена и, кроме того, могут служить вторичными мессенджерами при активации генов, экспрессирующих защитные белки. В ответ на заражение патогеном включаются защитные реакции, такие, как усиление барьерных свойств (лигнификация), экспрессия генов и синтез ряда белков, в том числе ферментов, среди которых особая роль отводится антиоксидантным ферментам. Усиленная активация антиоксидантных ферментов в ответ на заражение наблюдается у разных видов растений и при разных по природе инфекционных процессах (грибных, бактериальных, вирусных болезнях и т.д.) [3]. Растительная клетка обладает мощной системой защиты от окислительного стресса. В нее входят такие ферменты, как: супероксиддисмутаза (СОД), аскорбатпероксидаза (АПО), каталаза (КАТ), глутатионредуктаза, а также неферментативные элементы, такие как каротиноиды, α-токоферол, аскорбат и др. Ряд экспериментальных наблюдений свидетельствует о значительной роли этих ферментов в устойчивости растений к патогенезу.
Основной целью наших исследований являлось изучение активности антиоксидантных ферментов бобовых растений, натурально инфицированных нановирусами.
МАТЕРИАЛЫ И МЕТОДЫ
Объектами исследования служили образцы бобовых растений с характерными признаками болезней. Они были собраны из разных регионов Азербайджана, в том числе из Гекчай, Масаллы, Хачмаз, Джалилабад, Нахчыван, Исмаиллы, Ленкорань летом 2009-2010 гг. Из листьев собранных растений были выделены геномы вирусов, содержащих циклические ДНК.
Экстракция ДНК. ДНК выделяли из молодых свежих листьев по методике Эдвардса с некоторыми модификациями. Осадок ДНК несколько раз промывали в 70 %-ном этоноле, подсушивали и растворяли в 200 мкл RTE буфере (10мМ трис-HCl pH 7.0, 1мМ ЕДТА, 10 мкг RNase мл-1). Образцы ДНК хранили в холодильнике при -200 С.
Амплификация ДНК методом ПЦР. Диагностику вирусов в данных растениях осущствляли с помощью ПЦР c некоторыми модификациями. Для проведения амплификации использовали праймеры, синтезированные фирмой Eurogentec (таблица 1).
Таблица 1. Нуклеотидная последовательность праймеров, использованных для ПЦР
|
Обозначение праймера |
Последовательность 5´ → 3´ |
Ожидаемый размер фрагмета bp |
Tm ( 0C) |
|
Nano F103 |
ATTGTATTTGCTAATTTTA |
~770 |
44 |
|
Nano R101 |
TTCCCTTCTCCACCTTGT |
||
|
C5-F |
TACAGCTGTCTTTGCTTCCT |
~666 |
49 |
|
C5-R |
CGCGGAGTAATTAAATCAAAT |
Амплификацию ДНК проводили в реакционной смеси объемом 25 мкл, которую готовили в микропробирках для ПЦР, поочередно добавляя реактивы. На поверхность ПЦР-смеси наносили 5 мкл исследуемой ДНК, после чего пробирки помещали в амплификатор (Applied Biosystems 2720 Thermal Cycler, США). Протокол амплификации включал соответствующие условия для каждого праймера. Для разделения ПЦР-продуктов проводили электрофорез в 1,5 % агарозном геле. Для визуализации ДНК гель в течение 25 мин инкубировали в растворе бромистого этидия (0,5мкг/мл) и просматривали в ультрафиолете на приборе Gel Documentation System (UVITEK).
Определения активности антиоксидантных ферментов. Для определения активности КАТ (КФ 1.11.1.6) листья растирали в 50 мМ фосфатном буфере, рН 7,0. Гомогенат фильтровали и затем центрифугировали. Полученный ферментный экстракт разбавляли фосфатным буфером и непосредственно перед измерением добавляли 3 %-ную перекись водорода. На спектрофотометре ULTROSPEC 3300 PRO ("AMERSHAM", США) измеряли падение оптической плотности при 240 нм за 1 минуту. Активность рассчитывали в мкмоль/(мг×мин) на основе коэффициента молярной экстинкции ε =39,4 мМ-1см-1 [9].
Активность АПО (КФ 1.11.1.11) определяли по методике [6] с некоторыми модификациями. На холоде растирали 1 г листьев в 50 мМ фосфатного буфера, рН 7,6 и добавляли поливинилпирролидона, фильтровали и центрифугировали. Реакционная смесь состояла из 0,1 мМ ЭДТА, 0,05 мМ аскорбиновой кислоты, 0,1 мМ перекиси водорода, 50 мМ фосфатного буфера, рН 7,6 и растительного экстракта, полученного после центрифугирования гомогената. Растительный экстракт добавляли непосредственно перед измерением. Оптическую плотность регистрировали на спектрофотометре при 290 нм против контроля без ферментного экстракта. Поправку на неферментативное окисление аскорбата (в отсутствие перекиси водорода) не делали, т.к. оно не превышало 5 %. В качестве меры активности использовали понижение оптической плотности за первые 30 с реакции, с последующим расчетом активности в мкмоль/(мг×мин) на основе коэффициента молярной экстинкции ε = 2,8 мМ-1см-1.
Для определения активности СОД (КФ 1.15.1.1) использовали специальный кит для определения активности СОД (SOD Assay Kit-WST, Sigma-Aldrich). Растительные клетки обладают несколькими формами СОД. Нами был проведен анализ цитозольной фракции фермента. Навеску листьев гомогенизировали в 50 мМ калий-фосфатного буфера, рН 7,8. Гомогенат центрифугировали, а супернатант использовали как грубый экстракт цитозольной фракции СОД. Оптическую плотность измеряли при 450 нм.
Активность ГР (КФ 1.6.4.2) определяли спектрофотометрически по уменьшению оптической плотности при длине волны 340 нм в результате окисления НАДФ.Н в присутствии окисленного глутатиона [7]. Реакционная среда содержала 100 мМ фосфатного буфера (рН 7,8), 1 мМ EDTA, 0,2 мМ НАДФ.Н и 0,5 мМ окисленного глутатиона. Измерение оптической плотности проводили в течение 10 минут. Активность фермента рассчитали в мкмоль/(мг×мин) на основе коэффициента молярной экстинкции ε=6,2 мМ-1см-1.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате маршрутных обследований, проводимых летом 2009-2010 гг. на основных культурных посевах бобовых растений, были выявлены симптомы потенциальных инфекций нановирусов. Наблюдения показали, что южная зона Азербайджана идеальна для размножения и распространения вектор - насекомых нановирусов - тлей (aphids), что в будущем может стать серьезной угрозой для сельского хозяйства нашей страны. ПЦР анализ с праймерами NanoF103, NanoR101; C5F, C5R также выявил в ДНК бобовых фрагменты ДНК ожидаемых размеров- 770, 660 п.о., соответственно (рис. 1). Результаты ПЦР анализа представлены на рис.1.

Рис. 1. Электрофореграммы ПЦР продуктов, полученных c применением следующих праймеров: A - Nano F103, Nano R101; B - C5 F, C5 R. Стрелкой указана длина вирусного апликона; M - Маркеры молекулярной массы (Gene RulerTM 100 bp, DNA Ladder, "Fermentas"); 1-3- образцы бобовых с Лерикского района
В результате проведенных анализов ПЦР продукты ДНК бобовых растений дали идентичные профили с вирусом некротической желтухи бобов (Faba Bean Necrotic Yellows Virus - FBNYV). Итак, ПЦР анализ еще раз подтвердил присутствие инфекции - ранее идентифицированных три нановируса, два отличаемых вируса некротической желтухи бобов (Faba Bean Necrotic Yellows Virus - FBNYV) и один вирус некротической задержки роста бобов (Faba Bean Necrotic Stunt Virus - FBNSV) в этих образцах, используя метод RCA-RFLP [1,4]. Таким образом, было установлено наличие инфекции в бобовых растениях, а также определена их идентичность нановирусами. Нановирусы - Nanoviridae относятся к одноцепочечным ДНК- содержащим вирусам растений (ssDNA). Нановирусы (Nanoviridae) разделяются на 2 группы, которые отличаются по структуре генома. Это представители рода нановирус (genus Nanovirus), которые содержат монокомпонентный геном, который кодирует 8 белков (DNA-R, -S, -M, -C, -N, -U1, -U2, -U4) и представители рода бабувирус (genus Babuvirus), монокомпонентный геном этих вирусов кодирует 6 белков [3].
Известно, что вирусы могут вызывать в растениях окислительный стресс, который индуцируется образованием активных форм кислорода. Замечательным свойством растений является их способность индукции активности своих антиоксидантных систем в неблагоприятных условиях [10]. Антиоксидантная система позволяет клетке избежать последствий токсического действия свободных радикалов.
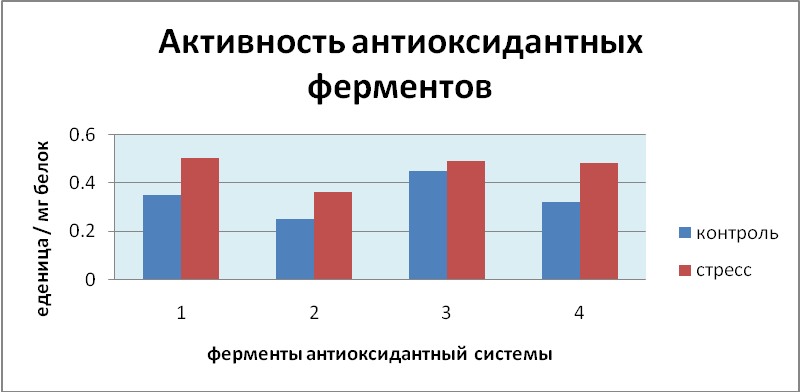
Наши исследования антиоксидантной системы Cicer arietinum
Рис.2. Активность антиоксидантных ферментов гороха - Cicer arietinum при инфицировании нановирусами. 1- активность КАТ, 2- активность АПО, 3- активность СОД, 4- активность ГР
В процессе инфицирования нановирусами активность антиоксидантных ферментов в основном имела высокое значение у всех образцов Cicer arietinum L. Как видно на рис. 2, у стрессовых вариантов, когда активность КАТ сильно повышается, в активности АПО наблюдаются незначительные изменения относительно контрольного варианта. В случае и других ферментов, наблюдалась похожая ситуация, так как, когда активность ГР значительно повышалась, в активности СОД не наблюдается большой разницы значений. Это может свидетельствовать о существующей функциональной связи и конкуренции между изучаемыми ферментами при данном вирозе. В данном случае высокая активность антиоксидантных ферментов, вероятно, может служить одним из маркеров устойчивости к патогену.
Болезни, вызванные нановирусами, широко распространены и наносят серьезный экономический ущерб семеноводству и сельскому хозяйству многих стран мира. Степень влияния вирусной инфекции на хозяйственно ценные признаки зависит от устойчивости сорта, наличия в растении других патогенов, почвенно-климатических условий и воздействия многих факторов окружающей среды. Таким образом, молекулярно-генетическое исследование болезней этих овощей очень важно для производства и селекции устойчивых признаков к биотическим факторам окружающей среды. Перспективным является использование ПЦР для анализа вирусных инфекций в растениях с целью организации производства здорового посадочного материала и планирования селекционных мероприятий.
Рецензенты:
Работа получена 11.11.2011.
Библиографическая ссылка
Гусейнова И.М., Мамедов А.Ч., Султанова Н.Ф. АНТИОКСИДАНТНАЯ СИСТЕМА У ИНФИЦИРОВАННЫХ НАНОВИРУСАМИ БОБОВЫХ РАСТЕНИЙ // Современные проблемы науки и образования. 2011. № 6.
;
URL: https://science-education.ru/ru/article/view?id=4934 (дата обращения: 14.01.2026).



