Введение
Коронавирусная болезнь 2019 г. (COVID-19) – это заболевание, вызванное инфекцией тяжелого острого респираторного синдрома-коронавируса-2 (SARS-CoV-2), вызвавшей пандемию, захватившую весь современный мир и потребовавшей немедленных и решительных действий со стороны медицинского сообщества. По данным на 10 марта 2023 г. пандемия COVID-19 привела к 676609955 случаев заболеваний в мире, которые привели к 6881955 летальным исходам [1]. Помимо повреждения лёгких COVID-19 связан с повреждением множества систем и органов, в том числе сердца и сосудов [2].
Этот вирус использует ангиотензинпревращающий фермент 2 (ACE2) в качестве функционального рецептора для проникновения в клетку. Исследования показывают, что различные ткани, в том числе миокард сердца, экспрессируют белок ACE2 на своей клеточной поверхности [3]. Сердечно-сосудистые проявления COVID-19 могут включать повреждение миокарда, инфаркт, миокардит, симулирующий инфаркт миокарда с подъемом сегмента ST, неишемическую кардиомиопатию, коронарный вазоспазм, перикардит или стрессовую кардиомиопатию (Такоцубо). Первоначальный опыт в Ухане показал, что примерно у 27,8% (52/187) пациентов с COVID-19 было выявлено повреждение миокарда, о чем свидетельствовал повышенный уровень сердечного тропонина-Т [4]. Особенностью поражения миокарда при COVID-19 является развитие выраженных иммунопатологических реакций в сочетании с нарушениями гемостаза, что может вести к развитию широкого спектра сердечно-сосудистых осложнений. Течение COVID-19 потенциально может осложняться острым инфарктом миокарда, венозными и артериальными тромбозами и тромбоэмболиями в различных сосудистых руслах, а также острым повреждением миокарда и миокардитом [5].
Повреждение миокарда связано с худшими исходами COVID-19, тогда как прогноз у пациентов с сопутствующим сердечно-сосудистым заболеванием, но без повреждения миокарда, был сравнительно благоприятным. Точный механизм развития повреждения миокарда при COVID-19 остается неясным, но некоторые предполагаемые механизмы могут включать следующее: прямое вирусное повреждение кардиомиоцитов, разрыв атеросклеротической бляшки, цитокиновый шторм, гипоксия, системная воспалительная реакция, коронарный вазоспазм, микротромбоз или микроангиопатия, вызванные протромботическим или коагулопатическим состоянием системы гемостаза и прямое эндотелиальное или сосудистое повреждение [6].
Так как повреждение сердца связано с более неблагоприятным исходом у пациентов с COVID-19, оно требует надлежащего выявления и мониторирования. При этом все патологические эффекты, связанные с повреждением сердца, могут быть обнаружены в виде различных паттернов на ЭКГ. В систематическом обзоре работ, посвященных нарушениям ритма сердца при COVID-19 Mehraeen E. и соавт. выделили два типа изменений: связанных с приемом проаритмогенных лекарственных средств, а также не связанных с лекарственной терапией [7]. В подавляющем большинстве исследований сообщалось о повышенном риске удлинения корригированного интервала QT (QTc) под влиянием различных схем терапии COVID-19, включавших хлорохин, гидроксихлорохин и азитромицин. Хотя эти препараты увеличивали риск серьезного удлинения интервала QTc, в проанализированных статьях не было выявлено их связи с возникновением летальных исходов аритмогенного характера. При сравнении электрокардиографических изменений в зависимости от применения проаритмогенных препаратов для лечения COVID-19, в группе больных, не получавших проаритмогенные препараты, аномалии сегмента ST и зубца T, особенно подъем сегмента ST, составляли наиболее часто наблюдаемую находку на ЭКГ у пациентов с COVID-19. При этом связь этих изменений с повреждениями миокарда, как вирусными и ишемическими, так и неспецифическими, тем не менее была сомнительной. В систематическом обзоре, посвященном изменениям на ЭКГ у больных COVID-19, было показано, что заболевание ассоциировано с такими патологическими изменениями, как удлинение QTc, фибрилляция предсердий и желудочковая тахикардия. Также в обзоре было отмечено, что указанные нарушения ритма нередко предшествовали остановке сердца [7]. Значительное удлинение интервала QTс, развивающееся на фоне медикаментозной терапии (p <0,05), возникало при отсутствии предшествующих отклонений QTc на исходной ЭКГ. В случае удлинения интервала QTс пациенты получали хлорохин/гидроксихлорохин в сочетании с азитромицином (комбинированная терапия) или без него (монотерапия).
Остановка сердца также является тяжелым осложнением COVID-19. Shao F. et al. изучили 136 пациентов с тяжелой формой COVID-19 в г. Ухань, у которых во время госпитализации произошла остановка сердца. Исходными паттернами ЭКГ и сердечными ритмами были фибрилляция желудочков и желудочковая тахикардия (8, 5,9%), и асистолия (122, 89,7%). Остановка сердца происходила после медианы 10 дней госпитализации и была связана с низкой выживаемостью пациентов [8].
По данным исследования van den Broek и его коллег, фибрилляция предсердий присутствовала на исходной ЭКГ у 11% госпитализированных больных COVID-19 [9]. Что касается впервые возникшей фибрилляции предсердий, Saleh и др. продемонстрировали, что фибрилляция предсердий на фоне лечения COVID-19 в госпитале с применением хлорохина, гидроксихлорохина и азитромицина развивалась у 8,5% пациентов [10]. Желудочковая тахикардия также встречается у больных COVID-19, в исследовании Saleh и др. 7 (3,5%) госпитализированных пациентов продемонстрировали признаки мономорфной неустойчивой желудочковой тахикардии, а у 1 (0,5%) был устойчивая гемодинамически стабильная мономорфная тахикардия [10]. При анализе изменений ЭКГ при поступлении у пациентов с COVID-19 в исследовании Bergamaschi L и др. у пациентов с COVID-19 гипертрофия левого желудочка отмечалась у 16 (7.4%) пациентов. При этом, при анализе исходов с учетом данных ЭКГ было установлено, что гипертрофия левого желудочка при поступлении была выявлена у 10 (18.5%) больных, потребовавших в дальнейшем интубации трахеи и респираторной поддержки, а также скончавшихся за время госпитализации, и у 6 (3.7%) больных, не столкнувшихся в этими осложнениями (p<0,01) [11].
По данным Рябыкиной М.В., среди больных COVID-19, госпитализированных в Институт кардиологии ФГБУ «Национальный медицинский исследовательский центр кардиологии» наиболее частыми признаками поражения функции правых отделов сердца относились правопредсердная фаза зубца Р (41,3 %), неполная блокада правой ножки пучка Гиса (42,6%), изменения ЭКГ по типу SI-QIII-TIII (33,3 %), типичного для тромбоэмболических событий, а также признаков гипертрофии правого желудочка, преимущественно в виде роста зубца SV5-6 (14,7 %). Эти изменения либо наблюдались в сочетании с признаками напряжения миокарда правого желудочка (16%), либо сопровождались высокими положительными остроконечными зубцами Т в большинстве отведений, которые в данной ситуации являлись признаками диффузной гипоксии [12].
Вся вышеперечисленная информация зарубежных и российских авторов о различных нарушениях ритма сердца и проводимости побудила авторов обратить особое внимание на данную проблему и начать исследование с целью сравнения клинико-лабораторных данных и частоты встречаемости электрокардиографических нарушений у выживших и умерших больных, госпитализированных по поводу средней или тяжелой степени тяжести COVID-19.
Цель исследования: сравнение клинико-лабораторных данных и частоты встречаемости электрокардиографических нарушений у выживших и умерших больных, госпитализированных по поводу средней или тяжелой степени тяжести COVID-19.
Материал и методы исследования
Исследование проводилось ретроспективно по типу случай-контроль. Объём выборки был рассчитан с учетом ранее проведенных схожих исследований [11] при Alpha=0,05 и силе исследования 80%, и был равен 30 пациентам в каждой группе, для чего были отобраны 60 завершенных историй болезни пациентов с COVID-19 со среднетяжелым и тяжелым течением заболевания, которые находились на стационарном лечении в ГКБ им. Братьев Бахрушиных с 10.09.2020 по 10.10 2020 г. и подписывали при поступлении в стационар информированное согласие на обработку персональных данных. Эти пациенты были рандомизированы случайным образом и выбраны с учетом клинического исхода госпитализации, в результате чего были сформированы две группы: в первой группе 30 человек было выписано с выздоровлением и во второй 30 человек с летальным исходом вследствие COVID-19 с непосредственной причиной смерти в виде отека легких или головного мозга. С учетом того, что карты были подобраны случайным образом, по 5 карт из каждой группы было исключено в связи с недостатком данных. Таким образом, при непосредственном анализе результатов объём карт в группах составил 25 человек. При поступлении в клинику всем больным проводилось клиническое и лабораторное обследование, измерение SpO2, выявление РНК SARS-CoV-2, ЭКГ покоя и компьютерная томография органов грудной клетки (КТ ОГК). Тяжесть течения заболевания определялась с учетом актуальных на тот момент временных методических рекомендаций по лечению COVID-19 (версия 8 от 03.09.2020)., которые также включали результаты оценки состояния по шкале NEWS-2.
Средний возраст пациентов составил 71 [60; 80] год, из них 27 мужчин и 23 женщины. В среднем пациенты, независимо от исхода (выписка или смерть от COVID-19), находились на стационарном лечении 10 [8; 15] койко-дней, при этом обе группы получали идентичную симптоматическую и противовирусную терапию (антикоагулянты, дексаметазон, при необходимости иммунодепрессанты и антибиотики) согласно актуальным на тот момент временным методическим рекомендациям по лечению COVID-19 (версия 8 от 03.09.2020). Конечной точкой считалась выписка из стационара или летальный исход от COVID-19.
Статистическая обработка данных проводилась с помощью программы Statistica 10. Данные представлены в виде M±SD, где M – средняя арифметическая величина вариационного ряда, а SD – стандартное отклонение в случае правильного распределения, а также Ме [25; 75%] в случае неправильного распределения. Для сравнения количественных показателей применяли критерий Манна-Уитни, критерий Вилкоксона для связанных выборок. Взаимосвязь между признаками определялась с помощью корреляционного анализа по Спирмену. Различия и взаимосвязь между показателями считались статистически значимыми при р <0,05.
Результаты исследования и их обсуждение
При сравнении между группами авторы не выявили значимых отличий по возрасту, полу, артериальному давлению (АД), концентрации SpO2 и поражению легких по данным КТ ОГК в процентах и степени тяжести при поступлении (табл. 1).
Таблица 1
Основные клинические данные пациентов с SARS-CoV-2 в стационаре
|
Показатели |
Выписаны n=25 |
Летальный исход n=25 |
p |
|
Возраст (лет) |
65,2±15,5 |
72,4±11,5 |
0,15 |
|
Мужской пол, n (%) |
13 (52) |
14 (56) |
0,83 |
|
Сопутствующая патология, n (%): Ишемическая болезнь сердца Артериальная гипертензия Сахарный диабет 2 типа Хронический пиелонефрит |
10 (40) 16 (64) 5 (20) 0 |
19 (76)* 20 (80) 8 (32) 7 (28) |
0,04 0,3 0,6 – |
|
Систолическое АД (мм рт. ст.) |
128±15 |
130±19 |
0,7 |
|
Диастолическое АД (мм рт. ст.) |
78±7 |
77±16 |
0,7 |
|
Степень тяжести при поступлении, n (%): Средней степени Тяжелой степени |
22 (88) 2 (12) |
16 (64) 9 (36) |
0,2 0,3 |
|
SpO2 (%) |
93 (92; 95) |
92 (91; 93) |
0,5 |
|
КТ ОГК (%) |
50 (25; 70) |
75 (33; 75) |
0,2 |
Примечание: *p <0,05 – различия статистически значимы.
Составлена авторами на основе полученных данных в ходе исследования.
При оценке сопутствующих заболеваний по данным анамнеза в группе пациентов с летальным исходом более часто встречались пациенты с хроническим пиелонефритом и ишемической болезнью сердца.
Также были проанализированы биохимические показатели у этих пациентов (табл. 2) и выявлено, что С-реактивный белок и креатинин были значимо повышены в группе с летальным исходом. Эти данные могли быть связаны как непосредственно с выраженностью воспаления при COVID-19, так и с поражением почек, вероятно связанным с нефропатией и пиелонефритом в анамнезе.
Таблица 2
Основные лабораторные показатели пациентов с COVID-19 в стационаре
|
Показатели |
Выписаны n=25 |
Летальный исход n=25 |
p |
|
Глюкоза, ммоль/л |
6,3 (5,3;8,1) |
7,1 (6,2;10,3) |
0,11 |
|
Креатинин, ммоль/л |
91 (84;100) |
107 (88;136) |
0,02* |
|
С-реактивный белок, мг/л |
59 (25;86) |
100 (52;171) |
<0,01* |
|
Повышение Д-димера, n (%) |
7 (28) |
10 (40) |
0,3 |
|
Калий, ммоль/л |
3,9 (3,5;4,8) |
4,2 (3,6;4,8) |
0,2 |
|
Лактатдегидрогеназа, ЕД/л |
377 (261;529) |
555 (385;875) |
0,12 |
|
Креатининфосфокиназа, ЕД/л |
171 (55;249) |
181 (87;414) |
0,15 |
|
Лейкоциты, 10*9/л |
5,4 (3,5;9,0) |
5,6 (3,8;9,8) |
0,5 |
|
Тромбоциты, 10*9/л |
184 (145;270) |
149 (116;207) |
0,3 |
Примечание: *p<0,05 – различия статистически значимы. Составлена авторами на основе полученных данных в ходе исследования.
Так как данные ЭКГ не учитывались при маршрутизации пациентов с COVID-19, авторы решили проанализировать результаты ЭКГ, зарегистрированные при госпитализации данных больных для того, чтобы выявить особенности у пациентов с неблагоприятным прогнозом.
При анализе интервалов PR, QTс и ширины QRS по данным ЭКГ, не получили значимых отличий между группами (p<0,05) при оценке частоты встречаемости указанных параметров (рис. 1). Частота встречаемости различных сочетаний этих нарушений не анализировались.
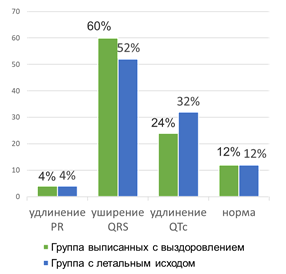
Рис. 1. Интервальные данные ЭКГ зарегистрированных при госпитализации Составлен авторами по результатам данного исследования
Удлинение интервала PR, которое отмечалось у 12% больных в обеих группах, вероятно связано с возрастными дегенеративными изменениями миокарда в то время, как удлинение интервалов QRS QTс может ассоциироваться как с возрастными неспецифическими нарушениями проведения, так и самим заболеванием, что подтверждается литературными данными об удлинении QRS на фоне COVID-19.
Тем не менее, при более детальном анализе авторы отметили, что в группе с летальным исходом чаще выявлялась гипертрофия левого желудочка по данным ЭКГ – у 11 (44%) больных с летальным исходом против 3 (12%) (p<0,05) выписанных больных. Также при сравнении групп с летальным исходом и выписанных с улучшением в группе с летальным исходом при поступлении в стационар статистически значимо более часто отмечались отклонение электрической оси сердца (ЭОС) резко влево от -40 до -80 (рис. 2) за счет блокады передней ветви левой ножки пучка Гиса (ЛНПГ) у 5 (20%) против 1 (4%) (p<0,05), а также наличие нарушений ритма по типу наджелудочковой (НЖЭ) у 5 (20%) больных против 2 (8%) (p<0,05) и желудочковой экстрасистолии (ЖЭ) у 2 (8%) против 0 (0%) (p<0,05).
Анализ исходов госпитализации с учетом степени отклонения ЭОС (рис.2) и наличия или отсутствия НЖЭ и ЖЭ (рис. 3) представлены на рисунках 2 и 3 соответственно.
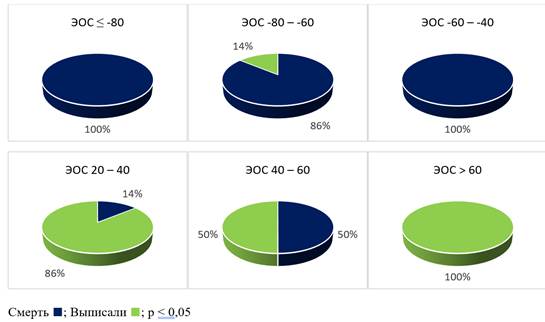
Рис. 2. Оценка исходов COVID-19 с учетом положения электрической оси сердца (ЭОС) Составлен авторами по результатам данного исследования
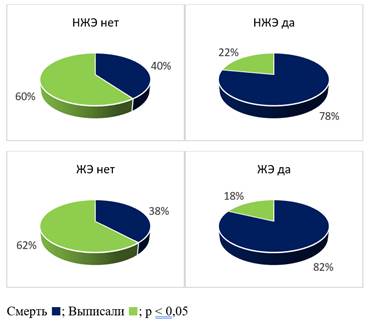
Рис. 3. Оценка исходов COVID-19 с учетом наличия желудочковой и наджелудочковой экстрасистолии. Составлен авторами по результатам данного исследования
Авторами были проанализированы клинические, инструментальные, лабораторные и электрокардиографические показатели больных с COVID-19, поступивших в стационар, для выявления неблагоприятных прогностических факторов течения заболевания. С учетом отсутствия значимых отличий по возрасту, полу, АД, концентрации SpO2, поражению легких по данным КТ в процентах и степени тяжести при поступлении между группами выписанных и погибших больных, особенно значимым становится выявление особенностей течения COVID-19, связанных с неблагоприятным исходом.
Среди наиболее распространенных факторов госпитальной летальности оказались такие коморбидных состояния, как ишемическая болезнь сердца и пиелонефрит, что указывает на необходимость тщательного сбора анамнеза у больных COVID-19 для выявления больных более высокого риска. Статистически значимо более высокий уровень C-реактивного белка в сыворотке крови у больных в группе летального исхода соответствует международным данным о положительной связи между плазменной концентрацией С-реактивного белка и тяжестью течения COVID-19 [13]. Более высокий уровень креатинина в группе с летальным исходом может быть ассоциирован как со снижением функции почек на фоне полиорганной недостаточности, так и со снижением функции почек на фоне самостоятельных заболеваний, что косвенно подтверждается наличием 7 случаев пиелонефрита в анамнезе среди погибших больных.
Статистически значимая положительная связь наличия подтвержденного диагноза пиелонефрита в анамнезе и летального исхода заслуживает отдельного внимания, так как в период пандемии COVID-19 многие больные с пиелонефритом столкнулись с трудностями в получении амбулаторной помощи по поводу своего заболевания. Более того в период пандемии стало отмечаться повышение числа тяжёлых осложнений пиелонефрита вплоть до нефрэктомии и летального исхода [14]. В то же время, по ряду клинических наблюдений, COVID-19 может быть ассоциирован с тяжелыми пиелонефритами у госпитализированных больных, особенно при наличии сахарного диабета 2 типа, вероятно из-за присоединения внутрибольничной бактериальной или грибковой инфекции [15, 16].
При анализе ЭКГ в двух группах авторы не выявили значимых отличий по таким параметрам, как интервалы QTc и ширина QRS. Отсутствие значимого удлинения интервала PQ можно объяснить отсутствием хлорохина и гидроксихлорохина в схемах терапии больных COVID-19, вошедших в выборку для проведения исследования. В то же время было выявлено статистически значимое повышение частоты ряда ЭКГ-изменений в группе больных с летальным исходом. Так, в этой группе статистически значимо чаще встречались гипертрофия левого желудочка, отклонение ЭОС резко влево за счет блокады ЛНПГ, а также и наличие нарушений ритма по типу НЖЭ и ЖЭ. Стоит обратить внимание на то, что при ведении больных с COVID-19 основное внимание врачей-клиницистов обычно приковано к более жизнеопасным нарушениям ритма сердца и проводимости, например, блокадам синусового и атриовентрикулярным блокадам, полным блокадам ножек пучка Гиса и удлинению интервала QTс. В то же время, выявленные авторами взаимосвязи указывают на необходимость внимательного анализа ЭКГ у больных с COVID-19 и контроля за состоянием пациентов с признаками гипертрофии левого желудочка, резким отклонением ЭОС влево на фоне блокады передней ветви ЛНПГ и при наличии НЖЭ и ЖЭ. Подобный анализ может быть особенно ценным на амбулаторном этапе при принятии решения о месте дальнейшего лечения больного COVID-19 и возможной госпитализации пациентов в случае выявления изменений ЭКГ.
Заключение
В заключение авторы констатируют, что наличие ишемической болезни сердца и хронического пиелонефрита в анамнезе, повышение сывороточного креатинина, С-реактивного белка по лабораторным данным, статистически более значимо сочетались с повышением частоты летальных исходов при COVID-19. В то же время выявление нарушений внутрижелудочковой проводимости по типу блокады передней ветви левой ножки пучка Гиса, электрокардиографических признаков гипертрофии левого желудочка, наличие нарушений ритма связаны с неблагоприятным прогнозом, что предполагает необходимость проводить электрокардиографию на амбулаторном этапе пациентам с COVID-19.
Конфликт интересов
Библиографическая ссылка
Ющук Е.Н., Садулаева И.А., Хадзегова А.Б., Крылова Н.С., Трофименко О.С., Щербак М.М., Есенова Э.К. ОЦЕНКА КЛИНИКО-ЛАБОРАТОРНЫХ И ЭЛЕКТРОКАРДИОГРАФИЧЕСКИХ НАРУШЕНИЙ У БОЛЬНЫХ, ГОСПИТАЛИЗИРОВАННЫХ СО СРЕДНЕТЯЖЕЛЫМ И ТЯЖЕЛЫМ ТЕЧЕНИЕМ COVID-19 // Современные проблемы науки и образования. 2025. № 6. ;URL: https://science-education.ru/ru/article/view?id=34391 (дата обращения: 07.01.2026).



