Введение. Аффективные расстройства являются распространёнными психическими нарушениями, которые существенно влияют на физическое и психологическое состояние матери и ребёнка [1]. Современные исследования выявляют ключевую роль нейроэндокринных изменений, особенно дисфункцию гипоталамо-гипофизарно-надпочечниковой системы, в патогенезе этих нарушений и развитии послеродовой депрессии [2]. Резкое прекращение плацентарной секреции кортикотропин-рилизинг гормона после родов вызывает длительную гормональную перестройку, повышая уязвимость к стрессу [2]. Послеродовая депрессия оказывает негативное влияние не только на здоровье матери, но и на психофизиологическое развитие ребёнка, что подчёркивает важность своевременной диагностики, изучения патогенетических механизмов развития данного расстройства с целью разработки комплексного лечения.
Аффективные расстройства у рожениц представляют собой значимую проблему для специалистов в области акушерства, гинекологии, психотерапии и психиатрии. Несмотря на значительные достижения в области диагностики, патогенез послеродовой депрессии (ПРД) остаётся недостаточно изученным. Работы, посвященные поиску лабораторных маркеров депрессивных расстройств во многом противоречивы, что подтверждает необходимость изучения патогенетических механизмов развития гипотимических расстройств с целью своевременной профилактики и лечения.
Цель исследования – на основе анализа динамики гормональных, иммунных, нейротрансмиттерных показателей крови женщин с аффективными расстройствами, возникшими в период беременности и родов, изучить патогенетические механизмы развития психической патологии, выявить гуморальные маркеры депрессивных расстройств.
Материал и методы исследования. В представленном обзоре проанализировано 34 отечественных и зарубежных источника литературы. Использовались поисковые системы еLibrary, Sci-hub, PubMed, Cyberleninka. Ключевыми словами для поиска литературы являлись: послеродовая депрессия, кинурениновый путь, нейротрофины, селективные ингибиторы обратного захвата серотонина. Изучена литература за период с 2019 по 2025 год. На исследование получено заключение локального этического комитета Мордовского государственного университета № 10 от 16.09.2024 года.
Результаты исследования и их обсуждение. Проблемы психического здоровья оказывают значительное влияние на общество. По данным Всемирной организации здравоохранения, психические расстройства приводят к потере 10,5% общего количества лет жизни, которые человек проводит в состоянии нетрудоспособности [2]. Беременность и послеродовой период, особенно последние недели перед родами и первые полтора месяца после них, представляют собой время повышенного риска развития депрессии у женщины [2]. Если депрессивное состояние возникает во время беременности, особенно после 30-й недели, это значительно увеличивает вероятность его сохранения и после родов [3].
Исследования свидетельствуют о тесной связи между психологическим складом первородящих женщин и особенностями проявления у них послеродовой депрессии. Наиболее выраженные симптомы послеродовой депрессии тяжёлой степени встречались у лиц с аффективно-лабильным типом личности. У женщин с застревающими и тревожно-боязливыми чертами обычно наблюдались депрессивные расстройства средней степени тяжести. В патогенезе депрессивных расстройств, возникающих в период беременности, важную роль может играть коморбидная эндокринная и кардиологическая патология, обусловленная физиологическими изменениями и гормональной перестройкой организма, приводящей в ряде случаев к значительной прибавке массы тела и в последующем к ожирению. В связи с этим изучение патогенетических механизмов развития, а также своевременная диагностика и коррекция сопутствующих эндокринных и кардиологических нарушений при депрессивных расстройствах представляются крайне важными для эффективного лечения депрессий у беременных. Наличие электрокардиологических изменений коррелирует с выраженностью депрессивных симптомов и может служить маркером тяжести состояния [4]. Лёгкие формы депрессии чаще диагностировали у рожениц с аффективно-экзальтированным и эмотивным типом личности. У беременных, страдающих паническими атаками и тревогой, функционирование вегетативной нервной системы характеризуется повышенной адаптационной изменчивостью. При панических атаках выявлена дезинтеграция физиологических, когнитивных и эмоциональных процессов, что оказывает негативное влияние на функцию сердечно-сосудистой системы [5]. Восстановление адекватного гормонального фона и модуляция гуморального иммунного ответа при гипотимических расстройствах, сочетающихся с различной коморбидной патологией, позволяют оптимизировать взаимодействие между эндокринной и иммунной системами и способствуют регрессу патологических симптомов [6]. Изучение патогенетических механизмов определяет эффективность лечения и улучшает исходы беременности при различных патологических состояниях.
Послеродовые депрессии делятся на четыре типа: тревожно-депрессивный, истеро-депрессивный, астено-депрессивный и меланхолический. Тревожно-депрессивный тип встречается чаще всего и характеризуется тревогой, замедлением мышления, двигательной заторможенностью, суицидальными мыслями и диссомнией [7]. Соматические проявления включают неприятные ощущения в эпигастрии, тошноту, тахикардию и гипергидроз. Матери с тревожными расстройствами проявляют гиперопеку и беспокойство о здоровье ребёнка. Истеро-депрессивный тип проявляется стремлением быть в центре внимания, драматизацией состояния и колебаниями настроения [7]. Патофизиология послеродовой депрессии сложна и до конца не выяснена. Однако есть данные о том, что биологические факторы, включая гормональные, иммунные и нейротрансмиттерные, могут играть определённую роль. Безусловно, нейроэндокринная система играет ключевую роль в регуляции работы всего организма, обеспечивая поддержание его гомеостаза. Более того, нормальная репродуктивная функция у женщин формируется благодаря сложному взаимодействию различных структур, включая кору головного мозга, гипофиз, надпочечники и яичники. Таким образом, слаженная работа этих органов и систем является основой женского здоровья [8]. Анализ некоторых предрасполагающих факторов риска и патогенетических механизмов развития аффективных расстройств представлен на рисунке 1.
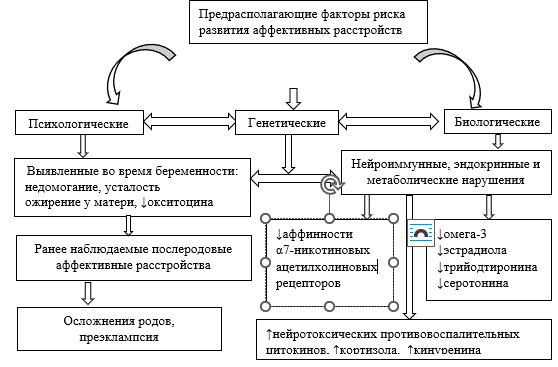
Рис. 1. Роль нейротрансмиттерных, гормональных, иммунных факторов в развитии аффективных расстройств во время беременности и послеродовом периоде
Примечание: составлено авторами на основе источника [9].
Триптофан – кинуренин – серотониновая модель послеродовой депрессии. Центральным звеном ПРД в данной модели выступает α-аминокислота триптофан, которая метаболизируется до нескольких биологически активных молекул, две из которых играют ведущую роль в патогенезе – это серотонин и кинуренин [9]. В организме триптофан окисляется в кинуренин двумя основными путями: в иммунных клетках и нервной системе. Этот процесс в нервной системе катализуется ферментом индоламин-2,3-диоксигеназой, тогда как в большинстве других тканей за него отвечает триптофан-диоксигеназа. Усиленная экспрессия этих ферментов приводит к повышенному расходованию триптофана на синтез кинуренина, снижая его доступность для синтеза серотонина. Дисбаланс между серотониновым и кинурениновым путями метаболизма может играть ключевую роль в патогенезе депрессии [9; 10]. Метаболизм кинуренина происходит по двум направлениям. В первом из них под действием фермента кинуренин-3-монооксигеназы образуется 3-гидроксикинуренин, который далее преобразуется в 3-гидроксиантраниловую кислоту, хинолиновую кислоту и в никотинамидадениндинуклеотид (NAD+) [10]. Помимо этого, хинолиновая кислота подавляет синтез важнейших нейротрофинов, включая фактор роста нервов (NGF) и нейротрофический фактор мозга (BDNF). Недостаток нейротрофинов является достоверным биомаркером послеродовой депрессии. В другом направлении кинуренин превращается в кинуреновую кислоту с помощью кинуренин-аминотрансферазы и выполняет защитную функцию [10]. Генетические исследования подтверждают гипотезу о том, что метаболизм триптофана и серотонина играет роль в развитии ПРД. Существует сильная корреляция между носителями длинного аллеля переносчика серотонина – гена 5-HTTLPR и ПРД [11]. Влияние гена 5-HTT и гена 5-HTTLPR обычно обсуждается в сочетании с факторами окружающей среды. Согласно данным исследований, полиморфизмы гена 5-HTT становятся значимыми предикторами развития депрессивных симптомов исключительно при наличии неблагоприятных жизненных обстоятельств у беременных. В частности, носительство S-аллеля потенцирует негативное воздействие стрессовых факторов, что особенно заметно в позднем послеродовом периоде. Воспалительные процессы играют ключевую роль в нарушении метаболического равновесия триптофана [11].
В течение физиологической беременности наблюдаются последовательные изменения иммунного статуса. Первый триместр характеризуется провоспалительным состоянием, критически важным для успешной имплантации эмбриона и формирования плаценты. Этот период сопровождается активной продукцией провоспалительных медиаторов [11]. Во втором триместре доминирует противовоспалительный фон, способствующий оптимальному развитию плода. В третьем триместре вновь усиливается провоспалительная активность, подготавливающая организм к родам. После родов иммунная система постепенно возвращается к своему исходному состоянию. Особое значение имеет способность провоспалительных цитокинов переключать метаболизм триптофана на кинурениновый путь путем активации фермента IDO [12]. Данный биохимический механизм удовлетворяет возросшие энергетические потребности иммунных клеток, поскольку конечным продуктом кинуренинового каскада является НАД+ - незаменимый компонент клеточного энергообмена [12]. Длительная или чрезмерная активация иммунной системы способна нарушать физиологические механизмы регуляции, что в конечном итоге приводит к развитию нейротоксических эффектов и значительному снижению уровня серотонина,посколькуорганизм теряет способность компенсировать эти изменения [12]. Существует чёткая взаимосвязь между уровнем провоспалительных цитокинов, впервую очередьинтерлейкина-6 (IL-6) и интерлейкина-1β (IL-1β), и выраженностью депрессивной симптоматики как во время беременности, так и в послеродовом периоде [12]. Эти данные позволяют предположить, что индивидуальные особенности иммунного ответа и активности фермента IDO могут объяснять часть случаев послеродовой депрессии (ПРД). Вместе с тем наличие случаев ПРД, не ассоциированных с воспалительными процессами, свидетельствует о том, что хотя воспаление и играет существенную роль в патогенезе этого состояния, оно не является обязательным фактором его развития.
Вторым ключевым фактором, который может нарушить гомеостаз триптофана, является реакция на стресс. Исследования показывают, чтопримерно 30% беременных женщин сталкиваются с клинически выраженным психологическим стрессом на различных этапах беременности [13]. Также в группу повышенного риска входятженщины с многоплодной беременностью, у которых уровень стресса растёт по мере увеличения сроков гестации. Ключевыми факторами, способствующими развитию стресса, являются низкий и средний социально-экономический статус, недостаточный уровень образования, возраст старше 35 лет, а также продолжительность брака более 5 лет при отсутствии детей [13]. Для большинства беременныхосновным источникомволнения остаётся беспокойство о течении беременности и предстоящих родах. Перечисленные факторы способны вызвать как острые, так и хронические стрессовые реакции у беременных, приводя к развитию аллостатической нагрузки [13]. Под этим термином понимаетсячрезмерное напряжение адаптационных систем организма, которые в норме обеспечивают гомеостаз посредством выделенияразличных биологически активных веществ - адреналина, кортизола и других гормонов стресса. Однако при длительном или интенсивном воздействии эти механизмы начинают давать сбой, вызывая постепенное истощение ресурсов организма и негативно влияя на работу головного мозга [14].
Стресс способствует переключению метаболизма триптофана на кинурениновый путь как напрямую, так и опосредованно. Основной механизм этого процесса связан с активацией фермента триптофандиоксигеназы (TDO), которая регулируется через глюкокортикоидные рецепторы [15]. В частности, стресс-индуцированное изменение экспрессии TDO происходит благодаря активации гипоталамо-гипофизарно-надпочечниковой оси и последующему действию глюкокортикоидных гормонов, включая кортизол. Повышенный уровень кортизола приводит к снижению чувствительности лимфоцитов к глюкокортикоидам за счёт насыщения соответствующих рецепторов, что постепенно вызывает развитие резистентности к стероидам. Это состояние, в свою очередь, приводит к интенсивной выработкепровоспалительных цитокинов,включая IL-1β, IL-6 и TNF-α, уровень которых значительно возрастает в кровотоке [15; 16]. Повышенная концентрация этих воспалительных маркеров стимулирует экспрессию фермента IDO, что существенно ускоряетпреобразование триптофана в кинурениновом пути метаболизма. Патологический цикл: стресс → воспалительная активация → нарушение метаболизма триптофана → нейротоксическиеэффекты, гдекаждыйэлементусиливает следующий. Активация глюкокортикоидных рецепторов подавляетдействиенейростероида 25-гидроксихолестерина, что усиливает токсическое влияние на NMDA-рецепторы [16]. Хронические формы невротических и депрессивных расстройств характеризуются повышением уровня кортизола периферической крови и нарушением тиреоидной функции [17]. Эти гормональные дисбалансы, воздействуя на нейротрансмиттерные системы и иммунный ответ, могут негативно влиять на гестационный процесс, способствовать развитию послеродовой депрессии. Данные изменения создают двойной удар по нервной системе: усиливается возбуждающая глутаматергическая активность при одновременном ослаблении тормозных ГАМКергических процессов, что ведёт к прогрессирующему повреждению нейронов [18].
Эндокринная динамика ПРД. Гормональные колебания способны модулировать метаболические пути триптофана, что позволяет рассматривать гормональный статус и ассоциированные генетические факторы как ключевые элементы единой патогенетической модели, где центральную роль играет обмен триптофана [19].
Существует сложная взаимосвязь эстрогена с воспалительными процессами: с одной стороны, он положительно коррелирует с уровнем провоспалительного цитокина IL-6, с другой - показывает отрицательную корреляцию с концентрацией кинуренина [20]. Важно отметить, что эстроген и его производные оказывают существенное влияние на баланс кинуренинового пути. Эти изменения приводят к нарушению равновесия в системе, способствуя развитию нейротоксических эффектов.
Динамика прогестерона при беременности повторяет характер изменений эстрогена: его уровень прогрессивно возрастает в течение гестационного периода, а после родов резко снижается, опускаясь ниже исходных значений. Однако, в отличие от эстрогена, прогестерон проявляет выраженные противовоспалительные свойства и способствует активации нейропротекторных метаболитов [21]. Исследования выявили отрицательную корреляцию между уровнем прогестерона и концентрацией противовоспалительного цитокина IL-1β, а также с такими метаболитами кинуренинового пути, как никотинамид и хинолиновая кислота [22; 23]. Важным аспектом действия прогестерона является его модулирующее действиенаактивность Т-лимфоцитов, которые играют ключевую роль в регуляции и разрешении воспалительных процессов. Таким образом, прогестерон выступает как важный физиологический модулятор, способствующийподдержанию баланса в системе кинуренинового метаболизма и ограничению воспалительных реакций [23].
Окситоцин (OXT) играет ключевую роль в регуляции эмоционального состояния стрессоустойчивости иформированиипривязанностиматерииребёнка, а также участвует в процессах родовой деятельности и лактации. Научные данные свидетельствуют о существовании обратной зависимости междуконцентрацией окситоцина при беременности и вероятностью развития послеродовой депрессии - у женщин с пониженным уровнем OXT в плазме крови чаще наблюдается повышенный риск депрессивных расстройств. Стимуляциявыработки окситоцина происходит при таких видахактивности,как грудное вскармливание, физический контакт с ребёнком. Отсутствие данных поведенческих факторов может существенно снижать естественную защитную функцию окситоциновой системы, повышая уязвимость к аффективным нарушениям [24].
Гены OXT играют критически важную роль в регуляции материнского поведения, особенно в процессе грудного вскармливания, что напрямую связано с риском развития ПРД. Особую озабоченность вызывает формирование межпоколенческого цикла передачи уязвимости к депрессии: когда ПРД у матери, обусловленная как неблагоприятным детским опытом, так и генетическими вариациями OXT, приводит к сокращению продолжительности грудного вскармливания. Это, в свою очередь, повышает предрасположенность дочери к развитию ПРД в будущем, создавая порочный круг семейной передачи этого расстройства [25]. Дополнительные исследования подчёркивают комплексное взаимодействие между качеством материнского ухода в раннем послеродовом периоде и генетическими особенностями гена OXT, которые совместно определяют эмоциональное состояние женщины даже через 6 месяцев после родов. Эти данные подчёркивают важность рассмотрения как биологических, так и психосоциальных факторов в понимании механизмов развития послеродовой депрессии.
Во время беременности происходит уникальное изменение работы гипоталамо-гипофизарно-надпочечниковой (ГГН) системы за счет дополнительной секреции кортикотропин-рилизинг-гормона (КРГ) плацентой, начинающейся с 7-й недели гестации [26; 27]. В отличие от физиологических условий, когда КРГ вырабатывается только гипоталамусом, плацентарный КРГ поступает непосредственно в кровоток, создавая особый гормональный баланс с двойной регуляцией: с одной стороны, положительная обратная связь усиливает выработку кортизола под действием плацентарного КРГ, с другой - отрицательная обратная связь подавляет гипоталамический КРГ под влиянием того же кортизола. После родов резкое прекращение поступления плацентарного КРГ вызывает значительную перестройку ГГН-системы [27]. В течение первых 12 недель послеродового периода наблюдается десенсибилизация гормональной регуляции, проявляющаяся сниженной супрессивной реакцией на дексаметазон и замедленным ответом АКТГ на экзогенный КРГ.
Следует отметить, что у здоровых женщин беременность вызывает физиологическое снижение кортизолового ответа на стресс, выполняющее защитную функцию. Однако у пациенток с ПРД выявляются нарушения этого адаптивного механизма: избыточный уровень КРГ во время гестации может потенцировать дефекты стресс-реактивности, а замедленное восстановление функции ГГН-оси в послеродовом периоде повышает уязвимость к развитию аффективных расстройств. Эти данные подчеркивают важность гормональной перестройки как ключевого фактора патогенеза ПРД [28; 29]. Кроме того, исследования показывают, что выявленные нарушения в работе ГГН-системы при послеродовой депрессии могут быть не прямой причиной, а сопутствующим явлением, связанным с повышенным риском у женщин с предшествующим негативным жизненным опытом [30].
При этом нельзя недооценивать роль психологических и психосоматических факторов, которые в совокупности с гормональными изменениями способствуют формированию послеродовой депрессии. Эта взаимосвязь отражена на рисунке 2.
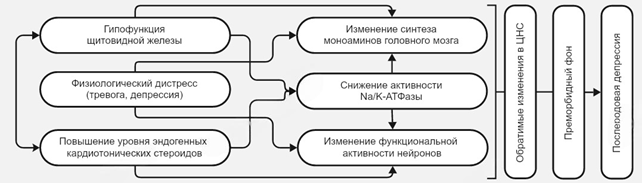
Рис. 2. Анализ некоторых патогенетических механизмов формирования послеродовой депрессии
Примечание: составлено авторами на основе источника [30].
Помимо физиологических изменений, вызванных беременностью, на уровень гормонов стресса могут влиять и социальные факторы, с которыми сталкиваются женщины, такие как нестабильные отношения в семье, беспокойство о развитии ребёнка и тревога из-за изменений в организме, часто связанная с недостатком сна [31]. Согласно исследованиям, общая распространенность бессонницы в третьем триместре беременности достигает 42,4% [32].
Сложности фармакологической терапии данных нарушений связаны с тем, что при лактации лечение должно учитывать риск и пользу для матери и ребёнка. Терапия соматических заболеваний у беременных также требует особого внимания к выбору лекарственных средств, так как многие из них, включая антигипертензивные, способны оказывать неблагоприятное воздействие на нейроэндокринную систему матери и плода, вызывая нарушения психических функций, что обусловлено как особенностями патогенеза развития аффективных расстройств при беременности, так и фармакологическими эффектами препаратов [33]. Полностью безопасные психотропные препараты отсутствуют, особенно для младенцев до года [34]. Своевременная психологическая поддержка женщин на этапе планирования беременности и во время гестации может значительно снизить риск послеродовой депрессии, поскольку позволяет проработать потенциальные ситуативные и личностные факторы риска [35]. Психотерапия и антидепрессанты являются первой линией терапии [36].
Заключение. Проведённое исследование позволило выявить ключевые патофизиологические механизмы, лежащие в основе развития аффективных расстройств при беременности и в послеродовом периоде. Они связанны с дисрегуляцией нейроэндокринных, иммунных и нейротрансмиттерных систем. Установлено, что резкое снижение плацентарного кортикотропин-рилизинг гормона после родов приводит к десенсибилизации гипоталамо-гипофизарно-надпочечниковой системы, сопровождается сниженной супрессивной реакцией на дексаметазон. Анализ метаболизма триптофана показал, что усиленная экспрессия ферментов индоламин-2,3-диоксигеназы и триптофан-диоксигеназы приводит к преобладанию кинуренинового метаболизма, что снижает доступность триптофана для синтеза серотонина. Выявлена связь между уровнем провоспалительных цитокинов и выраженностью депрессивной симптоматики. Отмечена чрезмерная активация иммунной системы, особенно в третьем триместре беременности, что способствует переключению метаболизма триптофана на кинурениновый путь и усугубляет нейротоксические эффекты. Полиморфизм гена окситоцина также ассоциирован с нарушением материнского поведения и повышением уязвимости к депрессии. Полученные результаты подчёркивают роль комплексного подхода к изучению патогенетических механизмов аффективных расстройств, учитывающего биологические, генетические, психологические и социальные факторы.
Конфликт интересов
Библиографическая ссылка
Мозерова К.А., Ермекшова А.И., Колмыкова М.С., Кирюхина С.В., Лабунский Д.А., Подсеваткин В.Г. РОЛЬ ЭНДОКРИННЫХ, ИММУННЫХ И НЕЙРОТРАНСМИТТЕРНЫХ МЕХАНИЗМОВ В РАЗВИТИИ АФФЕКТИВНЫХ РАССТРОЙСТВ В ПЕРИОД БЕРЕМЕННОСТИ И РОДОВ // Современные проблемы науки и образования. 2025. № 6. ;URL: https://science-education.ru/ru/article/view?id=34359 (дата обращения: 12.02.2026).
DOI: https://doi.org/10.17513/spno.34359



