Введение
В настоящее время острое нарушение мозгового кровообращения является одной из ведущих причин заболеваемости, смертности и инвалидизации в России. В связи с высокой распространенностью (1,5–7,4 случая на 1000 населения) актуальность проблемы мозгового инсульта сохраняется из года в год. Основным патогенетическим компонентом инсульта является отек головного мозга, который является главной причиной летального исхода у пациентов с инсультом [1, 2]. Отек мозга – это подъем внутричерепного давления, угроза дислокации и вклинения мозговой ткани, при которых нарушается капиллярный кровоток и нейроны погибают. В зависимости от механизма развития выделяют четыре вида отека мозга: вазогенный, цитотоксический, интерстициальный, осмотический [3, 4]. В условиях повреждения головного мозга имеет место сочетание нескольких типов формирования отека. Отек – набухание головного мозга является в итоге следствием нарушения осмолярности за счет нарушения содержания ионов натрия в плазме крови [5, 6].
Более чем у трети пациентов с ишемическим инсультом нарастание неврологической симптоматики вследствие отека головного мозга отмечается в течение первых 24 ч, что диктует, необходимость проведения противоотечной терапии начиная с первых часов развития данного заболевания [1, 7, 8]. В условиях гипоксии развитие отека, набухания вещества головного мозга, связано с патологией осмолярности плазмы крови вследствие нарушения обмена натрия и глюкозы, изменения секреции мозгового натрийуретического пептида (BNP).
Обязательным компонентом лечения пациентов с ишемическим инсультом является нейропротективная терапия. К нейропротекторным препаратам относится L-лизин эсцинат (водорастворимая соль сапонина каштана конского и аминокислоты L-лизин). В сыворотке крови соль L-лизин эсцината диссоциируется на ионы лизина и эсцината. Эсцин защищает от разрушения лизосомальными гидролазами гликозаминогликаны в стенках микрососудов, нормализуя повышенную сосудисто-тканевую проницаемость, оказывая при этом антиэкссудативное, противоотечное действие [3, 8]. Препарат повышает тонус сосудов. Если гипертонические растворы и салуретики воздействуют на уже развившийся отек, то L-лизин эсцинат предотвращает развитие отека. Благодаря таким эффектам L-лизина эсцинат снижает показатель летальности пациентов [9].
Персонифицированная интенсивная терапия ишемического инсульта на нейрореанимационном этапе предполагает алгоритм с включением L-лизин эсцината, опыт применения которого подтверждает эффективность компонентов препарата при тяжелой черепно-мозговой травме, повреждении легких при коронавирусной инфекции, в остром периоде при различных видах цереброваскулярной недостаточности путем воздействия на сосудистый эндотелий, изменяя его проницаемость и вызывая уменьшение отека мозга и легких [10, 11]. В доступной литературе не обнаружено данных о времени наиболее выраженного противоотечного эффекта L-лизин эсцината у пациентов с ишемическим инсультом.
Цель исследования – определить оптимальные сроки назначения препарата L-лизин эсцината в качестве противоотечного средства у пациентов с ишемическим инсультом.
Материалы и методы исследования
Проведено проспективное одноцентровое клиническое исследование, которое одобрено Этическим комитетом ФГБОУ ВО СОГМА МЗ РФ, протокол № 10.12 от 26 ноября 2020 г.
Обследовано 163 пациента с ишемическим инсультом (ИИ), поступивших на лечение в отделение интенсивной терапии Республиканской клинической больницы. Из них 90 женщин и 73 мужчины, средний возраст пациентов составил 49,6+7,2 года (30–60). Диагноз «ишемический инсульт» в первые сутки от начала заболевания устанавливался на основании клинической картины и подтверждался данными компьютерной и магнитно-резонансной томографии. Состояние пациентов оценивалось по шкале NIHSS [4]. Критерии включения в исследование: возраст от 30 до 60 лет; информированное согласие ближайших родственников на включение в исследование. Критерии исключения из исследования: наличие эндокринной патологии; наличие в анамнезе инсульта.
Все пациенты с первых часов поступления в клинику находились на искусственной вентиляции легких. Ежедневно в утренние часы брались образцы венозной крови для определения осмолярности криоскопическим методом.
Отек головного мозга верифицировался на основании данных измерения внутричерепного давления (ВЧД) аппаратом Camino (США), результатов МРТ-исследования головного мозга на аппарате Airis Vento (Япония) и измерения осмолярности плазмы крови. МРТ-обследование пациентов проводили при поступлении и на пятые сутки пребывания в отделении.
Группе, в которую входило 48 пациентов (28 женщин и 20 мужчин) на фоне базовой интенсивной терапии назначали L-лизин эсцинат: с первых часов поступления в клинику – 24 пациента (группа 1), со вторых суток – 24 пациента (группа 2). Группой сравнения (группа 3) считались пациенты, не получавшие данный препарат в составе базовой интенсивной терапии (115 чел.).
Согласно инструкции 10,0 мл препарата растворяли в 100 мл 0,9 % раствора хлорида натрия и вводили внутривенно капельно в течение 30–40 мин в утренние часы.
Статистический анализ полученных результатов проводился с помощью программы STATISTICA 6,5 и Microsoft Office Excel 2016. Различия показателей считались статистически значимыми при уровне значимости p < 0,05. Для оценки прогноза по уровню ВЧД использовали уравнение фон Берталанфи [9]. Для сравнения процентных величин использовался метод четырехпольной таблицы сопряженных частот.
Результаты исследования и их обсуждение
Динамика измерения внутричерепного давления у пациентов трех групп с ишемическим инсультом на протяжении пяти суток после поступления в клинику представлена в табл. 1.
Таблица 1
Динамика измерения ВЧД у пациентов с ишемическим инсультом
|
Группы пациентов |
1 сутки |
2 сутки |
3 сутки |
4 сутки |
5 сутки |
|
Группа 1 |
27,0+2,3 |
28,1+2,2* |
24,0+1,4* |
24,3+1,3* |
24,1+1,5** |
|
Группа 2 |
26,8+2,0 |
35,9+3,3 |
31,1+2,2 |
31,1+2,9 |
34,5+3,3 |
|
Группа 3 |
26,6+2,0 |
36,8+3,2 |
30,4+2,1 |
30,0+2,0 |
34,6+2,1 |
Примечание. *– p < 0,05; ** – p < 0,001 по отношению к пациентам групп 2 и 3.
Источник: составлено авторами на основе полученных данных в ходе исследования.
У всех пациентов с ИИ с первых суток регистрируется повышение ВЧД (в норме – 6–20 мм рт. ст.).
У пациентов группы 1 начиная со вторых суток отмечалась устойчивая тенденция к снижению величины ВЧД по сравнению с пациентами группы 3, которые не получали в составе интенсивной терапии дополнительно L-лизина эсцинат. На пятые сутки от эпизода ишемии головного мозга у пациентов группы 1 показатели ВЧД были гораздо ниже по сравнению с пациентами группы 3, чем в предыдущие сутки, что характеризовалось статистической достоверностью (p < 0,001). У пациентов группы 2 значения ВЧД в динамике не отличались от таковых, регистрируемых у пациентов группы 3.
Из табл. 1 видно, что с первых суток у пациентов с ИИ отмечалось повышение ВЧД (в норме составляет от 6 до 20 мм рт. ст.). Динамика изменения ВЧД в течение острейшего периода заболевания представлена двумя пиками свыше 30 мм рт. ст.: на вторые и пятые сутки после возникновения эпизода ишемического инсульта у пациентов групп 1 и 3. На эти же сутки приходится ухудшение клинической картины, оцениваемой по шкале NIHSS, и возрастание числа летальных исходов. Между показателями ВЧД и тяжестью клинической картины ишемического инсульта по шкале NIHSS определяется высокий коэффициент корреляции (r = +0,87).
Динамика изменения ВЧД в течение острейшего периода заболевания представлена двумя пиками: на вторые и пятые сутки. На эти же сутки приходится ухудшение клинической картины, оцениваемой по шкале NIHSS, и возрастание числа летальных исходов. Путем использования математического уравнения фон Берталанфи определено, что при ВЧД свыше 30 мм рт. ст. ИИ приводит к неблагоприятному прогнозу (1 точка), а при уровне ВЧД свыше 36 мм рт. ст. (2 точка) вероятность летального исхода приближается к 100 % (рисунок).
Другие исследователи также указывают, что повышение ВЧД более 50 мм рт. ст. вызывает тяжелую гипоперфузию головного мозга и прогнозируется возможный неблагоприятный исход [10–13].
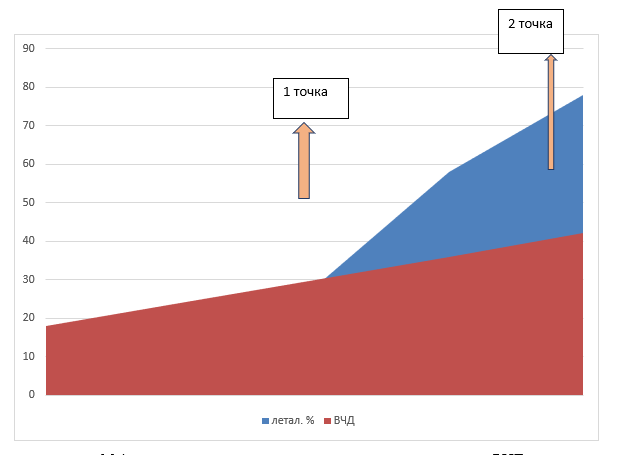
Модель зависимости вероятной летальности от уровня ВЧД
Источник: составлено авторами по результатам данного исследования
У пациентов группы 1 начиная со вторых суток лечения отмечалась устойчивая тенденция к снижению величины ВЧД по сравнению с пациентами групп 2 и 3 (рисунок). Разница в величине ВЧД была особенно выражена на пятые сутки. У пациентов группы 2 значения ВЧД не отличались от таковых, регистрируемых у пациентов группы 3.
При величине ВЧД свыше 30 мм рт. ст. прогноз ИИ становится неблагоприятным, а с уровня ВЧД более 36 мм рт. ст. уровень вероятной летальности стремится к 100 %.
Динамика изменения ВЧД у пациентов с ИИ представлена двумя пиками свыше 30 мм рт. ст. – на вторые и пятые сутки после возникновения эпизода инсульта. На эти же сутки приходится увеличение числа летальных исходов. Математически доказано, что при ВЧД свыше 30 мм рт. ст. прогноз ИИ – неблагоприятный, а при уровне ВЧД более 36 мм рт. ст. уровень вероятной летальности стремится к 100 %. Это указывает на важность коррекции ВЧД.
Результаты выявляемости МРТ-признаков отека головного мозга у пациентов трех групп приведены в табл. 2.
Таблица 2
Степень выявляемости МРТ-признаков отека головного мозга, в %
|
Группы пациентов |
1 сутки |
5 сутки |
|
Группа 1 |
9 |
89* |
|
Группа 2 |
10 |
95 |
|
Группа 3 |
10 |
96 |
Примечание. *– p < 0,05 по отношению к пациентам групп 2 и 3.
Источник: составлено авторами на основе полученных данных в ходе исследования.
Степень выявляемости отека головного мозга по данным МРТ-исследования была статистически достоверно ниже у пациентов группы 1 по сравнению с таковыми групп 2 и 3 на пятые сутки пребывания в клинике.
Показатели осмолярности плазмы крови у пациентов с ишемическим инсультом в течение первых пяти суток заболевания представлены в табл. 3.
Таблица 3
Динамика осмолярности плазмы крови у пациентов с ишемическим инсультом
|
Группы пациентов |
1 сутки |
2 сутки |
3 сутки |
4 сутки |
5 сутки |
|
Группа 1 |
308,5+1,7 |
307,8+1,9* |
310,3+1,9* |
311,2+1,9* |
312,4+1,8* |
|
Группа 2 |
309,5+1,5 |
326,7+2,5 |
324,6+2,0 |
324,0+2,1 |
329,7+2,1 |
|
Группа 3 |
309,4+1,7 |
328,4+2,3 |
326,9+2,3 |
326,2+2,5 |
330,0+2,9 |
Примечание. *– p < 0,001 по отношению к пациентам групп 2 и 3.
Источник: составлено авторами на основе полученных данных в ходе исследования.
У пациентов группы 1, получавших в комплексе интенсивной терапии L-лизин эсцинат, осмолярность плазмы крови была статистически значимо ниже, чем у больных групп 2 и 3.
В первые сутки осмолярность плазмы крови была схожей с осмолярностью здоровых лиц. Отмечено статистически достоверное нарастание осмолярности плазмы крови на вторые сутки заболевания. На третьи и четвертые сутки величина осмолярности несколько снижалась по сравнению с пятыми сутками под влиянием проводимой терапии, а на пятые сутки вновь нарастала до величин, определяемых на вторые сутки.
В исследованиях других авторов показано, что повышенная осмолярность сыворотки крови у пациентов с различной патологией, в том числе и центральной нервной системы, косвенно свидетельствующая о развитии отека головного мозга, при поступлении в ОРИТ, как правило, связана с высоким риском летального исхода [2, 10].
Таким образом, отчетливый противоотечный эффект назначения L-лизин эсцината в составе интенсивной терапии проявляется в первые сутки развития ишемического инсульта [11, 12]. Это связано с тем, что L-лизин эсцинат является препаратом, оказывающим непосредственное влияние на сосудистую проницаемость, то есть на первый, вазогенный, компонент формирования отека – набухания головного мозга [13–15].
Заключение
По итогам полученных результатов исследования можно сделать вывод, что противоотечная эффективность препарата L-лизин эсцината, исходя из данных прямых (внутричерепное давление, МРТ-исследование головного мозга) и косвенных (осмолярность плазмы крови) методов исследования проявляется в том случае, если препарат используется в составе интенсивной терапии в первые сутки после наступления эпизода ишемии головного мозга.
Путем использования математического уравнения фон Берталанфи авторы определили, что при ВЧД свыше 30 мм рт. ст. ИИ ведет к неблагоприятному прогнозу, а при уровне ВЧД более 36 мм рт. ст. вероятность летального исхода приближается к 100 %. Другие исследователи также указывают, что повышение ВЧД свыше 50 мм рт. ст. вызывает тяжелую гипоперфузию головного мозга и указывает на возможный неблагоприятный исход. Это определяет важность ранней коррекции внутричерепного давления.
Применение L-лизин эсцината в последующие сутки развития ИИ не оказывает отчетливого противоотечного эффекта, чем и объясняется отсутствие эффекта у некоторых пациентов.
Конфликт интересов
Библиографическая ссылка
Хасуева А.У., Слепушкин В.Д. ОПЫТ ПРИМЕНЕНИЯ L-ЛИЗИН ЭСЦИНАТА В ИНТЕНСИВНОЙ ТЕРАПИИ ОСТРОГО ПЕРИОДА ИШЕМИЧЕСКОГО ИНСУЛЬТА В КАЧЕСТВЕ ПРОТИВООТЕЧНОГО СРЕДСТВА // Современные проблемы науки и образования. 2025. № 5. ;URL: https://science-education.ru/ru/article/view?id=34323 (дата обращения: 27.02.2026).
DOI: https://doi.org/10.17513/spno.34323



