Введение. Современные данные о распространенности полиморфизмов генов, влияющих на эффективность терапии и частоту возникновения сердечно-сосудистых заболеваний (ССЗ), вносят значительные изменения в диагностику, тактику лечения и исходы заболеваний. Персонализированный подход всё чаще предполагает не только детальное изучение анамнеза с целью подбора наиболее эффективной терапии в каждом конкретном случае, но и разбор генетических особенностей пациента, учитывая расу или этническую принадлежность [1]. Немаловажную роль в концепции доказательной медицины имеет применение фармакогенетического тестирования как инструмента, влияющего на подходы к лечению ряда нозологий, в том числе и ССЗ, число которых ежегодно увеличивается. Только в России за 2024 год смертность от ССЗ составила 43,8%, уступая лидерство онкологическим заболеваниям [2]. Выявляя пациентов, находящихся в группе риска, ученые и практикующие врачи отмечают, что наличие в анамнезе независимых и широко распространённых диагнозов «артериальная гипертензия» и/или «хроническая болезнь почек» существенно влияют на частоту возникновения более серьёзных осложнений ССЗ, которые могут привести к уменьшению трудоспособного населения, увеличению риска его инвалидизации и смерти [3]. На практике большая часть пациентов обращается за квалифицированной медицинской помощью, когда артериальная гипертензия уже осложнена симптомами других заболеваний, влияющих на самочувствие и качество жизни [4]. Именно поэтому стартовая терапия лечения ССЗ, как правило, нацелена на применение антигипертензивных препаратов, эффективность которых зависит от генетических особенностей пациентов.
Согласно клиническим рекомендациям, наиболее часто назначаемой группой препаратов, используемых для лечения артериальной гипертензии, являются ингибиторы ангиотензин-превращающего фермента (иАПФ). Данная группа назначается как в моно- так и в комбинированной терапии вместе с β-блокаторами, блокаторами кальциевых каналов или диуретическими препаратами. Частота возникновения нежелательных побочных реакций от применения иАПФ вариабельна и варьируется от сухого кашля, обусловленного накоплением брадикинина, до ангионевротического отека [5]. Многочисленными метаанализами и систематическими обзорами было доказано, что частота встречаемости ангионевротического отека у представителей негроидной расы наиболее существенная в сравнении с другими расами и этническими группами [6]. Резистентность к препаратам данной группы может быть связана с наличием генетических полиморфизмов у представителей различных этнических групп, что обусловливает необходимость учета этих особенностей при разработке международных алгоритмов лечения [6–8].
Суммируя особенности гендерной и расовой принадлежности, ученые пришли к выводу, что полиморфизмы генов, выявляемые у пациентов с ССЗ, являются одними из ключевых факторов, определяющих предрасположенность к развитию нозологических форм и индивидуальный лекарственный ответ на терапию [9]. Инсерция, делеция, гомо- или гетерозиготность аллелей позволяют проводить персонализацию терапии, учитывая каждый клинический случай индивидуально и обеспечивая рациональный подбор эффективного и безопасного лечения [10]. Вследствие длительного характера антигипертензивной терапии, обусловленного спецификой каждого клинического случая, заболевание может приобретать статус хронической патологии, требующей постоянного медикаментозного контроля, эффективность которого способна снижаться под влиянием индивидуальных особенностей генетического кода. К генам-кандидатам, полиморфизм которых снижает эффективность от применения группы иАПФ, относят такие гены, как ACE, AGTR1, ACE2, AGT, NR3C2, MTHFR, BDKRB1, PRCP, CYP11B2, CES1, SLCO1B1. Полиморфизм генов, обладающих наибольшей клинической значимостью (ACE, CES1, AGT, ACE2), доказанно влияет на эффективность от терапии иАПФ, что необходимо учитывать при назначении данной группы препаратов [11].
В данной статье наибольшее внимание будет уделено генам АСЕ и CES1, как ключевым генетическим маркерам, наличие полиморфизма в которых определяет эффективность и безопасность лечения иАПФ.
Геномная структура АСЕ представлена 26 экзонами и 25 интронами, расположенными на длинном плече 17 хромосомы (17q23.3) [12]. АСЕ регулирует продукцию аденозин-превращающего фермента (АПФ), представленного в форме мембранного дипептидилкарбоксипептидазного энзима, экспрессируемого на поверхности эндотелиальных клеток сосудов. В организме человека АПФ выполняет функцию катализатора неактивного ангиотензина I в сильный вазоконстриктор ангиотензин II, который повышает артериальное давление и участвует в поддержании водно-солевого баланса. Транскрипция гена АСЕ представлена двумя основными изоформами фермента, такими как соматическая (эндотелиальная) изоформа, тестикулярная изоформа. Соматическая изоформа представлена полноразмерным белком (~1306 аминокислот), кодируемым всеми экзонами за исключением 13, а также содержащим два каталитических домена (N- и C-). Тестикулярная изоформа представлена укороченным белком (~701 аминокислота), который экспрессируется исключительно в клетках семенников и содержит один каталитический домен (C-) [13]. В настоящий момент одной из наиболее изученных генетических вариаций является полиморфизм (I/D), который обусловлен вставкой (I) либо делецией (D) последовательности Alu в 16 интроне [14]. Данный полиморфизм возникает в результате вставки или делеции фрагмента Alu длиной 287 пар оснований в интроне, что приводит к образованию трех генотипов: II, ID, DD [12]. Стоит отметить, что несмотря на то, что полиморфизм в гене АСЕ, локализируясь в интроне, не затрагивает изменения аминокислотной последовательности белка, он влияет на активность промотора АСЕ1, предположительно действуя как цис-регуляторный элемент. Вставка фрагмента Alu снижает эффективность транскрипции, выполняя роль транс-репрессора для РНК полимеразы II [15]. Данная гипотеза объясняет взаимосвязь уровня экспрессии и секреции АПФ у носителей разных генотипов.
Рассматривая данный полиморфизм с позиции влияния на частоту возникновения ССЗ, ученые выявили, что аллель D (особенно генотип DD) является фактором, потенциально повышающим риск и тяжесть ряда патологий сердца и сосудов. В настоящий момент в литературе описаны ассоциации наличия полиморфизма гена АСЕ (I/D) и риска развития артериальной гипертензии, ишемической болезни сердца и инфаркта миокарда, инсульта, сердечной недостаточности и ремоделирования сердца [16]. Кроме того, ряд исследований указывает на наличие статистически значимой связи между наличием в генотипе аллеля D и риском возникновения рака предстательной железы [17], псориаза и ревматоидного артрита [18]. Исследования частот встречаемости указанных полиморфизмов также отмечают высокий риск корреляции полиморфного аллеля D и частоты возникновения у пациентов болезни Альцгеймера [19] и сахарного диабета 2 типа [20].
Немаловажную роль в изучении влияния полиморфизма гена АСЕ имеют однонуклеотидные полиморфизмы, наличие которых влияет на эффективность лекарственной терапии. Одной из наиболее клинически значимых ассоциаций между полиморфизмом и вариабельностью терапевтической эффективности является взаимосвязь ACE (I/D, rs1799752) с ответом на терапию иАПФ. Научно доказано, что наличие аллеля D (rs1799752) снижает эффективность от применения иАПФ, а в гомозиготном варианте (DD) требует изменения тактики лечения.
Большое внимание при выборе антигипертензивных средств уделяется иАПФ, поскольку данная группа нередко используется в качестве стартовой терапии для лечения артериальной гипертензии, сердечной недостаточности и хронической болезни почек [5]. Наиболее актуальными препаратами выбора становятся эналаприл и периндоприл, имеющие форму пролекарства. Данная форма предполагает необходимость предварительной биотрансформации препаратов in vivo в формы активных метаболитов (эналаприлат и периндоприлат). Фермент карбоксилэстераза (CES1) катализирует гидролиз эфирной связи в молекулах эналаприла и периндоприла, в результате чего образуются активные формы эналаприлата и периндоприлата, соответственно [21]. Процесс биотрансформации на примере эналаприла представлен на рисунке.
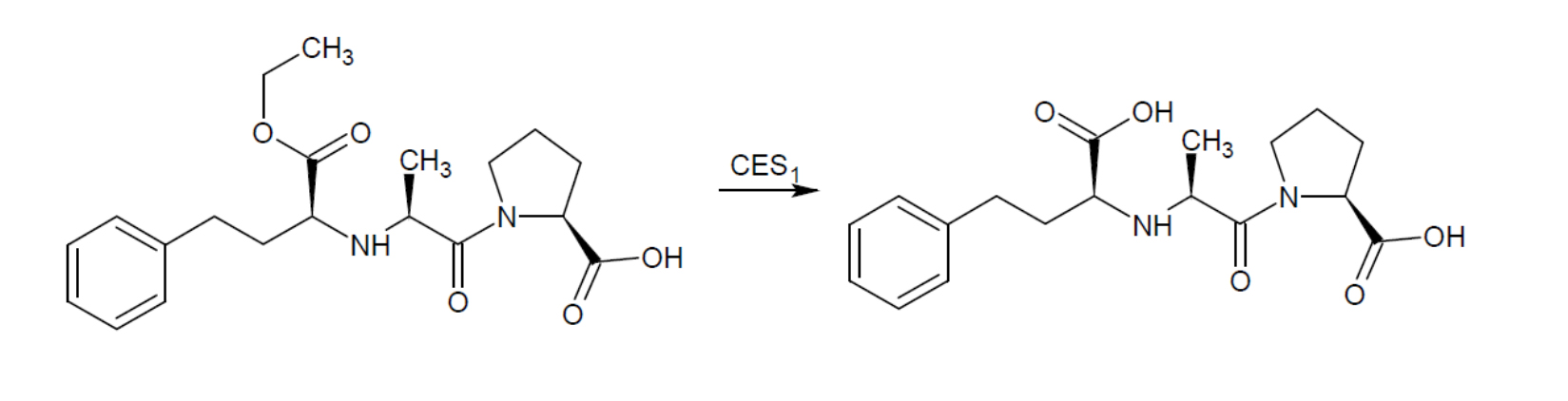
Модификация пролекарственной формы эналаприла до активной формы эналаприлата
Источник: составлено авторами с помощью программы ChemSketch.
Активность фермента CES1 может отличаться у разных пациентов в зависимости от наличия/отсутствия генетических полиморфизмов, в частности 1168-33C> A (rs2244613) [22]. Известно, что наличие аллели С влияет на активацию пролекарственных форм иАПФ и, как следствие, на средние минимальные концентрации препаратов данной группы [23]. Впервые влияние CES1 (rs2244613) генотипа на фармакокинетику эналаприла у пациентов с артериальной гипертензией было изучено российскими учеными, которые выявили наиболее клинически значимые полиморфизмы (CES1: rs2244613 (1168-33C> A), rs71647871 (c.428G> A), CES1A1c: rs12149368, rs111604615 и rs201577108), а также определили, что при эмпирическом подборе дозировки эналаприла концентрация активного метаболита может не достигать терапевтического диапазона или, наоборот, быть выше [24]. Выявлено, что у пациентов с гомозиготным (СС) генотипом значительно замедлена биотрансформация иАПФ в активные формы, что свидетельствует об уменьшении активных метаболитов в крови и необходимости увеличения дозировки препарата или назначения другой группы. Пациенты с генотипом АС имеют сниженную активность фермента CES1 в печени, что также требует изменения дозировки, в отличие от генотипа АА.
В настоящее время полиморфизмы генов АСЕ и CES1 не являются широко изученными, в то время как изучение распространённости их генетических полиморфизмов среди пациентов с ССЗ может позволить оценить возможные фармакогенетические особенности терапии. Полученные данные могут поспособствовать разработке персонализированных подходов к лечению ССЗ, снижению риска побочных эффектов и повышению эффективности терапии, особенно в условиях полиэтнической популяции.
Цель исследования. Определить частоту встречаемости полиморфизма генов АСЕ (I/D, rs1799752) и CES1 (1168-33C> A, rs2244613) среди пациентов с ССЗ в Астраханской области, а также оценить гендерную специфичность в данной когорте пациентов.
Материалы и методы исследования. Представленное исследование относится к типу молекулярно-генетических и направлено на определение частоты встречаемости полиморфизмов АСЕ (I/D, rs1799752) и CES1 (1168-33C> A, rs2244613) среди пациентов с диагностированной артериальной гипертензией. Пациенты, принявшие участие в исследовании, отбирались рандомно на основе соответствия критериям включения данных, полученных из амбулаторных карт Федерального центра сердечно-сосудистой хирургии (г. Астрахань). К критериям включения относились такие параметры, как диагностированная артериальная гипертензия вне зависимости от тяжести заболевания, использование в качестве антигипертензивной терапии иАПФ (периндоприл, каптоприл, эналаприл, лизиноприл), возраст старше 18 лет. Все участники исследования дали добровольное согласие на участие, а также были полностью проинформированы об особенностях его проведения и дальнейшего анализа полученных данных. Исследование одобрено локальным этическим комитетом ФГБОУ ВО «Астраханский ГМУ» Минздрава России. Протокол № 11 от 25.12.2024. Согласно международной базе данных «PharmGKB.org» в настоящее время полиморфизм ACE (I/D) представлен rs1799752, при этом ранее данный полиморфизм имел другой идентификационный номер (rs4646994, rs13447447, rs4340). Поиск научной литературы велся по запросу «АСЕ (I/D, rs1799752)» включая публикации с rs4646994, rs13447447, rs4340.
Для генотипирования использовали венозную кровь (3 мл), собранную в вакуумные пробирки с раствором ЭДТА с последующим выделением ДНК из цельной крови. Отобранные образцы хранились в соответствии с нормативными требованиями при температуре -20℃. Для выделения ДНК использовался набор реагентов «М-Сорб-Кровь» (на магнитных частицах) (HG-502-100). Для определения наличия полиморфизмов в генах АСЕ и CES1 использовались наборы реагентов «Alu I/D гена АСЕ (rs4646994)» (NP-519-100) и «ГенТест CES1 1168-33C> A (rs2244613)».
Результаты, полученные в исследовании, анализировались согласно современным статистическим принципам и критериям оценки данных. Частоты встречаемости аллелей и генотипов оценивались согласно уравнению Харди - Вайнберга, применяемому для выявления отклонений, свидетельствующих о возможном селективном давлении, дрейфе генов и миграции в исследуемой когорте пациентов. Для анализа выявления зависимости и статистической значимости распределения сцепленных с полом полиморфизмов использовался критерий хи-квадрата (χ²) Пирсона (p <0,05). В качестве количественной оценки ассоциации наличия полиморфизма генов и пола пациента рассчитан критерий отношения шансов (ОШ, 95%ДИ). В качестве дополнительного параметра в исследовании рассчитан критерий оценки силы связи исследуемых категориальных данных (V Крамера). В исследовании проведена сравнительная оценка частоты встречаемости полиморфизмов генов ACE и CES1 в популяции Астраханской области в сравнении с аналогичными показателями для других субъектов Российской Федерации и ряда зарубежных стран.
Результаты исследования и их обсуждение. В исследовании приняли участие 90 пациентов с выраженной артериальной гипертензией, использующих в качестве антигипертензивной терапии группу иАПФ. В исследовании приняли участие 30 (33%) женщин и 60 (67%) мужчин в возрасте от 40 до 88 лет (65,8±10,1).
Проведённый молекулярно-генетический анализ позволил установить характерные особенности распространённости полиморфизмов генов ACE (I/D, rs1799752) и CES1 (1168-33C> A, rs2244613) среди пациентов с артериальной гипертензией в Астраханской области. Оценка частоты встречаемости аллелей и генотипов показала их соответствие закону Харди – Вайнберга (p> 0,05), что свидетельствует об отсутствии значимых популяционных сдвигов и подтверждает достоверность полученных данных. В таблице 1 представлены результаты исследования, отражающие частоты встречаемости полиморфизмов в исследуемой когорте пациентов.
Таблица 1
Оценка частоты встречаемости полиморфизмов генов ACE и CES1 среди пациентов Астраханской области
|
Локус |
Генотипированные пациенты (n=90) |
Значение p согласно равновесию Харди -Вайнберга |
|
ACE (I/D rs1799752) |
P=0,3252* |
|
|
II, n (%) |
35 (38,9) |
|
|
ID, n (%) |
37 (41,1) |
|
|
DD, n (%) |
18 (20) |
|
|
ACE (все аллели) |
||
|
I, n (%) |
107 (59,4) |
|
|
D, n (%) |
73 (40,6) |
|
|
CES1 (rs2244613) |
P=0,7545* |
|
|
AA, n (%) |
44 (48,8) |
|
|
AC, n (%) |
39 (43,3) |
|
|
CC, n (%) |
7 (7,77) |
|
|
CES1 (все аллели) |
||
|
A, n (%) |
127 (70,6) |
|
|
C, n (%) |
53 (29,4) |
|
Примечание: * - значения показателя соответствует равновесию Харди - Вайнберга (р >0,05).
Источник: составлено авторами на основе полученных данных в ходе исследования.
Анализ полиморфизма I/D гена ACE выявил, что аллель D, ассоциируемый со сниженной эффективностью иАПФ, встречается у 40,6% пациентов. Гомозиготный по данному аллелю генотип (DD) был определён у 20% обследованных, что указывает на необходимость адресного применения иАПФ у данной группы пациентов ввиду потенциального снижения фармакологического ответа на терапию. В общей сложности у 61,1% пациентов были обнаружены полиморфизмы ID и DD (95% ДИ: 0,51–0,71), что подтверждает распространённость данного варианта, а также свидетельствует о возможности возникновения сопутствующих нозологий сердечно-сосудистой системы, для которых аллель D является предиктором.
По результатам исследования полиморфизма rs2244613 гена CES1 установлено, что аллель C, связанный с замедленной биотрансформацией пролекарственных форм иАПФ (эналаприл, периндоприл), встречается у 29,4% пациентов. Генотипы AC и CC, определяющие снижение активности CES1 и, соответственно, метаболизма пролекарств, выявлены у 51,07% пациентов (95% ДИ: 0,39–0,61). Это подтверждает высокий риск недостаточной клинической эффективности указанных препаратов в данной когорте.
Оценка комбинированных случаев полиморфизмов показала, что у 32,2% пациентов одновременно присутствуют оба генетических варианта риска (аллели D и C), что может значительно снижать эффективность стандартной антигипертензивной терапии иАПФ. Такие пациенты требуют индивидуализации фармакотерапии и возможного подбора альтернативных препаратов. Результаты оценки частоты встречаемости генотипов (II, ID, DD/ AA, AC, CC) являются важными параметрами для понимания генетического разнообразия популяций и прогнозирования наследственных заболеваний (табл. 2).
Таблица 2
Оценка частоты встречаемости комбинаций полиморфизмов генов АСЕ и CES1 среди пациентов Астраханской области
|
Варианты комбинаций генотипов |
Значения |
Варианты комбинаций генотипов |
Значения |
|
ACE (I/D rs1799752) |
CES1 (rs2244613) |
||
|
1 комбинация |
|||
|
DD+ID |
55 (61,1%) |
CC+AC |
46 (51,1%) |
|
II |
35 (38,9%) |
AA |
44 (48,9%) |
|
2 комбинация |
|||
|
DD |
18 (20,0%) |
CC |
7 (7,8%) |
|
II+ID |
72 (80,0%) |
AA+AC |
83 (92,2%) |
|
3 комбинация |
|||
|
ID |
37 (41,1%) |
AC |
39 (43,3%) |
|
II+DD |
53 (58,9%) |
AA+CC |
51 (56,7%) |
Источник: составлено авторами на основе полученных данных в ходе исследования.
Комплексный анализ частот полиморфизмов rs1799752 и rs2244613 в генах ACE и CES1 позволил получить важные статистические данные о распространенности полиморфных аллелей, частота возникновения которых существенно влияет на генетическое разнообразие популяций и необходимость персонализированного подхода к лечению пациентов Астраханской области. В связи с тем, что основным критерием включения при отборе пациентов для участия в исследовании послужило назначение группы иАПФ в качестве основного антигипертензивного препарата, можно сделать вывод о неэффективности данной группы для 29 (32,2%) пациентов, имеющих одновременно оба полиморфизма.
Немаловажную роль в оценке частоты встречаемости полиморфизмов генов играет распределение полиморфных аллелей по половому признаку. В исследовании в качестве группирующего признака была выбрана номинальная переменная «Пол» (женский/мужской), а в качестве изучаемого признака 2 категории (наличие/отсутствие полиморфизма). Полученные результаты по полиморфизму АСЕ отражены в таблице 3.
Таблица 3
Сравнение частоты встречаемости полиморфизма гена АСЕ в зависимости от пола пациента
|
Пол |
Полиморфизм гена АСЕ |
p |
ОШ, 95%ДИ |
|||
|
Наличие признака (n=55) |
Отсутствие признака (n=35) |
|||||
|
Абс. |
% |
Абс. |
% |
|||
|
Женщины |
19 |
63,3 |
11 |
36,7 |
0,760 |
0,868, 0,351-2,146 |
|
Мужчины |
36 |
60 |
24 |
40 |
||
Примечание: * - различия показателей статистически значимы (р <0,05).
Источник: составлено авторами на основе полученных данных в ходе исследования.
При сравнении частоты встречаемости полиморфизма гена АСЕ в зависимости от пола пациента не было выявлено статистически значимой корреляции (р> 0,05). Между сопоставляемыми признаками отмечалась несущественная связь (V=0,032). Оценка шансов не дала статистически значимых результатов (95% ДИ (0,351<1; 2,146>1), что может указывать на отсутствие значимых различий между сравниваемыми группами или на недостаточную выборку пациентов. Аналогично сравнивались частоты встречаемости полиморфизма CES1 относительно пола генотипированных пациентов (табл. 4).
Таблица 4
Сравнение частоты встречаемости полиморфизма гена CES1 в зависимости от пола пациента
|
Пол |
Полиморфизм гена CES1 |
p |
ОШ, 95%ДИ |
|||
|
Наличие признака (n=45) |
Отсутствие признака (n=45) |
|||||
|
Абс. |
% |
Абс. |
% |
|||
|
Женщины |
18 |
60,0 |
12 |
40,0 |
0,180 |
0,545, 0,224-1,328 |
|
Мужчины |
27 |
45,0 |
33 |
55,0 |
||
Примечание: * - различия показателей статистически значимы (р <0,05).
Источник: составлено авторами на основе полученных данных в ходе исследования.
Результаты сравнения позволили выявить, что сравнение частот встречаемости полиморфизма гена CES1 в зависимости от пола пациента не обладает статистической значимостью (р> 0,05). Между сопоставляемыми признаками отмечалась слабая взаимосвязь (V=0,141). Оценка шансов не позволила достоверно оценить гендерную взаимосвязь между наличием полиморфизма и половым признаком (95% ДИ (0,224<1; 1,328>1). Полученный результат может быть связан с недостаточной выборкой пациентов либо с полным отсутствием представленного взаимодействия между изучаемыми параметрами в данной этнической группе.
Проведённый гендерный анализ не выявил достоверных различий в частоте встречаемости полиморфизмов ACE (I/D, rs1799752) и CES1 (1168-33C> A, rs2244613) между мужчинами и женщинами (р> 0,05). Вероятные причины отсутствия статистически значимых различий включают как независимый от пола характер наследования данных полиморфизмов, так и ограниченность выборки.
Сравнивая полученные значения с мировыми данными, можно сделать вывод о том, что частота встречаемости полиморфизмов АСЕ и CES1 вариабельна для разных рас и этнических групп. Сравнительный анализ с результатами исследований других субъектов Российской Федерации показал, что частота аллеля D гена ACE (40,6%) в Астраханской области сопоставима с показателями для Московской области (48,3%) [25] и Республики Мордовия (46,3%) [26], что подтверждает её типичность для европейской части России. Исследования, направленные на выявление частот встречаемости полиморфизма гена АСЕ среди пациентов из Российской Федерации, не показали существенных различий с Астраханским регионом (табл. 5) [27].
Таблица 5
Оценка частоты встречаемости полиморфизма I/D гена АСЕ в разных субъектах Российской Федерации
|
Вариант SNP* ACE |
Субъекты Российской Федерации |
||||
|
Астраханская область (n=90) |
Московская область (n=179) |
Республика Мордовия |
Кабардино-Балкарская Республика (n=96) |
||
|
Мордва (n=207) |
Русские (n=88) |
||||
|
II, % |
38,9 |
28,5 |
30,88 |
40,54 |
26,0 |
|
ID, % |
41,1 |
46,4 |
45,59 |
37,84 |
48,9 |
|
DD, % |
20 |
25,1 |
23,53 |
21,62 |
25,1 |
Примечание: *SNP – однонуклеотидный полиморфизм гена.
Источник: составлено авторами на основе источников [25-27].
При оценке частоты встречаемости полиморфизма 1168-33C> A в гене CES1 была определена высокая вариабельность распространения генотипов. Полученные данные отражены в таблице 6 [1].
Таблица 6
Оценка частоты встречаемости полиморфизма 1168-33C> A гена CES1 для различных субъектов и этнических групп Российской Федерации
|
Вариант SNP* CES1 |
Субъекты Российской Федерации |
|||||
|
Астраханская область (n=90) |
Московская область (n=286) |
Поволжье (n=184) |
Сибирь и Дальний Восток (n=184) |
|||
|
Марийцы (n=206) |
Чуваши (n=238) |
Буряты (n=114) |
Нанайцы (n=70) |
|||
|
AA, % |
48,8 |
61,6 |
36,4 |
40,8 |
14,9 |
4,3 |
|
AC, % |
43,3 |
31,8 |
46,6 |
43,7 |
45,6 |
57,1 |
|
CC, % |
7,77 |
6,6 |
17,0 |
15,5 |
39,5 |
38,6 |
Примечание: *SNP – однонуклеотидный полиморфизм гена.
Источник: составлено авторами на основе источника [1].
Анализ полиморфизма CES1 демонстрирует выраженную этническую вариабельность: частота генотипа AA у марийцев и чувашей достигает 36–61%, тогда как у нанайцев и бурятов отмечено значительное преобладание полиморфных вариантов AC и CC.
Сравнивая данные показатели с мировыми данными частот встречаемости полиморфизма АСЕ (I/D), можно проследить значительную вариабельность результатов в зависимости от этнической группы пациентов (табл. 7). Необходимо отметить, что оценка частоты встречаемости полиморфизма гена CES1 (1168-33C> A rs2244613) в зарубежных популяциях недостаточно изучена для предоставления точных данных. Для наиболее детальной оценки влияния представленных полиморфизмов необходимо расширять географию генотипирования [28].
Таблица 7
Мировая оценка частот встречаемости полиморфизма I/D гена АСЕ.
Зарубежные страны
|
Вариант полиморфизма АСЕ |
|
||||
|
Египет (n=460) |
Италия (n=68) |
Испания (n=79) |
Индия (n=269) |
Чешская Республика (n=408) |
|
|
II |
87 (19,0%) |
5 (7,3%) |
22 (28,0%) |
116 (43,2%) |
107 (26,2%) |
|
ID |
120 (26,0%) |
25 (36,8%) |
41 (52,0%) |
106 (39,4%) |
210 (51,5%) |
|
DD |
253 (55,0%) |
38 (55,9%) |
16 (20,0%) |
47 (17,4%) |
91 (22,3%) |
Примечание: составлено авторами на основе источников [29–31].
Сравнение с зарубежными популяциями выявило ещё более значительную вариабельность частоты полиморфизма ACE, что подчёркивает необходимость этнически специфической интерпретации результатов фармакогенетического тестирования.
Заключение. Фармакогенетические тестирования являются одним из самых современных инструментов персонализированной медицины. Наличие высокой частоты встречаемости полиморфизмов генов АСЕ и CES1 указывает на необходимость подбора индивидуальной терапии для достижения высокой эффективности от лечения, что немаловажно для ССЗ, требующих длительного приема лекарственных препаратов. К таким нозологиям относятся ССЗ, которые ежегодно становятся причиной высокой смертности и инвалидизации населения. Именно поэтому выявление факторов, влияющих на эффективность лечения ССЗ или риск возникновения патологий, определяет их значительную роль в медицинской практике.
Полученные данные демонстрируют высокую частоту встречаемости генетических полиморфизмов, ассоциированных со снижением эффективности иАПФ, что подтверждает целесообразность дальнейшего изучения особенностей представленных генотипов. Индивидуализация терапии на основе генотипирования позволит повысить эффективность и безопасность лечения данной категории пациентов, снизить риск развития резистентной гипертензии и связанных с ней сердечно-сосудистых осложнений.
Конфликт интересов
Библиографическая ссылка
Комарова О.В., Кантемирова Б.И., Романова А.Н., Тимофеева Н.В. ОЦЕНКА ЧАСТОТЫ ВСТРЕЧАЕМОСТИ ПОЛИМОРФИЗМОВ ГЕНОВ АСЕ И CES1 СРЕДИ ПАЦИЕНТОВ С СЕРДЕЧНО-СОСУДИСТЫМИ ЗАБОЛЕВАНИЯМИ В АСТРАХАНСКОЙ ОБЛАСТИ // Современные проблемы науки и образования. 2025. № 5. ;URL: https://science-education.ru/ru/article/view?id=34319 (дата обращения: 27.02.2026).
DOI: https://doi.org/10.17513/spno.34319



