Введение
Оценка резидуального (остаточного) сердечно-сосудистого риска у пациентов с ишемической болезнью сердца (ИБС) многогранна, включает различные патогенетические компоненты, неразрывно связанные друг с другом: липидный, воспалительный, тромботический [1-3]. Именно при недостаточном контроле параметров липид-транспортной системы, нарастающей эндотелиальной дисфункции ввиду неконтролируемого уровня артериального давления, повреждающего действия провоспалительных агентов возможно повторное наступление нежелательных кардиоваскулярных событий, которые снижают качество жизни больных и увеличивают летальность [4-6]. Новейшие подходы к стратификации резидуального риска включают различные прогностические маркеры, которые косвенно могут дать представление об остаточном риске у пациента; однако их определение «здесь и сейчас» зачастую невозможно в силу различных причин [7-9]. В последнее время одним из перспективных направлений при изучении биохимических параметров считают конечные продукты гликирования (КПГ), являющиеся продуктами биохимических реакций гликозилирования липидов, белков, нуклеиновых кислот [10; 11]. Интенсивное образование КПГ в том числе свидетельствует об интенсивных процессах гликирования волокон эластина и коллагена стенки сосуда, что ведет к прогрессированию эндотелиальной дисфункции, а значит, приводит к интенсифицированию атеросклероза [12; 13]. Опыт использования портативных ридеров КПГ, работающих с использованием метода аутофлуоресценции для оценки резидуального риска, до сих пор ограничен.
Цель исследования – оценить возможность стратификации резидуального риска у пациентов с ИБС, находящихся на каскадной гиполипидемической терапии, с помощью определения индекса аутофлюоресценции КПГ портативным ридером.
Материал и методы исследования. Проведено одноцентровое проспективное исследование на базе ОБУЗ «Курская городская больница № 6» с участием 120 мужчин с установленным диагнозом ИБС, которые подписали добровольное информированное согласие на участие (протокол регионального этического комитета № 3 от 15 марта 2023 г.). Критерии включения пациентов в исследование: возрастной диапазон 55-75 лет, мужской пол, дислипидемия в сочетании с различными формами ИБС и коморбидной патологией. Критерии исключения: женский пол, тяжелая сопутствующая патология в виде сахарного диабета с множественными осложнениями, выраженного снижения функции почек, морбидного ожирения, сердечной недостаточности с низкой фракцией выброса, выраженной гипертриглицеридемии более 5 ммоль/л. Всем участникам исследования была назначена коррекция дислипидемии: первый этап – розувастатин 20 мг однократно per os, далее по прошествии срока в 1,5 месяца в случае отсутствия достижения целевого уровня липопротеинов низкой плотности (ЛПНП) ниже 1,4 ммоль/л пациентов переводили на сочетание розувастатина 20 мг и эзетимиба 10 мг. При отсутствии эффективности снижения ЛПНП по прошествии 1,5 месяцев пациентов переводили на тройную комбинацию с включением моноклональных антител-ингибиторов к PCSK9 (иPCSK9) – алирокумаба – в дозе 150 мг 1 раз в 14 дней подкожно. Всем пациентам была назначена адекватная терапия основного и сопутствующих заболеваний, в том числе антиангинальная, антигипертензивная, гипогликемическая. Всего было запланировано 4 визита, медиана наблюдения составила 18 недель.
Были использованы общеклинические методы исследования: определение общего анализа крови, биохимического анализа крови – липидограммы, общего белка, билирубина и его фракций, трансаминаз, креатинина, мочевины, электролитов крови – на старте исследования, далее – по визитам с шагом в 6 недель. Кроме того, пациентам однократно определяли уровень липопротеина (а) (Лп(а)). Инструментальные методы включали: регистрацию электрокардиограммы (ЭКГ), эхокардиографии (ЭхоКГ); а также неинвазивное определение КПГ с помощью портативного ридера – AGE Reader – методом аутофлюоресценции КПГ на чистой коже внутренней поверхности предплечья трехкратно с вычислением среднего значения индекса аутофлюоресценции (иАУФ), которое проводилось на каждом визите. Исследование было запланировано и проведено в соответствии с принципами Хельсинкской декларации Всемирной медицинской ассоциации от 1964 г. Статистическая обработка данных была осуществлена с помощью отечественного программного обеспечения StatTech v. 4.8.8. Показатели описывали с помощью критерия Шапиро-Уилка, критерия Краскела-Уоллиса; средние значения – общепринятыми методами в зависимости от нормальности распределения. Использовали метод логистической регрессии, а также метод анализа ROC-кривых. Данные считали статистически значимыми при p<0,05.
Результаты исследования и их обсуждение. В ходе анализа собранных данных анамнеза и общего осмотра выявлены следующие особенности: средний возраст составил 66,5 лет (95% ДИ 64,00-70,75), индекс массы тела 29,38 ± 3,99 м2 (95% ДИ 27,89–30,87), окружность талии 97,73 ± 12,68 см (95% ДИ 93,00–102,47). По сопутствующей патологии: пациенты имели неконтролируемую артериальную гипертензию (АГ) на старте исследования в 45% (n=54) случаев, СД 2 типа в 43% (n=52), метаболический синдром в 17,5% (n=21). Мультифокальный атеросклероз диагностирован у 12,5% пациентов (n=15), ожирение 1 степени у 40% пациентов (n=48), 2 степени – у 22,5% пациентов (n=27). Курили 46% (n=55) пациентов, нерационально питались 77% (n=92), вели малоподвижный образ жизни 70% (n=83), имели отягощенный анамнез по сердечно-сосудистой патологии 48% (n=57). Данные основных биохимических показателей представлены в таблице.
Основные биохимические показатели пациентов на старте исследования
|
Показатели |
M ± SD / Me |
95% ДИ / Q₁ – Q₃ |
n |
min |
max |
|
ОХ, M ± SD, ммоль/л |
5,00 ± 1,34 |
4,50 – 5,50 |
120 |
3,00 |
7,20 |
|
ЛПНП, M ± SD, ммоль/л |
3,12 ± 1,18 |
2,68 – 3,56 |
120 |
1,36 |
5,30 |
|
Лп(а), Me, г/л |
0,56 |
0,34 – 0,77 |
120 |
0,20 |
1,01 |
|
ТГ, M ± SD, ммоль/л |
1,61 ± 0,77 |
1,32 – 1,90 |
120 |
0,40 |
3,60 |
|
ЛПВП, Me, ммоль/л |
1,10 |
1,00 – 1,20 |
120 |
0,70 |
2,11 |
|
Глюкоза, M ± SD, ммоль/л |
6,33 ± 1,49 |
5,77 – 6,88 |
120 |
4,00 |
10,10 |
|
КПГ, Me |
2,80 |
2,20 – 4,07 |
120 |
1,80 |
5,20 |
Примечание: ОХ – общий холестерин, ТГ – триглицериды, ЛПВП – липопротеины высокой плотности.
В соответствии с таблицей 1 ни один из включенных в исследование пациентов не достиг требуемого уровня ЛПНП<1,4 ммоль/л, что считают обязательным для больных ИБС очень высокого кардиоваскулярного риска в соответствии с современными клиническими рекомендациями [14]. Средний уровень глюкозы для пациентов составлял 6,33 ± 1,49 ммоль/л (95% ДИ 5,77–6,88), что является тенденцией к повышению. Показатель Лп(а) в среднем составлял 0,56 (95% ДИ 0,34–0,77); при значении Лп(а) более 0,5 г/л можно сделать вывод о наличии наследственной предрасположенности к более агрессивному течению атеросклеротических процессов, а также, возможно, низкой эффективности традиционных схем гиполипидемической терапии.
В ходе каскадной коррекции ингибирования холестерина динамика снижения ЛПНП стала основой для разделения пациентов на когорты. Участники исследования, достигшие таргетного уровня ЛПНП на монотерапии розувастатином за 6 недель (27,5%), составили когорту 1 (n=33), на фиксированной комбинации (60%) – когорту 2 (n=72), на тройной терапии (12,5%) – когорту 3 (n=15). Примечательно, что тройная терапия показала значительное снижение первоначального уровня ЛПНП более чем на 85%, что напрямую согласуется с результатами прорывного исследования ODYSSEY OUTCOMES [15]. Темпы снижения уровня ЛПНП до таргетных значений представлены на рис. 1.
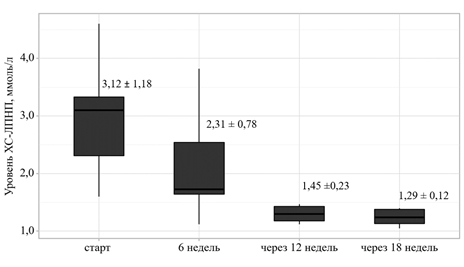
Рис. 1. Динамика достижения целевого уровня ЛПНП участниками исследования
При определении иАУФ методом аутофлюоресценции с помощью портативного ридера в соответствии с уникальными особенностями пациента – возрастом, толщиной кожной складки, интенсивностью реакций гликирования, количеством КПГ, воспалительным статусом – прибор автоматически относит пациента в различные цветовые диапазоны: красный – очень высокий риск (иАУФ>3), оранжевый – высокий резидуальный риск (иАУФ 2,4-3), желтый – умеренное значение (иАУФ 1,7-2,4), зеленый – низкий риск (иАУФ<1,7). При расчете показателей были получены следующие изменения средних значений иАУФ в ходе проведения четырех визитов у исследуемых пациентов с ИБС: на 1-м визите значение иАУФ составило 3,1 (95% ДИ 2,20–4,07), на втором – 3,0 (95% ДИ 2,12–4,00), на 3-м – 2,6 (95% ДИ 2,02–3,88), на 4-м – 2,5 (95% ДИ 2,00–3,71), что имело статистически значимые различия по критерию Фридмана при p<0,05 (рис. 2).
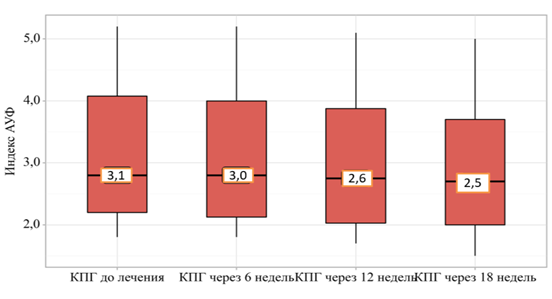
Рис. 2. Изменение иАУФ у пациентов за 4 визита
На диаграмме, представленной на рис. 2, можно заметить снижение средних значений иАУФ при комплексном подходе к лечению пациентов на основе адекватной, в том числе многокомпонентной гиполипидемической, терапии заболеваний.
Для определения взаимосвязей высоких градаций резидуального риска и значения ЛПНП через 18 недель, а значит, и достижения таргетного значения, была выработана теория о прогностической модели на основе статистического метода, а именно – бинарной логистической регрессии. Это охарактеризовало возможность предикции очень высокого резидуального риска на основе определения иАУФ в ходе коррекции нарушения липидного обмена. Число наблюдений составило 120. Было составлено уравнение:
P = 1 / (1 + e-z) × 100%, а именно z = -10,728 + 8,307XЛПНП через 18 недель,
где P – оценка вероятности наличия очень высокого резидуального риска, z – значение логистической функции, ХЛПНП через 18 недель – ЛПНП через 18 недель (ммоль/л). При увеличении ЛПНП через 18 недель на 1 ммоль/л на фоне высокого иАУФ (красный диапазон) при неэффективности ингибирования холестерина или недостаточном удержании целевого уровня шансы возрастания уровня резидуального риска до очень высокого увеличивались в 53,354 раза при p<0,05.
В ходе анализа дискриминационных возможностей искомой регрессионной модели с применением ROC-анализа выведена следующая закономерность. Оценка вероятности P является статистически значимым предиктором очень высокого резидуального риска (AUC = 0,736; 95% ДИ: 0,555 – 0,917, p = 0,028). Чувствительность и специфичность полученной прогностической модели составили 66,7% и 86,7% соответственно (рис. 3).
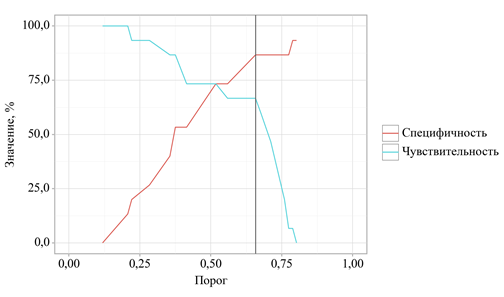
Рис. 3. Анализ чувствительности и специфичности модели в зависимости от пороговых значений оценок вероятности очень высокого резидуального риска
Таким образом, каскадное ингибирование холестерина при использовании двух- и трехкомпонентной схемы с наиболее эффективным способом достижения целевого уровня ЛПНП и дальнейшего его удержания является одним из основополагающих аспектов снижения уровня резидуального риска. Определение иАУФ в динамике, демонстрация возможностей некоторого его снижения на фоне адекватной терапии основных заболеваний и многокомпонентной гиполипидемической терапии косвенно демонстрирует возможность модификации величины остаточного риска.
Заключение. Липидный компонент остаточного риска является одним из его важнейших патогенетических компонентов, который, наряду с тромботическим и воспалительным, создает триединство патогенеза резидуального риска. Коррекция дислипидемии на основе каскадного ингибирования холестерина с использованием многокомпонентных схем позволяет достичь и удержать целевое значение параметра ЛПНП, что является критически важным. В противном случае, в соответствии с результатами проведенного исследования, при увеличении уровня ЛПНП на 1 ммоль/л через 18 недель и высоком уровне иАУФ предикция очень высокого резидуального риска возможна с чувствительностью и специфичностью 66,7% и 86,7% соответственно.
Конфликт интересов
Финансирование
Библиографическая ссылка
Объедкова Н.Ю., Маль Г.С., Цуканова Ю.А. НОВЫЕ ВОЗМОЖНОСТИ ОПРЕДЕЛЕНИЯ ОСТАТОЧНОГО РИСКА У ПАЦИЕНТОВ С ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА ПРИ КАСКАДНОМ ИНГИБИРОВАНИИ ХОЛЕСТЕРИНА // Современные проблемы науки и образования. 2025. № 5. ;URL: https://science-education.ru/ru/article/view?id=34303 (дата обращения: 27.02.2026).
DOI: https://doi.org/10.17513/spno.34303



