Введение
Использование наноматериалов в медицине открывает множество возможностей для лечения нейродегенеративных заболеваний, одним из которых является болезнь Альцгеймера (БА) [1]. Металлические наночастицы (МНЧ) являются многообещающим инструментом из-за их уникальных свойств. Такие наночастицы (НЧ) можно использовать как платформы для диагностики и лечения нейропатологий, которые доставляют терапевтические агенты непосредственно в мозг, повышая эффективность и точность лечения и уменьшая побочные эффекты в здоровых тканях [2]. Платформы доставки на основе НЧ могут состоять из широкого спектра веществ: липидов, синтетических полимеров, пептидов, олигонуклеотидов, а также золота, кремния и железа [3]. НЧ можно функционализировать определенными молекулами для избирательного нацеливания на такие белки, как тау-белок (p-tau) и β-амилоидный пептид (Аβ), которые играют основную роль в патогенезе БА [4]. Однако, несмотря на значительный потенциал МНЧ, необходимо решить проблемы их использования в медицине, связанные с безопасностью и биосовместимостью этих наноматериалов в контексте центральной нервной системы [5].
Цель исследования – изучить современные проблемы и перспективы применения наночастиц для диагностики и лечения болезни Альцгеймера.
Материалы и методы исследования
Для подготовки обзорной статьи был проведен систематический анализ литературы, касающейся патогенеза и современных методов терапии болезни Альцгеймера, классификации наночастиц, роли металлических наночастиц в заболеваниях центральной нервной системы, использовании наночастиц в терапии и дагностике болезни Альцгеймера, сравнительной характеристики магнитных и металлических наночастиц. В качестве основных баз данных использовались e-library и PubMed. Поиск литературы охватывал временной промежуток с 2017 по 2024 г., что соответствует современным требованиям к актуальности источников. В ходе поиска были использованы следующие ключевые слова: «металлические наночастицы», «магнитные наночастицы», «тау-белок», «β-амилоидный пептид», «болезнь Альцгеймера». Общее количество проанализированных источников составило 350. Из них в список литературы были включены 40 наиболее значимых и актуальных работ, что соответствует принципам подготовки современных обзоров, изложенным в протоколе Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA) [6].
Результаты исследования и их обсуждение
Патогенез болезни Альцгеймера
Нейродегенеративные заболевания – это разнородная группа мультисистемных нарушений, поражающих центральную нервную систему (ЦНС) и приводящих к нейродегенерации с прогрессирующим ухудшением когнитивных способностей [7]. Часто встречающиеся нейродегенеративные заболевания – БА, болезнь Паркинсона (БП), боковой амиотрофический склероз, болезнь Хантингтона. БА – наиболее распространенное поражение ЦНС. БА, сочетающаяся с другими нейродегенеративными заболеваниями, называется «смешанной деменцией». Гистологически БА проявляется внеклеточным отложением бляшек Aβ, образованием внутриклеточных нейрофибриллярных клубков (NFTs) гиперфосфорилированного p-tau и нейровоспалением [4]. Дисбаланс между выработкой и выведением Aβ при БА происходит из-за нарушения протеолиза белка-предшественника амилоида (АРР). Агрегация Aβ снижает митохондриальное дыхание в нейронах и астроцитах [8], что препятствует их нормальному функционированию и вызывает гибель нейронов [9]. Aβ связывается с глиальными клетками, высвобождая факторы, вызывающие воспаление и усиливающие гиперфосфорилирование p-tau. Развитию БА способствует также окислительный стресс, возникающий в головном мозге. В настоящее время эффективных методов лечения этих неврологических расстройств практически не существует [1].
Современные методы терапии болезни Альцгеймера
Большинство подходов к терапии БА базируется на ингибировании продукции неправильно сворачивающихся белков, их агрегации и распространения, чтобы снизить уровень токсичности Aβ и тау-белка. На рис. 1 представлены препараты для лечения БА, специфичные к Aβ и находящиеся на разных стадиях клинических испытаний [2].
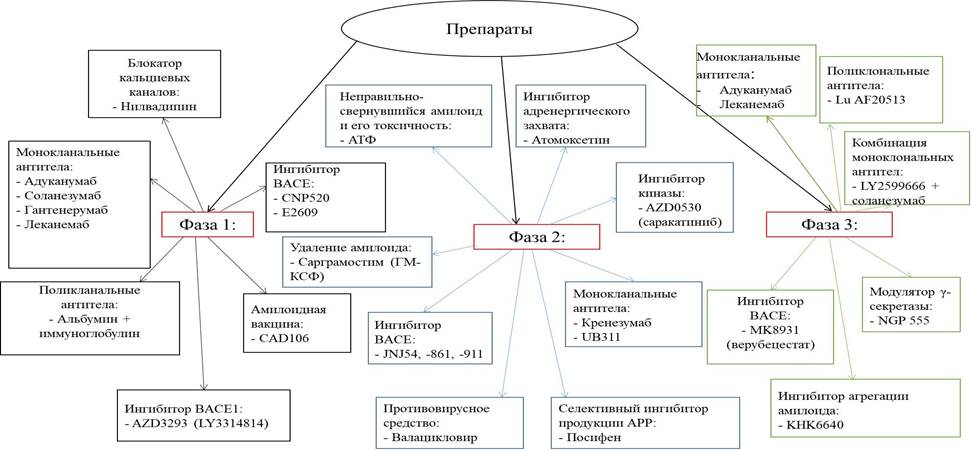
Рис. 1. Препараты, специфичные к Aβ, достигшие I, II и III клинических фаз испытаний [2]
Американским управлением по надзору за пищевыми и лекарственными препаратами одобрено шесть лекарственных препаратов и одна их комбинация для лечения БА: ингибиторы ацетилхолинэстеразы – донепезил, галантамин и ривастигмин для лечения легкой и умеренной БА; антагонист NMDA-рецепторов – мемантин для лечения умеренной и тяжелой форм БА; моноклональные антитела к Aβ – адуканумаб (адухельм) для лечения додементных когнитивных расстройств на ранних стадиях БА и леканемаб; комбинация донепезила и мемантина [7]. В настоящее время стандартом диагностики БА является нейропсихологическое обследование с использованием шкал для оценки выраженности когнитивных расстройств и позитронно-эмиссионной томографии с 18F-флуорбетабеном, 18F-флютеметамолом. Данная шкала была разработана в 2018 г. и переиздана 27 июня 2024 г. Ассоциацией болезни Альцгеймера ADAS-Cog (Alzheimer’s Disease Assessment Scale – Cognitive Subscale), на основании которой было предложено выделить 6 стадий течения БА [10].
Среди новых терапевтических подходов особое внимание уделяется моноклональным антителам, механизм действия которых направлен на регулирование накопления амилоидных бляшек и тау-белка в головном мозге путем нацеливания на уже агрегированные формы Aβ [11]. Помимо фармпрепаратов в терапии БА существуют другие направления: 1) введение факторов роста, а именно фактора роста нервов (NGF), для поддержания функции холинергических нейронов в базальных отделах переднего мозга; 2) клиническое исследование аполипопротеина E (APOE), играющего важную роль в развитии БА [12]; 3) изменение генетической основы БА: гибель нейронов можно предотвратить с помощью синтетических антисмысловых олигонуклеотидов, воздействующих на мРНК и микро-РНК мозга, а именно на ген ассоциированного с микротрубочками тау-белка.
Одним из эффективных направлений, развивающихся в последние десятилетия в диагностике, тераностике и лечении заболеваний ЦНС, являются нанотехнологии. Наноматериалы действуют на молекулярном уровне, могут одновременно поддерживать высвобождение лекарств, повышать их биодоступность, доставлять несколько агентов к мишеням. Наноматериалы являются отличным кандидатом для разработки стратегий обхода гематоэнцефалического барьера (ГЭБ) [13].
Классификация наночастиц
НЧ представляют собой частицы размером 1–200 нм и состоят из углерода, металла, оксидов металлов или органического вещества. Уникальные физические, химические и биологические свойства НЧ обусловлены относительно большей площадью поверхности по отношению к объему, повышенной реакционной способностью, механической прочностью, стабильностью в химическом процессе [14]. Размер НЧ определяет биологическую судьбу, токсичность, распределение и достижение цели. Мелкие НЧ способствуют быстрому высвобождению лекарства, крупные – медленному [15]. Форма НЧ определяет их функции: доставку лекарств, период полувыведения, эндотелиальное поглощение. НЧ имеют различные формы, включая стержневую, сферическую, треугольную, кубическую, гексагональную и другие. Поверхностный заряд и гидрофобность НЧ могут влиять на их биораспределение, время циркуляции и токсичность. Положительно заряженные НЧ лучше доставляют лекарства, но обладают более высокой цитотоксичностью [16].
К органическим НЧ относятся липосомы (модифицированный пептид, полученный из ApoE, ривастигмин), дендримеры (мемантин, такрин, пиридилфенилен) [17], полимерные НЧ (галантамин, донепезил, витаферин, мемантин, розмариновая кислота и куркумин), наногели, мицеллы, твердые липидные НЧ (ресвератрол, пиперин) и наноэмульсии (рис. 2).
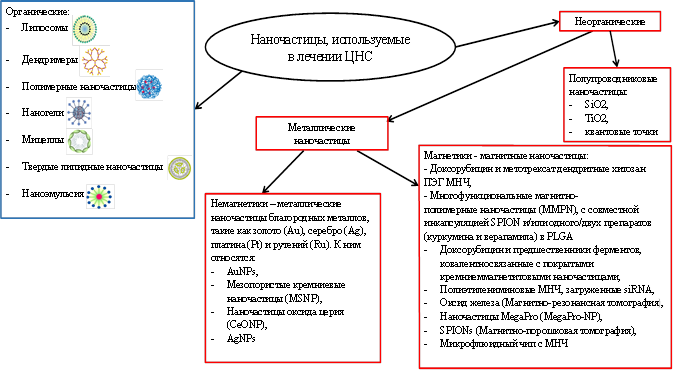
Рис. 2. Классификация НЧ, используемых в лечении ЦНС [17]
Неорганические НЧ не содержат углерод (за некоторыми исключениями, такими как карбонат кальция). МНЧ состоят из металлов, которые имеют слабые связи между атомами, что позволяет электронам свободно перемещаться, поэтому они являются превосходными проводниками тепла и электричества. МНЧ могут быть монометаллическими, биметаллическими или полиметаллическими. Полупроводниковые НЧ состоят из полупроводниковых материалов, которые обладают промежуточными свойствами между металлами и неметаллами [18].
МНЧ подразделяются на два класса: магнитные НЧ (НЧ железа (Fe), кобальта (Co), меди (Cu), никеля (Ni), титана Ti) и цинка (Zn)), и НЧ благородных металлов (золото (Au), серебро (Ag), платина (Pt) и рутений (Ru)). Также МНЧ можно дополнительно классифицировать на основе их магнитных свойств на магнетики и немагнетики [1].
Роль металлических наночастиц в заболеваниях центральной нервной системы
НЧ широко используются при заболеваниях ЦНС, включая нейродегенеративные заболевания, черепно-мозговую травму, инсульт, церебральную опухоль. Как носители лекарств или собственно терапевтические препараты НЧ оказывают нейропротекторный эффект за счет устойчивости к окислению, антиапоптоза и регенерации нервов. Первоначальным фокусом воздействия НЧ являются наиболее уязвимые к гипоксии и эксайтотоксичности нейроны, а также астроциты, перициты, эндотелиальные клетки, а именно антиоксидантные ферменты, антиапоптотические пути и цитокины [16].
МНЧ легко проникают в различные органы, включая мозг, улучшают скорость всасывания, биодоступность и биосовместимость лекарства. Широк спектр введения МНЧ в организм: пероральное, интратрахеальное, внутривенное, внутрибрюшинное и интраназальное [1]. Свойства МНЧ: механическая прочность, большая площадь поверхности, низкая температура плавления, оптические и магнитные свойства [19]. МНЧ имеют ряд недостатков: 1) нестабильность частиц; 2) при синтезе НЧ возможны примеси из-за высокой реактивности НЧ; 3) наноматериалы могут быть токсичны, канцерогенны и вызывать раздражение.
Нейропротекция наночастицами металлов достигается путем регулирования различных метаболических процессов: 1) ингибирование продукции активных форм кислорода (АФК) и активных форм азота за счет контроля над высвобождением митохондриального цитохрома С; 2) подавление активации микроглии и макрофагов в клетках головного мозга; 3) ингибирование гиперфосфорилирования тау-белка [1].
НЧ серебра (AgNPs) активируют митохондрии с образованием АТФ и перекиси водорода в обмен на аденозиндифосфат (АДФ) и сукцинат. AgNPs вызывают воспаление и нарушение работы ГЭБ [20, 21]. НЧ золота (AuNPs) играют важную роль в системах доставки лекарств и индуцируют активность нейронов, подавляют активацию микроглии и макрофагов в клетках головного мозга, снижают фактор некроза опухоли (TNF-α) и уровень АФК в мозге, уменьшают апоптоз и активность каспаз [1, 22, 23]. НЧ селена ингибируют выработку АФК, увеличивают продолжительность жизни нейронов, регулируя систему окислительной защиты, воспалительные реакции, состояние клеточного метаболизма [24]. НЧ рутения хорошо растворяются в воде, что приводит к увеличению их поглощения микроглией. Три основных свойства, благодаря которым НЧ рутения хорошо подходят для применения в медицине: скорость обмена лигандами, диапазон доступных степеней окисления и способность рутения имитировать железо при связывании с определенными биологическими соединениями [25]. Цинк в составе НЧ участвует в свертывании белков и экспрессии генов, высвобождается вместе с глутаматом при возбуждении нейронов [1].
Однако МНЧ накапливаются не только в клетках головного мозга, но и в других органах, вызывая нейротоксичность, запуская выработку АФК и индуцируя окисление белков, а перекисное окисление липидов увеличивает содержание малонового диальдегида в головном мозге, что приводит к нейродегенерации [26].
Магнитные наночастицы (МагНЧ) – это НЧ от 1 до 100 нм. МагНЧ могут создавать временные поры в мембранах клеток, как в случае эндотелия ГЭБ, для улучшения доставки, которая называется магнитопорация. МагНЧ могут взаимодействовать с внешним магнитным полем, что обусловлено их суперпарамагнитными, ферримагнитными и/или ферромагнитными свойствами [27]. Магнитные свойства МагНЧ определяются тремя действующими на МагНЧ силами в кровеносных сосудах: магнитный дрейф, диффузия и адвекция крови [28].
Размер, форма и покрытие МагНЧ могут изменять магнитные силы: маленькие частицы испытывают недостаточную магнитную силу, а слишком большие встречают слишком большое сопротивление в ткани [29]. Напряженность поля должна быть 200–700 мТл с градиентами около 8–100 Тл/м в зависимости от кровотока [30]. Размер и форма МагНЧ также влияют на их характеристики: магнитный отклик, биосовместимость, клеточный захват. По мере уменьшения размера МагНЧ могут переходить от многодоменного к суперпарамагнитному поведению. Размер МагНЧ также влияет на температуру их магнитной блокировки. Мелкие частицы имеют низкие температуры блокировки [31] и высокое отношение площади поверхности к объему, что делает их более реактивными и подходящими для доставки лекарств или катализа [27]. МагНЧ обычно производятся в виде коллоидной феррожидкости: суспензии МагНЧ в водных жидкостях с концентрацией около 1015–1017 частиц/мл [30].
МагНЧ состоит из ядра и оболочки покрытия. Ядро включает магнитные элементы (Fe, Ni, Co и т.д.) и соответствующие им оксиды, оболочка сохраняет их структуру и свойства [27]. Магнитная составляющая МагНЧ представлена биосовместимыми полимерами (поливинилацетатом – ПВА, декстраном, полиэтиленгликолем – ПЭГ и др.) или, например, таким неорганическим покрытием, как SiO2. Оболочка также может быть модифицирована присоединением функциональных групп, биотина, карбодиимидов и других молекул.
Использование наночастиц в терапии и диагностике болезни Альцгеймера
МагНЧ можно применять при БА в качестве: 1) контрастных веществ для магнитно-резонансной томографии (МРТ), 2) гипертермических агентов, где МагНЧ селективно нагреваются под воздействием высокочастотного переменного магнитного поля, 3) магнитных векторов, направленных с помощью градиентов магнитного поля в определенное место [32]. Большинство МагНЧ влияют на время спин-спиновой (Т2) релаксации окружающих тканей. Другие контрастные вещества для МРТ направлены на спиновую решетку (Т1) – время релаксации окружающих протонов, используя обычно хелаты гадолиния (Gd) для сокращения времени релаксации Т1 в тканях [33, 34].
Использование МагНЧ оксида железа (IONPs) при МРТ из-за их чувствительности к Aβ-бляшкам дает возможность визуализации БА на ранних стадиях и мониторинга эффективности антиамилоидной терапии [32–34]. Для визуализации Aβ in vivo, НЧ покрываются бычьим сывороточным альбумином и сиаловой кислотой [35]. In vitro МагНЧ, меченные антителами против Aβ-40 и Aβ-42, применяются для выявления Aβ в крови. Суперпарамагнитные оксиды железа, конъюгированные с куркумином (SPIOs), могут обнаруживать амилоидные бляшки в мозге [36]. На рис. 3 приведены некоторые примеры МагНЧ оксида железа, используемые для диагностики и терапии БА [37].
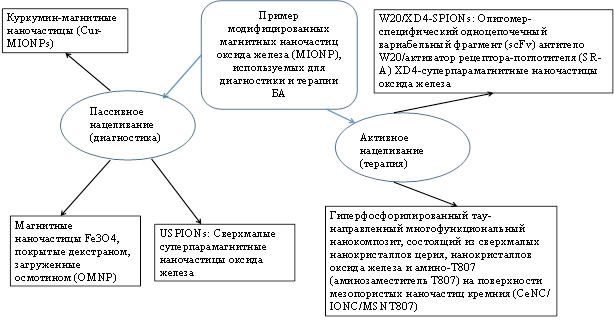
Рис. 3. Пример модифицированных магнитных наночастиц оксида железа, используемых для диагностики и терапии БА [37]
МагНЧ, связанные с антителом к ферритину, используют для обнаружения ферритина в областях с большим количеством амилоидных бляшек при БА [32]. Пэгилированные суперпарамагнитные НЧ оксида железа улучшают память и способность к обучению за счет повышения нейротрофического фактора головного мозга и фосфорилированного белка, связывающего цАМФ. Биосовместимые НЧ, например НЧ золота и оксида железа, обладают способностью перенаправления кинетики фибрилляции Aβ [37]. Магнитные нанокапсулы с кремниевым покрытием (SiMNC) позволяют высвобождать лекарственные препараты посредством удаленного радиочастотного магнитного поля [38].
Сочетание NGF и кверцетина с суперпарамагнитными ионами PPS увеличивает ветвление нейронов в клетках при терапии нейродегенеративных заболеваний. Примененние МагНЧ позволяет решить данную проблему за счет двух возможных вариантов: 1) прямой магнитной фокусировки и 2) фокусировки МагНЧ обходными путями [39].
При двойном магнитном нацеливании (сначала МагНЧ перемещаются внешним магнитным полем для усиления клеточной ассоциации с эндотелиальными клетками мозга, а затем МагНЧ активируются переменным магнитным полем) показано открытие плотных контактов в ГЭБ и целенаправленное накопление МагНЧ в мозге. Следовательно, транспорт МагНЧ через ГЭБ, вызванный двойным магнитным нацеливанием, является эффективным способом доставки терапевтических средств [40].
Существует несколько транспортных путей, по которым лекарственные средства в сочетании с МНЧ могут перемещаться через ГЭБ: пассивная диффузия (параклеточная водная и трансклеточная липофильная диффузия) и рецептор-опосредованный эндоцитоз (рецептор-опосредованный трансцитоз, транспортопосредованный транспорт и адсорбционный опосредованный трансцитоз) [1].
На рис. 4 представлен спектр МНЧ с положительным действием при БА.
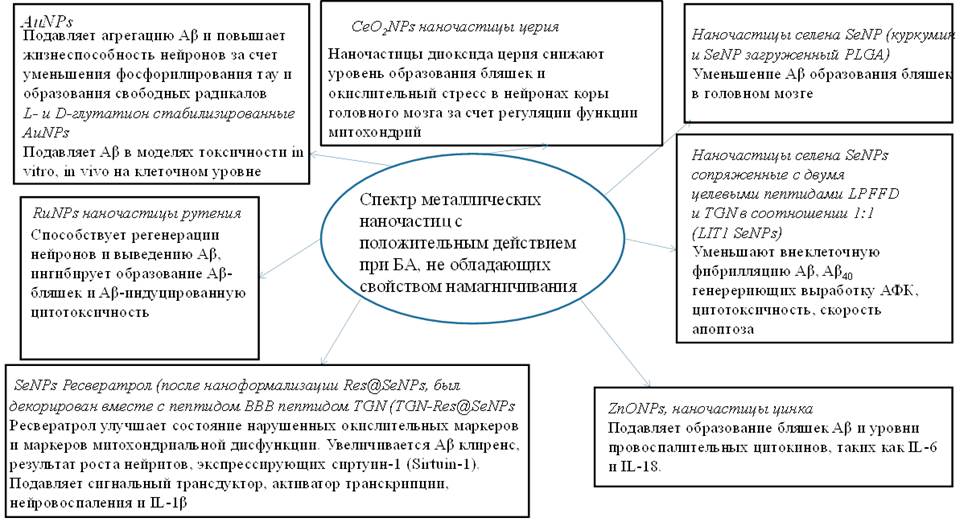
Рис. 4. Спектр металлических наночастиц с положительным действием при БА, не обладающих свойствами намагничивания [1]
Характеристика МНЧ с магнитными и немагнитными свойствами
Проведя сравнительный анализ МНЧ с магнитными свойствами (магнетики) и МНЧ, не обладающих свойством магнетизма (немагнетики), в отношении использования для доставки лекарственных агентов, перспектив в диагностике и терапии БА, можно выявить ряд преимуществ МагНЧ по сравнению с МНЧ (таблица).
Сравнительная характеристика МагНЧ и МНЧ
|
Свойства |
МагНЧ |
МНЧ |
|
Увеличенная площадь поверхности |
+ |
- |
|
Возможность реализации направленной доставки соединения |
+ |
- |
|
Защита терапевтических соединений от деградации |
+ |
- |
|
Увеличение времени циркуляции соединений в кровотоке |
+ |
- |
|
Доставка малорастворимых соединений |
+ |
- |
|
Возможность доставки лекарств во внутриклеточное пространство |
+ |
- |
|
Возможность преодоления защитных барьеров организма |
+ |
- |
|
Уменьшение распределения цитотоксического лекарства в организме |
+ |
- |
|
Значительное снижение количества вводимого препарата |
+ |
- |
Заключение
Таким образом, БА сопряжена со значительным бременем для здоровья и экономики, что требует более глубокого изучения ее патогенеза и разработки новых методов диагностики и терапии. В данной обзорной статье освещены современные проблемы и перспективы применения НЧ для диагностики и лечения БА. Выявлено, что действие МагНЧ (магнетиков) для диагностики и лечения БА становится более эффективным благодаря присутствию магнитного поля, специфическое влияние которого способно контролировать высвобождение из НЧ и распределение лекарства по потребности.
Конфликт интересов
Библиографическая ссылка
Уланова А.А., Альдо Д.Д., Соловьева А.Г. НАНОЧАСТИЦЫ ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА: СОВРЕМЕННОЕ СОСТОЯНИЕ ПРОБЛЕМЫ И ПЕРСПЕКТИВЫ // Современные проблемы науки и образования. 2025. № 4. ;URL: https://science-education.ru/ru/article/view?id=34248 (дата обращения: 05.03.2026).
DOI: https://doi.org/10.17513/spno.34248



