Введение
Термин «эндотип» впервые был использован для установления корреляции между патофизиологическими процессами и клиническими проявлениями бронхиальной астмы [1]. Данный термин подчеркивает гетерогенность заболевания, предполагая наличие различных подгрупп заболевания, характеризующихся специфическими молекулярными и клеточными механизмами. Эндотипы, в отличие от фенотипов, основаны на объективных биологических маркерах и отражают лежащие в основе патогенетические пути развития астмы. Идентификация эндотипов имеет важное значение для разработки персонализированных терапевтических стратегий, направленных на конкретные механизмы заболевания. В настоящее время описаны эндотипы различных заболеваний верхних дыхательных путей, которые обусловлены разным иммунопатогенезом. Эндотип определяет особенности течения заболевания у конкретного пациента вследствие взаимодействия его генетической составляющей и факторов внешней среды [2]. Под диагнозом «хронический аденоидит» могут скрываться различные патологические процессы в глоточной миндалине, имеющие разный патогенез и требующие персонализированной терапии [3]. Метаанализ зарубежных эпидемиологических исследований демонстрирует возрастающую тенденцию распространенности хронического аденоидита, который выявляется у 35% детей с гипертрофией аденоидов, а в некоторых исследованиях этот показатель достигает 70% [4], что свидетельствует о значимости данной медицинской проблемы.
Тип иммунного ответа определяет развитие и прогрессирование хронического воспаления. Исследования указывают на корреляцию между преобладанием определенных субпопуляций T-хелперов (Th) и конкретными эндотипами. Описаны эндотипы, характеризующиеся доминированием Th1-ответа на фоне персистирующей вирусной инфекции или Th2-ответа на фоне аллергии [5]. Данные различия в иммунном ответе влияют на интенсивность воспалительного процесса, риск рецидивов и эффективность различных терапевтических стратегий [6].
Клинические проявления хронического воспаления глоточной миндалины не специфичны и схожи с симптомами других заболеваний верхних дыхательных путей, что затрудняет дифференциальную диагностику и выбор оптимальной тактики лечения [7; 8].
Цель исследования: разработка метода диагностики эндотипа хронического аденоидита у детей.
Согласно гипотезе исследования, воспалительный эндотип заболевания должен проявляться одинаковыми диагностическими маркерами в сыворотке крови и ткани глоточной миндалины. Для проверки данной гипотезы было проведено исследование воспалительных маркеров, характеризующих тип иммунного ответа, в сыворотке крови детей с хроническим аденоидитом и определена экспрессия этих же маркеров в ткани удаленных у них глоточных миндалин.
Материалы и методы исследования. В исследование включены пациенты 3-15 лет с верифицированным диагнозом хронического аденоидита, которым была выполнена аденотомия по показаниям. Контрольную группу составили 40 здоровых детей, отнесенных к I-II группам здоровья. Маркеры воспаления для исследования выбирали, основываясь на значимости выбранных показателей для дифференциальной диагностики эндотипов воспаления. В образцах сыворотки крови участников исследования были измерены концентрации одиннадцати медиаторов воспалительного ответа: IL-1β, IL-5, IL-17 α, IL-6, IL-8, IL-33, IL-35, IL-22, IFN-γ, TNF-α и TGF-β1. Для количественного определения использовался метод иммуноферментного анализа (ИФА), анализировали уровни экспрессии тех же провоспалительных цитокинов в соответствии с протоколами и проводили в тщательно отобранных образцах ткани глоточных миндалин, полученных от всех включенных в исследование пациентов. Анализ был сфокусирован на образцах, демонстрирующих наибольшую информативность с точки зрения гистологических характеристик и наличия маркеров воспаления. Для определения уровня экспрессии каждого маркера применялась оценка суммарного балла иммунореактивности, базирующаяся на методе иммуногистохимического счета, известном как H-score. Выявление дифференцирующих характеристик выполнялось путем анализа критерия Λ, частного критерия Λ и значений F-статистики Фишера. В качестве инструмента статистического анализа был использован алгоритм классификации CHAID (Chi-squared Automatic Interaction Detection), представляющий собой технику построения дерева решений с использованием критерия хи-квадрат. Для статистической обработки полученных данных применялись программные пакеты Statistica 12.0 (StatSoft Inc., USA) и SPSS Statistics.
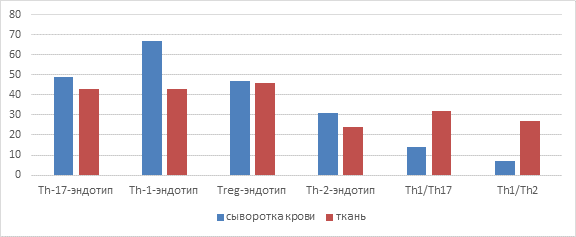
Результаты исследования и их обсуждение. Анализ характеристик сыворотки крови и уровня проявления маркеров в ткани миндалин позволил выделить четыре обособленных эндотипа и два смешанных субэндотипа, демонстрирующих существенные расхождения в паттернах воспаления, как в сыворотке, так и в ткани глоточной миндалины. Th-1-эндотип характеризовался увеличенной экспрессией IFN-γ, TNF-α и IL-1β, что является типичным признаком Th1-иммунного ответа. Treg-эндотип показывал высокие концентрации TGF-β1 и IL-35, известных своими иммунодепрессивными функциями, а Th-2-эндотип отличался преобладанием IL-5 и IL-33, что обычно наблюдается при Th2-ассоциированных иммунных реакциях. Для Th-17-эндотипа ключевыми маркерными цитокинами являлись IL-17 и IL-22, что соответствует опубликованным данным о значении этих цитокинов в Th17-зависимом воспалительном процессе [9] (рис. 1).
|
|
Рис. 1. Численность пациентов с учетом различных эндотипов по результатам сывороточных показателей и уровня экспрессии специфических маркеров в ткани
Источник: составлено авторами по результатам данного исследования.
Иммуногистохимическое исследование продемонстрировало, что, помимо ожидаемой экспрессии в иммунокомпетентных клетках, эпителиальных компонентах и соединительнотканном матриксе, исследуемые маркеры также обнаруживались во внеклеточном матриксе в виде жидкой фракции. Наличие маркеров во внеклеточном матриксе согласуется с данными о секреции различных факторов клетками, формирующими микроокружение [10].
Существенно, что во всех изученных образцах жидкая фракция преобладала, создавая специализированную среду и микроокружение, критичное для клеточных взаимодействий в пределах гистологических структур. Эта среда оказывала значительное влияние на эффективность межклеточных коммуникаций, что соответствует концепции влияния микроокружения на клеточную функцию.
Основываясь на этих данных и учитывая роль поддержания жидкостного баланса в организме, можно выдвинуть гипотезу об идентичности маркеров, определяющих эндотипы, хотя необходимо учитывать потенциальные ошибки измерений. Это предположение требует дальнейшей верификации с использованием дополнительных методов для более точной идентификации компонентов жидкой фракции.
Сопоставление параметров сыворотки крови и экспрессии маркеров в ткани внутри каждого эндотипа осуществлялось посредством анализа сопряженности. Анализ, проведенный для образцов ткани глоточной миндалины, подтвердил наличие четырех эндотипов хронического аденоидита с высокой степенью достоверности (c2(Yates) = 442,2, p <0,0001), при этом коэффициент сопряженности составил 0.82. Полученные результаты подчеркивают важность эндотипирования для разработки персонализированных подходов к лечению (табл. 1).
Таблица 1
Таблица сопряжения эндотипов по показателям сыворотки крови и экспрессии маркеров в ткани
|
Эндотипы сыворотки крови |
Эндотипы ткани |
Всего в эндотипе |
|||||
|
Th-17 |
Th-1 |
Treg |
Th-2 |
Th1/Th2 |
Th1/Th17 |
||
|
Th-17 |
38 (17, 7%) |
1 (0,5%) |
4 (1, 9%) |
0 |
3 (1, 4%) |
3 (1, 4%) |
49 (22, 8%) |
|
Th-1 |
2 (0, 9%) |
38 (17, 7%) |
0 |
1 (0, 5%) |
12 (5, 6%) |
14 (6, 5%) |
67 (31, 2%) |
|
Treg |
0 |
0 |
42 (19, 5%) |
2 (0, 9%) |
2 (0, 9%) |
1 (0, 5%) |
47 (21, 9%) |
|
Th-2 |
0 |
3 (1, 4%) |
0 |
18 (8, 4%) |
5 (2, 3%) |
5 (2, 3%) |
31 (14, 4%) |
|
Th1/Th17 |
3 (1, 4%) |
1 (0, 5%) |
0 |
1 (0, 5%) |
0 |
9 (4, 2%) |
14 (6, 5%) |
|
Th1/Th2 |
0 |
0 |
0 |
2 (0, 9%) |
5 (2, 3%) |
0 |
7 (3, 3%) |
|
Всего в эндотипе |
43 (20, 0%) |
43 (20, 0%) |
46 (21, 4%) |
24 (11, 2%) |
27 (12, 6%) |
32 (14, 9%) |
215 (100%) |
|
c2(Yates) =442,2, p <0,0001, коэффициент сопряжения 0,82 |
|||||||
Источник: составлено авторами по результатам данного исследования.
Следовательно, с высокой достоверностью можно считать, что показатели сыворотки крови отражают соответствующие изменения в ткани и могут быть использованы для диагностики эндотипа без выполнения аденотомии.
Для определения ключевых маркеров с высокой дискриминирующей способностью применялся метод пошагового дискриминантного анализа. В рамках разработанной статистической модели все задействованные переменные продемонстрировали статистически существенное воздействие на точность классификации эндотипов. Анализ показателей сыворотки крови продемонстрировал значительную дискриминантную способность у большинства исследуемых маркеров. Из одиннадцати исследованных маркеров, характеризующих дифференцирующую способность, девять продемонстрировали высокую активность в разделении групп. К ним относятся IFN-γ (интерферон гамма), TNF-α (фактор некроза опухоли альфа), IL-1β (интерлейкин 1 бета), IL-5, IL-17α, IL-22, TGF-β1 (трансформирующий фактор роста бета 1), IL-33 и IL-35 (табл. 2).
Таблица 2
Результаты дисперсионного анализа различий средних показателей между кластерами
|
|
Различия по маркерам сыворотки крови |
Различия по экспрессии маркеров в ткани миндалины |
||
|
Показатель |
F |
p |
F |
p |
|
IFN-γ |
541,2039 |
<0,0000001 |
133,668 |
<0,0000001 |
|
TNF-a |
34,5061 |
<0,0000001 |
1317,194 |
<0,0000001 |
|
IL-1β |
9,0484 |
0,000011 |
90,163 |
<0,0000001 |
|
IL-5 |
17,3449 |
<0,0000001 |
32,472 |
<0,0000001 |
|
IL-17α |
39,2183 |
<0,0000001 |
2521,921 |
<0,0000001 |
|
IL-22 |
125,2433 |
<0,0000001 |
4333,138 |
<0,0000001 |
|
TGF-β1 |
254,8267 |
<0,0000001 |
1770,543 |
<0,0000001 |
|
IL-6 |
18,3361 |
<0,0000001 |
159,994 |
<0,0000001 |
|
IL-8 |
4,6108 |
0,003763 |
49,954 |
<0,0000001 |
|
IL-33 |
3,7503 |
0,011734 |
31,701 |
<0,0000001 |
|
IL-35 |
74,7293 |
<0,0000001 |
1777,254 |
<0,0000001 |
Примечание: F - критерий Фишера, р – значение р при сравнении четырех кластеров.
Источник: составлено авторами по результатам данного исследования.
С учетом установленной важности специфических сывороточных маркеров для каждого идентифицированного эндотипа последующим шагом исследования стала разработка диагностической панели, предназначенной для кластерной идентификации. Развертывание подобного инструментария обеспечивает возможность быстрой и высокоточной оценки эндотипа воспалительного процесса, что способствует назначению терапии, адаптированной к индивидуальным особенностям пациента (персонализированный подход).
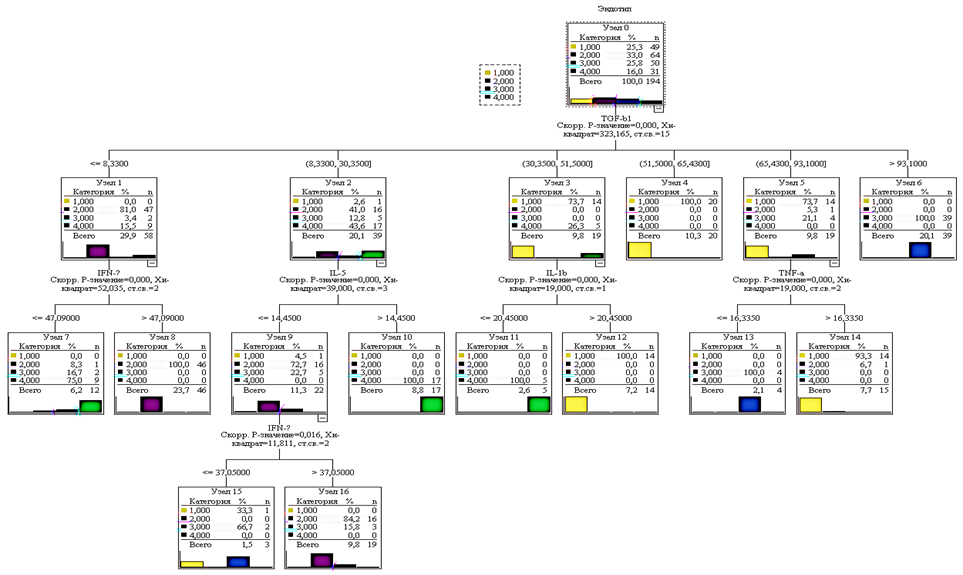
Для статистического анализа был использован алгоритм классификации CHAID (Chi-squared Automatic Interaction Detection) на основе «Дерева решений». В качестве зависимой переменной выступал эндотип, определенный на основе экспрессии тканевых маркеров, а в качестве независимых переменных – уровни сывороточных маркеров воспаления, демонстрирующие наиболее выраженную дискриминационную способность. При построении диагностической модели, исходя из значимости анализируемых переменных, в финальный вариант были включены маркеры: TGF-β1, IFN-γ, IL-5, IL-1β, TNF-α. В контексте корреляционного анализа фактор TGF-β1 продемонстрировал наивысшую степень дифференциальной релевантности в процессе идентификации эндотипа (рис. 2).
|
|
Рис. 2. Дерево решений диагностики эндотипа хронического аденоидита (составлено авторами)
Анализ полученных узлов дерева решений подкрепляет концепцию иммунопатогенетического механизма, лежащего в основе развития хронического воспаления глоточной миндалины. Согласно ключевой гипотезе, патогенез респираторных заболеваний верхних дыхательных путей характеризуется индукцией ремоделирования слизистой оболочки под воздействием цитокинов, медиаторов, ферментов и других биологически активных молекул, высвобождаемых в ходе воспаления. Характер и продолжительность воспалительного процесса играют решающую роль в формировании структурных изменений. Активные исследования направлены на выявление биомаркеров ремоделирования, при этом трансформирующий фактор роста бета (TGF-β) признается наиболее значимым медиатором фиброгенеза. Он обладает способностью индуцировать дифференцировку наивных CD4+ T-лимфоцитов в регуляторные T-клетки (Treg). Интерлейкин-35 (IL-35), секретируемый Treg, оказывает не только прямое иммуносупрессивное действие на эффекторные T-клеточные ответы, но и стимулирует пролиферацию регуляторных T-клеток, формируя, таким образом, выраженную индуцированную популяцию. Treg-клетки, обладая широким спектром иммунорегуляторных функций, участвуют в поддержании периферической толерантности, модулируя активность различных клеточных популяций [11-13]. Регуляторные Т-клетки (Treg) играют важную роль в модуляции иммунного ответа, способствуя восстановлению тканей и регулируя процессы их структурной перестройки. Одним из ключевых факторов, опосредующих взаимодействие между Treg и эффекторными Т-клетками, является трансформирующий фактор роста бета 1 (TGF-β1). Его концентрация служит значимым маркером, позволяющим глубже изучить механизмы хронического воспаления.
Анализ уровня TGF-β1 дает возможность разграничить разные фазы патологического процесса. При Th17- и Th1-опосредованных реакциях преобладает активное воспаление, тогда как для Th2- и Treg-ассоциированных состояний характерны процессы тканевого ремоделирования. В частности, Th2-профиль связан с аллергическим типом воспаления, в то время как Treg-профиль сопровождается фиброзными изменениями и уменьшением лимфоидной ткани в миндалинах. Поэтому оценка уровня TGF-β1 позволяет не только уточнить патогенетические механизмы заболевания, но и определить оптимальную стратегию терапии, учитывающую особенности иммунного ответа у каждого пациента [14; 15].
Проведенный анализ методом дерева решений выявил четкие диагностические критерии для дифференциации иммунологических вариантов хронического аденоидита. На основании полученных данных были определены следующие диагностические алгоритмы. Th1-доминантный профиль характеризуется дефицитом TGF-β1 (концентрация ниже 8.3 пг/мл) и сопровождается гиперпродукцией IFN-γ (превышает 47 пг/мл). Th2-ассоциированный вариант: выявляется при умеренном содержании TGF-β1 (8,3-30,3 пг/мл) вместе с повышенным IL-5 (свыше 14,4 пг/мл), альтернативно диагностируется при TGF-β1 30,3-51,5 пг/мл на фоне сниженного IL-1β (менее 20,4 пг/мл). Th17-опосредованный тип: определяется при значительном росте TGF-β1 (до 65,5 пг/мл) или при TGF-β1 30,3-51,5 пг/мл с увеличенным IL-1β (выше 20,4 пг/мл). Treg-регуляторный профиль: диагностируется при экстремально высоком TGF-β1 (превышающем 93,1 пг/мл) либо при TGF-β1 65,4-93,1 пг/мл с пониженным TNF-α (ниже 16,3 пг/мл). Данные диагностические параметры обеспечивают объективную основу для определения патогенетических механизмов заболевания, что имеет ключевое значение для разработки персонализированных схем терапии.
Совокупная диагностическая точность предложенной модели достигает 95,9%. Результаты валидационного тестирования подтвердили надежность метода - погрешность прогнозирования возрастала минимально: с исходных 4,1% до 9,3% при перекрестной проверке.
Эти данные свидетельствуют о высокой воспроизводимости и клинической значимости разработанного диагностического алгоритма, что позволяет рекомендовать его для практического применения в клинической практике. В зависимости от типа иммунного воспаления, характеризующего эндотип хронического аденоидита, необходимо адаптировать подход к лечению. Для пациентов с Th17-ассоциированной формой заболевания первостепенное значение имеет подбор эффективной антимикробной терапии. В случаях Th1-доминантного типа воспаления оптимальным решением становится применение иммуномодулирующих препаратов, направленных на нормализацию клеточного иммунного ответа. При Treg-варианте патологии рекомендуется радикальный подход - проведение аденотомии на ранних стадиях заболевания без назначения повторных курсов консервативного лечения. Для больных с Th2-опосредованной формой показана комплексная терапия, включающая поэтапное лечение по аналогии с аллергическими патологиями дыхательных путей и инновационные методы биологической терапии, избирательно воздействующие на ключевые звенья Th2-воспаления. Таким образом, эффективность нового метода диагностики хронического аденоидита у детей основывается на его способности обеспечивать быструю и точную дифференциальную диагностику варианта эндотипа, используя объективные критерии оценки.
Заключение
Разработанный алгоритм дифференциальной диагностики эндотипов хронического аденоидита у детей, базирующийся на анализе медиаторов воспаления в сыворотке крови методом иммуноферментного анализа, предоставляет перспективы для прогнозирования типа иммунного ответа, специфичного для каждого отдельного пациента. Это, в свою очередь, создает основу для разработки индивидуализированных терапевтических стратегий. Такой подход позволяет отойти от эмпирического назначения препаратов и перейти к целенаправленному воздействию на патогенетические механизмы заболевания, что может повысить эффективность лечения.
Конфликт интересов
Библиографическая ссылка
Стагниева И.В., Затуливетрова Д.О. ДИАГНОСТИКА ХРОНИЧЕСКОГО АДЕНОИДИТА У ДЕТЕЙ ПУТЕМ ОПРЕДЕЛЕНИЯ ЭНДОТИПА ЗАБОЛЕВАНИЯ // Современные проблемы науки и образования. 2025. № 4. ;URL: https://science-education.ru/ru/article/view?id=34220 (дата обращения: 05.03.2026).
DOI: https://doi.org/10.17513/spno.34220