Введение. Меланома чаще всего локализуется в коже, считаясь самой агрессивной её опухолью, также может возникать в глазах, слизистых и даже в мозговых оболочках [1]. Меланома кожи (МК) занимает пятое место среди наиболее распространенных видов рака [2]. Эта неоплазма чрезвычайно злокачественна, агрессивна и ежегодно становится причиной гибели 55 000 человек. С развитием первичной профилактики и изменением образа жизни заболеваемость некоторыми опухолями снизилась, но заболеваемость МК ежегодно увеличивается примерно на 3% и будет увеличиваться в дальнейшем в связи с повышенным воздействием ультрафиолета, особенно у светлокожих людей [3]. Пятилетняя выживаемость пациентов с МК IV стадии составляет всего 4,6%. Легкие являются наиболее распространенным местом метастазирования МК, на их долю приходится до 40%. Медиана выживаемости пациентов с легочными метастазами МК составляет 7–8 месяцев [4].
Самая важная проблема терапии МК заключается в том, что её клетки по своей природе устойчивы к противораковым воздействиям [5]. Иммунотерапия, разработанная для пациентов с МК, характеризуется малой эффективностью, но высокой токсичностью, что ограничивает применение этого метода лечения на поздних стадиях заболевания. Комбинированная терапия с различными препаратами более эффективна, чем химиотерапия одним агентом, но лишь незначительно влияет на общую выживаемость пациентов с МК. Выявление мутаций в гене BRAF привело к разработке таргетной терапии МК, что улучшило показатели эффективности по крайней мере на начальной стадии заболевания. Однако через несколько месяцев у пациентов развивалась приобретенная резистентность, что стало серьезной клинической проблемой [6]. Использование ингибиторов MEK (митоген-активируемой протеинкиназы), таких как траметиниб и кобиметиниб, улучшало результаты лечения МК, но не устраняло появление приобретенной резистентности [7]. Причиной устойчивости к антиBRAF-терапии, в частности к вемурафенибу, стала активация сигнального пути рецептора эпидермального фактора роста (EGFR) [8].
EGFR относится к семейству рецепторных тирозинкиназ, которые редко мутируют при МК, но экспрессия и активация нескольких членов этого семейства связаны с проинвазивным фенотипом, резистентностью к терапии и, как следствие, – с плохим прогнозом. Подобно проинвазивной рецепторной тирозинкиназе AXL, EGFR экспрессируется в дедифференцированных клетках МК в отрицательной корреляции с фактором меланоцитарной линии MITF [9]. Экспрессия EGFR зависит от влияния ряда белков: главного регулятора окислительного стресса – транскрипционного ядерного фактора эритроидного происхождения 2 (NRF2) [10], члена семейства кинезинов 22 (KIF22) [11] и некоторых других. NRF2 через активацию EGFR стимулирует пролиферацию злокачественных клеток [12; 13], а KIF22 – инвазию МК [11]. Установлено, что при МК повышенная активность EGFR в основном вызвана транскрипционной регуляцией, а не появлением онкогенных мутаций EGFR [7]. Следовательно, выявление новых молекулярных мишеней и разработка терапевтических стратегий, направленных на эти мишени, представляются необходимыми для преодоления развития приобретенной лекарственной устойчивости МК. EGFR, который, по-видимому, является важным белком, участвующим в этом процессе, может быть такой мишенью, а включение его ингибиторов в методы лечения МК может быть полезным.
В Пятигорском медико-фармацевтическом институте с помощью компьютерной программы «Биоэврика» смоделировано и в последующем синтезировано несколько соединений, потенциально обладающих способностью блокировать внутренний домен EGFR и тем самым оказывать противоопухолевое действие в отношении МК. В НМИЦ онкологии предоставлено два образца новых блокаторов EGFR – натриевые соли 6-[(2-бензамидобензоил) амидо]гексановой кислоты (NQEAmK-Na) и 4-{2-[2-(2-Гидрокси-3-метоксифенил)-винил]-6-метил-4-оксо-5-фенил-4H-пиримидин-1-ил}-бензсульфамида (PmSoVn-Na). Все новые соединения, прежде чем будут допущены к использованию в клинической практике, должны пройти экспериментальное изучение in vivo. Для этих целей применяются как CDX-модели (cell line-derived xenograft) – рост клеточных линий опухолей человека у мышей Balb/c Nude, так и сингенные опухоли мышей линии C57Bl/6 – эпидермоидная карцинома лёгкого Льюис и меланома В16 [14; 15]. Учитывая нынешний упор на разработку индивидуальных подходов к лечению рака, в том числе потенциал половых различий [16], изучение противоопухолевой эффективности новых соединений целесообразно проводить на животных обоего пола.
Цель исследования – экспериментальная оценка противоопухолевой эффективности новых субстанций, по механизму действия – блокаторов внутреннего домена EGFR.
Материал и методы исследования. Молекулярное конструирование в ряду пиримидин-4(1Н)-она позволило предположить выраженную противоопухолевую активность, направленную на блокаду внутреннего домена EGFR, в сочетании с низкой токсичностью двух соединений NQEAmK-Na и PmSoVn-Na.
1. Схема синтеза PmSoVn-Na. 2-винилензамещенное производное 4-(2,6-диметил-4-оксо-5-фенил-4H-пиримидин-1-ил)-бензсульфамида было синтезировано по методике стирилирования (рис. 1).
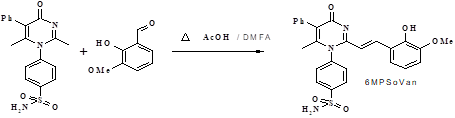
Рис. 1. Схема получения 4-{2-[2-(2-Гидрокси-3-метоксифенил)-винил]-6-метил-4-оксо-5-фенил-4H-пиримидин-1-ил}-бензсульфамида (6MPSoVan)
Источник: составлено авторами.
Для улучшения растворимости в воде его сначала переводили в натриевую соль (рис. 2).
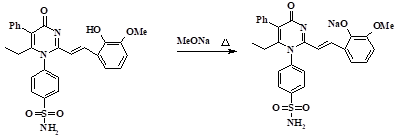
Рис. 2. Схема получения натриевой соли 6MPSoVan (PmSoVn-Na)
Источник: составлено авторами.
А затем для устранения гидроксифенильного радикала – в фенолят. Выход PmSoVn-Na составил 64%. Вещество представляет собой красный кристаллический порошок без запаха. Растворим в воде, этаноле, пропаноле-2, нерастворим в диэтиловом эфире.
2. Схема синтеза NQEAmK-Na. Синтез амида N-бензоилантраниловой кислоты осуществлен реакцией амидирования с ε-аминокапроновой кислотой в ледяной уксусной кислоте без добавления ДМСО (рис. 3).
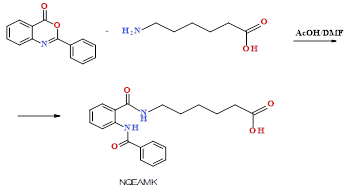
Рис. 3. Схема получения амида о-бензоиламинобензойной кислоты (NQEAmK)
Источник: составлено авторами.
Натриевую соль соединения NQEAmK получали аналогично натриевой соли производного пиримидин-4(1H)-она (6MPSoVan-Na) по карбоксильной группе в реакции с метилатом натрия (рис. 4).
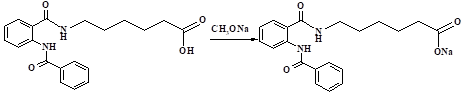
Рис. 4. Схема получения амида о-бензоиламинобензойной кислоты (NQEAmK-Na)
Источник: составлено авторами.
Исследование противоопухолевых свойств новых соединений проводили на модели in vivo с использованием мышей линии С57BL/6, которые поступили из филиала «Андреевка» ФГБУН «Научный центр биомедицинских технологий ФМБА России» (Московская область). При проведении экспериментов соблюдали Европейскую конвенцию по защите позвоночных животных, используемых для экспериментов (Директива 86/609/ЕЭС) и «Международные рекомендации по проведению медико-биологических исследований с использованием животных».
54 мыши: 27 самцов и 27 самок, равномерно распределили на три группы. Всем животным подкожно в правую подлопаточную область была трансплантирована опухоль – меланома B16/F10 (штамм предоставлен НМИЦ онкологии им. Н.Н. Блохина, Москва). Опухолевую взвесь для трансплантации готовили, разбавляя измельчённую ткань опухоли физиологическим раствором в соотношении 1:10. Одному животному вводили 0,5 мл взвеси. Через сутки после трансплантации опухоли начинали курс терапии. Первая основная группа получала новое соединение NQEAmK-Na; вторая основная группа – новое соединение PmSoVn-Na, контрольная группа – воду для инъекций («Гротекс», Россия). Разработанные соединения в основных группах вводили в дозе 18,75 мг/кг внутримышечно в бедренную область ежедневно, предварительно растворив в 0,3 мл воды для инъекций непосредственно перед применением; воду в контрольной группе – в том же объёме и тем же способом, что и в основных группах. Курс лечения состоял из 5 дней введения препаратов с последующим 2-дневным перерывом. Данный цикл повторяли на протяжении всего срока жизни животных.
Для анализа противоопухолевой активности использовали ряд параметров. Среднегрупповую продолжительность жизни (СПЖ) рассчитывали как среднее арифметическое продолжительности жизни всех животных в группе. Увеличение продолжительности жизни (УПЖ) определяли по формуле: УПЖ = [(СПЖ опытной группы - СПЖ контроля) / СПЖ контроля] × 100. Значимым считали УПЖ ≥ 25%. Средний объём опухолей в группах (V) вычисляли как произведение её трех взаимно перпендикулярных линейных размеров. Торможение роста опухоли (ТРО) рассчитывали по формуле: ТРО = (V контроля - V опыта)/ V контроля х 100. Значимым считали ТРО ≥20-50% [17, с. 640-654.; 18].
Полученные результаты подвергали статистическому анализу при помощи программы Statistica 12. На первом этапе посредством критерия Шапиро - Уилка оценивали нормальность распределения показателей в ряду. Поскольку в большинстве случаев распределение показателей было нормальным, их сравнивали попарно с использованием критерия Стьюдента. Результаты в таблицах представлены в виде среднего значения ± ошибка среднего (М ± m). Критический уровень значимости р<0,05.
Результаты исследования и их обсуждение. У всех мышей, вошедших в исследование, латентный период выхода опухолей был примерно одинаков, однако минимальная продолжительность жизни мышей из основных групп была больше соответствующих контрольных значений: у самцов – на 12 суток, у самок – на 10 суток (табл. 1).
Таблица 1
Особенности продолжительности жизни мышей (сутки) под влиянием новых соединений
|
Группы |
Продолжительность жизни |
||
|
min |
max |
средняя |
|
|
Самцы |
|||
|
Меланома В16 + вода, n=9 |
14 |
34 |
27,50 ± 0,96 |
|
Меланома В16 + NQEAmK-Na, n=9 |
26 |
40 |
34,0 ± 4,16 |
|
Меланома В16 + PmS0Vn-Na, n=9 |
26 |
60 |
48,00* ± 6,02 |
|
Самки |
|||
|
Меланома В16 + вода, n=9 |
15 |
30 |
28,33 ± 0,67 |
|
Меланома В16 + NQEAmK-Na, n=9 |
25 |
60 |
39,67*т ± 4,91 |
|
Меланома В16 + PmS0Vn-Na, n=9 |
25 |
40 |
30,33 ± 4,84 |
Примечание: * – показатели отличались от контрольных значений статистически значимо (р<0,05).
Источник: таблица составлена авторами на основе полученных в ходе исследования данных.
Максимальная продолжительность жизни у самцов, получавших PmS0Vn-Na, была на 26 суток больше, чем в контрольной группе, тогда как у самцов, получавших NQEAmK-Na, – всего на 6 суток больше, чем в контроле, и в результате – в 1,5 раза (на 20 дней) меньше, чем у самцов основной группы 2 (табл. 1). У самок максимальная продолжительность жизни, так же как и у самцов, была больше в основных группах по сравнению с контролем: у самок, получавших NQEAmK-Na – в 2,0 раза (на 30 дней) больше, у самок, получавших PmS0Vn-Na – на 10 дней больше; в результате максимальная продолжительность жизни у самок из основной группы 2 была на 20 дней меньше, чем у самок из основной группы 1 (табл. 1).
Средняя продолжительность жизни самцов, получавших PmS0Vn-Na, была в 1,7 раза (р<0,05) больше, чем у контрольных животных соответствующего пола (табл. 1). У самок, получавших NQEAmK-Na, отмечалась лишь тенденция к увеличению средней продолжительности жизни в 1,4 раза по сравнению с контрольными значениями. Значение показателя УПЖ в основной группе 1 составило: у самцов – 23,6%, у самок – 40,0%; в основной группе 2: у самцов – 74,5%, у самок – 7,1%. Исходя из того, что за значимые принимают значения УПЖ ≥25%, можно заключить, что наиболее эффективно увеличивало продолжительность жизни животных обоего пола соединение NQEAmK-Na, поскольку у самцов этот показатель отличался от критичного уровня УПЖ всего на 1,6%, а у самок – превышал его на 15%. Тогда как соединение PmS0Vn-Na увеличивало продолжительность жизни исключительно у самцов, превысив при этом критическую величину УПЖ на 49,5% (табл. 1).
Только у самцов из основной группы 2 с 18 суток от начала экспериментальной терапии отмечалось уменьшение объёма опухолей, который был меньше соответствующего контроля в 2,2 раза, самцов из основной группы 1 в 2,5 раза и самок из основной группы 2 в 2,7 раза (табл. 2).
Таблица 2
Динамика объёмов (мм3) подкожных опухолей у мышей с меланомой В16 под влиянием NQEAmK-Na и PmS0Vn-Na в сравнении с контрольной группой, М±m
|
Сутки от перевивки |
Меланома В16 + вода, n=18 |
Меланома В16 + NQEAmK-Na, n=18 |
Меланома В16 + PmS0Vn-Na, n=18 |
|||
|
♀, n=9 |
♂, n=9 |
♀, n=9 |
♂, n=9 |
♀, n=9 |
♂, n=9 |
|
|
18 |
6,54 ± 0,15 |
5,35 ± 1,09 |
6,98 ± 0,75 |
6,02 ± 0,94 |
6,64 ± 0,58 |
2,421,2, + ± 0,43 |
|
25 |
17,22 ± 1,33 n=8 |
16,72 ± 0,86 n=7 |
10,941 ± 0,55 |
12,181 ± 0,52 |
19,732 ± 2,49 |
7,951, + ± 0,90 |
|
28 |
30,00 n=1 |
25,00 n=1 |
10,47 ± 0,60 n=6 |
18,42+ ± 1,61 n=5 |
33,06 n=2 |
14,70 ±1,73 |
|
32 |
- |
32,00 n=1 |
16,72 ± 1,94 n=5 |
30,42+± 2,27 n=5 |
23,32 n=1 |
17,682 ± 3,46 n=8 |
|
35 |
- |
- |
13,00 ± 1,07 n=5 |
33,49+±2,84 n=5 |
29,17 n=1 |
13,852 ± 2,65 n=6 |
|
41 |
- |
- |
18,77 ± 1,72 n=4 |
- |
- |
28,31 ± 8,39 n=5 |
|
55 |
- |
- |
30,00 n=1 |
- |
- |
38,74 ± 6,40 n=3 |
Примечание. Статистическая значимость отличий: 1 – относительно значений мышей соответствующего пола контрольной группы; 2 – между группами веществ, + – самцов от самок в пределах одной группы (р<0,05; ♀ – самки, ♂ – самцы).
Источник: таблица составлена авторами на основе полученных в ходе исследования данных.
На 25-е сутки эксперимента разница между объёмами опухолей самцов из основной группы 2, соответствующим контролем и самками из этой же группы сохранялась, тогда как значимые отличия по сравнению с самцами из основной группы 1, характерные для 18-х суток, исчезали. Обусловлено это было тем, что у животных из основной группы 1 на этом сроке наблюдения также отмечалось замедление роста опухолей: у самок объём опухолей был меньше контроля в 1,6 раза (р<0,05), у самцов – в 1,4 раза (р<0,05), при этом объёмы опухолей у самцов и самок статистически значимо не различались между собой. В результате объём опухолей у самок из основной группы 1 был в 1,8 раза (р<0,05) меньше, чем у самок из основной группы 2. Необходимо отметить, что в этот период начался падёж животных в контрольной группе: у самцов он составил 22%, у самок – 11%, тогда как в основных группах все животные оставались живыми (табл. 2). На 28-е сутки эксперимента падёж животных в контрольной группе достиг 89%. В основной группе 1 в живых оставалось 56% самцов и 67% самок, при этом средний объём опухолей у самцов был в 1,8 раза (р<0,05) больше, чем у самок, а средний объём опухолей животных из основной группы 1 был меньше, чем объём опухолей мышей из контрольной группы: самцов – в 2,9 раза, самок – в 1,5 раза. В основной группе 2 на 28-е сутки наблюдения все самцы были живыми, тогда как 89% самок пало. Объём опухолей у самцов из основной группы 2 по-прежнему не отличался от объёма опухолей самцов из основной группы 1 и был в 2,2 раза меньше, чем объём опухолей у оставшихся в живых самок из этой же группы, и в 1,7 раза меньше, чем объём опухоли самца из контрольной группы (табл. 2).
На 32-е сутки наблюдения в живых оставался один самец из контрольной группы, при этом все самки пали, и одна самка из основной группы 2, при этом пал только один самец из этой группы (табл. 2). У самцов из основной группы 1 объём опухолей был больше, чем у самок из этой же группы, в 1,8 раза (р<0,05) и самцов из основной группы 2 в 1,7 раза (р<0,05). На 41-е сутки от начала экспериментальной терапии в живых оставалось только 44,4% самок из основной группы 1 и 55,5% самцов из основной группы 2, объёмы опухолей у них не отличались между собой, тем не менее максимальный объём опухолей у самцов двукратно превышал максимальный объём опухолей у самок. На 55-е сутки наблюдения оставались в живых 33,3% самцов из основной группы 2 и 11,1% самок из основной группы 1 (табл. 2).
Поскольку продолжительность жизни мышей из контрольной группы была короче, рассчитать ТРО в основных группах животных можно было для самок до 28 суток, для самцов до 32 суток включительно (табл. 3). Установлено, что ТРО более 50% регистрировался у самцов, получавших PmS0Vn-Na, на 18-е сутки от начала введения препарата с последующим снижением этого показателя на 13,6% к 28 суткам, при этом все животные оставались живы; у самок из этой группы ТРО не достигал 20% ни на одном из сроков наблюдения, при этом к 28 суткам большая часть самок пала (табл. 3).
Таблица 3
Торможение роста опухолей меланомы В16 под влиянием новых соединений
|
Группы |
Сутки от трансплантации опухолей |
||||
|
18 |
25 |
28 |
32 |
||
|
Меланома В16 + NQEAmK-Na |
Самки, n = 9 |
-6,7 |
36,5 |
65,1 n = 6 |
- |
|
Самцы, n = 9 |
-12,5 |
27,2 |
26,3 n = 5 |
4,9 n = 5 |
|
|
Меланома В16 + PmS0Vn-Na |
Самки, n = 9 |
-1,5 |
-14,6 |
-12 n = 2 |
- |
|
Самцы, n = 9 |
54,8 |
52,5 |
41,2 |
44,8 n = 8 |
|
Источник: таблица составлена авторами на основе полученных в ходе исследования данных.
В группе мышей, получавших NQEAmK-Na, ТРО более 50% регистрировался только у самок на 28-е сутки экспериментальной терапии после меньшего увеличения на 25-е сутки; у самцов из этой группы ТРО был несколько больше 20% на 25-е и 28-е сутки наблюдения. По данным ТРО с 18-х по 32-е сутки экспериментальной терапии можно заключить, что, по всей видимости, соединение PmS0Vn-Na одинаково эффективно подавляло рост опухолей у всех самцов, тогда как NQEAmK-Na хорошо подавляло рост опухолей у двух третей самок, поскольку после гибели 3 самок к 28-м суткам показатель ТРО вырос почти в 2,0 раза (табл. 3).
EGFR – это трансмембранный гликопротеин с молекулярной массой 170 кДа, широко представленный как в нормальных, так и в злокачественных клетках, включая клетки немелкоклеточного рака легкого, меланомы, рака желудка, предстательной железы и других видов рака [19]. Структурно EGFR состоит из трех доменов: внеклеточного, связывающего лиганд; трансмембранного, представленного гидрофобным участком; и внутриклеточного, обладающего тирозинкиназной активностью. На основе этих структурных особенностей были разработаны таргетные препараты для лечения онкологических заболеваний – блокаторы EGFR. По механизму действия эти блокаторы подразделяются на две группы: ингибиторы внеклеточного домена и ингибиторы внутриклеточного тирозинкиназного домена EGFR [20]. Примером ингибитора внеклеточного домена является цетуксимаб – рекомбинантное химерное моноклональное антитело, созданное на основе мышиного моноклонального антитела М225 с присоединением фрагмента человеческого IgG1 для снижения иммуногенности. Он обладает высокой специфичностью и конкурирует с естественными лигандами (EGF; TGF-a) за связывание с рецептором. Препараты с таким механизмом действия входят в схемы лечения метастатического колоректального рака, локализованного плоскоклеточного рака головы и шеи в комбинации с лучевой терапией, немелкоклеточного рака лёгких с экспрессией EGFR, особенно при отсутствии мутаций в гене KRAS и других – в тех случаях, когда отмечается высокая экспрессия EGFR в опухолях.
Гефитиниб, иресса, эрлотиниб, осимертиниб – препараты из группы низкомолекулярных ингибиторов тирозинкиназной активности EGFR, блокирующие внутренний домен EGFR. Их преимущество состоит в отсутствии конкуренции с лигандами EGFR за связывание с внеклеточным доменом рецептора. Благодаря своей низкой молекулярной массе блокаторы внутреннего домена EGFR обладают хорошей проникающей способностью. Они нашли своё применение преимущественно в лечении немелкоклеточного рака лёгкого. Однако последние исследования показывают их эффективность и при лечении немеланомного рака кожи [21]; меланомы, развивающейся на слизистых [22]. Известные препараты данного класса вводятся исключительно перорально. Некоторые онкологи относят такой путь введения к преимуществам блокаторов тирозинкиназного домена EGFR, тогда как у пациентов со злокачественными опухолями часто встречаются коморбидные заболевания желудочно-кишечного тракта, которые не позволяют в полной мере поступать таргетному препарату в организм в результате ограничения его всасывания. Поэтому разработка блокаторов внутреннего домена EGFR, обладающего способностью проявлять высокую противоопухолевую активность при парентеральном способе его введения, является насущной потребностью.
Ещё одна проблема, возникающая у онкологических пациентов – разная эффективность противоопухолевого лечения, причиной чего могут быть не только особенности опухолевого роста, но и тот факт, что при назначении противоопухолевых препаратов не учитываются индивидуальные особенности пациентов, в частности возраст и пол. Связано это с тем, что доклинические исследования, как правило, начинаются с тестирования на клеточных линиях, а затем продолжаются на самцах грызунов, а в клинических испытаниях задействуют относительно небольшое число тщательно отобранных пациентов, без учёта их индивидуальных характеристик, в том числе и пола [23]. Исключение параметра «пол» может привести к неверной интерпретации, предвзятости и неправильному переносу результатов в клиническую практику. Поэтому всё больше исследователей, по большей части зарубежных, выступают за пересмотр экспериментальных протоколов с учётом генетического пола на всех доклинических этапах, чтобы обеспечить надёжную основу для новых методов лечения рака [24; 25].
В результате совместной работы Пятигорского медико-фармацевтического института и Ростовского НМИЦ онкологии были разработаны и сконструированы два соединения для парентерального введения, по механизму действия – блокаторы внутреннего домена EGFR, по химическому строению – натриевые соли производных пиримидин-4она. Тактику разработки соединений – потенциальных ингибиторов EGFR на основе производных пиримидина – используют в настоящее время и зарубежные учёные [26], что свидетельствует о её актуальности и перспективности. Эффективность этой тактики была подтверждена и в наших исследованиях [27]. При изучении противоопухолевого действия новых субстанций установлено, что оно имело половую специфичность: PmS0Vn-Na было эффективным исключительно на самцах, тогда как NQEAmK-Na показало лучшую эффективность на самках, чего не встречалось ранее [27].
Возможно, что разная противоопухолевая активность синтезированных соединений у мышей разного пола могла быть обусловлена особенностями их гормональной регуляции, например степенью экспрессии рецепторов эстрогенов (ER)-α36 [28]. Известно, что опухоли, развивающиеся в мужском и женском организме, имеют разную чувствительность к гормональной стимуляции эстрогенами [29]. Причём, кроме пути EGF, выделяют по крайней мере 5 сигнальных путей, активируемых эстрогенами, которые могут быть задействованы в опухолевом росте при «выключении» пути EGF [30]. Полученные данные требуют дополнительных исследований, направленных на выявление причин разной чувствительности самок и самцов мышей к данным соединениям.
Заключение. Таким образом, вновь синтезированные соединения – натриевые соли производных пиримидин-4(1Н)-она, оказывают разную противоопухолевую эффективность в отношении меланомы В16 у мышей разного пола. Соединение NQEAmK-Na показало среднюю противоопухолевую эффективность у самок (УПЖ = 40%), тогда как соединение PmS0Vn-Na – выраженную противоопухолевую эффективность у самцов (увеличение средней продолжительности жизни в 1,7 раза (р<0,05), УПЖ = 75%, высокие значения ТРО с 18 суток наблюдения сохранялись в течение 2 недель).
Конфликт интересов
Библиографическая ссылка
Франциянц Е.М., Каплиева И.В., Кодониди И.П., Глушко А.А., Шихлярова А.И., Алексеев Э.К., Качесова П.С., Трепитаки Л.К., Чиряпкин А.С. ЭКСПЕРИМЕНТАЛЬНАЯ ОЦЕНКА ПРОТИВООПУХОЛЕВОЙ ЭФФЕКТИВНОСТИ НОВЫХ ОТЕЧЕСТВЕННЫХ СУБСТАНЦИЙ – БЛОКАТОРОВ РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА // Современные проблемы науки и образования. 2025. № 5. ;URL: https://science-education.ru/ru/article/view?id=34205 (дата обращения: 27.02.2026).
DOI: https://doi.org/10.17513/spno.34205



