Введение
По данным Всемирной организации здравоохранения, колоректальный рак (КРР) вызывает значительное количество смертей во всем мире, занимая третье место по частоте среди всех видов онкологических заболеваний, что подчеркивает важность ранней диагностики и профилактических мер. Среди КРР преобладает поражение толстой кишки, на долю которой приходилось 59,5% новых случаев и 61,9% смертей [1].
Рак правой половины толстой кишки встречается реже, чем рак левых отделов, и в зависимости от популяции и методов исследований частота рака правой половины толстой кишки варьирует от 20% до 30% среди всех случаев рака толстой кишки [2; 3].
Хирургический метод лечения пациентов с КРР является основным и может выполняться как открытым - лапаротомным, так и лапароскопическим или робот-ассистированным способами. Независимо от варианта оперативного доступа самым грозным осложнением гемиколэктомии справа является несостоятельность илеотрансверзоанастомоза. Так, несмотря на использование современных сшивающих аппаратов, в когортном ретроспективном исследовании общая частота послеоперационных осложнений составила 28,9%, а частота несостоятельности анастомоза - 2,6%. Независимыми предикторами осложнений после гемиколэктомии справа были пожилой возраст (ОШ 1,03, 95%ДИ 1-1,06; Р = 0,01), расширенная гемиколэктомия (ОШ 2,76, 95%ДИ 1,07-7,08; Р = 0,035) и экстренное хирургическое вмешательство (ОШ 4,5, 95%ДИ 1,3-14,9; Р = 0,035). 0,014) [4].
При анализе регистра 4062 пациентов, перенесших открытую правостороннюю гемиколэктомию с наложением илеотрансверзоанастомоза (n=2742 – ручной, n=1320 - степлерный) по поводу рака толстой кишки, немецкого общества общей и висцеральной хирургии (DGAV StuDoQ) не было выявлено существенной разницы в частоте несостоятельности ручного анастомоза – 106 (3,9%) [5].
Принцип формирования илеотрансверзоанастомоза «бок в бок» как антиперистальтически, так и изоперистальтически, включая открытый и лапароскопический доступ, идентичен, что доказано исследованием ISOVANTI. Изоперистальтический и антиперистальтический анастомоз показывают схожие результаты с точки зрения физиологичности, безопасности и функциональности [6]. По мнению D. Symeonidis et al., важным является освоение обеих анастомотических техник, а выбор между двумя конфигурациями должен осуществляться на основе каждого индивидуального случая [7].
Профилактика несостоятельности анастомозов продолжает оставаться важнейшей областью исследований на протяжении десятилетий. Разработанные методы и технологии (физическое укрепление, герметики, воздействие на микросреду кишечника и др.) не были окончательно успешны [8]. Ни совершенствование ручной техники формирования анастомоза, ни применение современных сшивающих аппаратов не исключают риска возникновения несостоятельности анастомозов. Поэтому совершенствование подходов и оптимизация способов формирования илеотрансверзоанастомоза продолжают оставаться актуальными.
Цель исследования: сравнительная оценка результатов исполнения скобочного шва межкишечного анастомоза с оригинальной методикой его укрепления.
Материалы и методы исследования
Авторами проведено одноцентровое, ретроспективно-проспективное рандомизированное исследование. Проанализированы результаты хирургического лечения 287 пациентов, которым в плановом порядке была выполнена правосторонняя гемиколэктомия с одномоментным наложением антиперистальтического илеотрансверзоанастомоза «бок в бок» в период с 2021 по 2024 г. в отделении абдоминальной онкологии и торакальной онкологии ГБУЗ СО «ТГКБ № 5» г. Тольятти. Операции выполнялись по стандартизированной методике одной и той же группой хирургов, с едиными принципами предоперационной подготовки и послеоперационного ведения.
Критерии включения: пациенты, подписавшие добровольное информированное согласие на участие в исследовании; возраст 18-75 лет; шкала для комплексной оценки состояния пациента в онкологии ECOG (Eastern Cooperative Oncology Group) 0–2 балла; индекс коморбидности Charlson 1-4 балла; отсутствие сахарного диабета I и II типа; ИМТ (индекс массы тела) в пределах 16-35 кг/м²; патоморфологическая картина рT2-4аN0-1M0G1-3.
Критерии невключения: предшествующее неоадъювантное лечение; индекс коморбидности Charlson выше 5 баллов; наличие сахарного диабета; ИМТ выше 35 кг/м² и ниже 16 кг/м²; патоморфологическая картина, отличная от рT2-4аN0-1M0G1-3, местнораспространенная и диссеменированная формы; наличие нескорректированной гипопротеинемии (общий белок < 50 г/л), острых осложнений: кровотечения, перфорации опухоли или острого нарушения кишечной проходимости.
Критерии исключения: больные, отказавшиеся от участия на любом из этапов исследования.
После подписания формы информированного добровольного согласия на обработку персональных данных и использование результатов их обследования и лечения в научных целях пациенты были рандомизированы в две группы. Использована простая рандомизация методом генерации случайных чисел.
В основной группе (n=90) проводилось дополнительное укрепление скобочного шва анастомоза по предложенному нами способу (патент на изобретение № 2726346 C1 Российская Федерация «Способ защиты и укрепления межкишечного анастомоза "бок в бок" при использовании линейного сшивающего аппарата», опубл. 14.07.2020.) [9].
В контрольной группе (n=100) формирующийся степлерный/скрепочный анастомоз дополнительно не укреплялся.
Выделенные группы сравнения пациентов с характеристиками по полу, возрасту, локализации опухоли представлены в таблице1.
Таблица 1
Характеристика пациентов групп сравнения (n=190)
|
Показатель |
Группа основная (n= 90) |
Группа контрольная (n=100) |
р |
|
Возраст, годы |
69±12,1 |
68±9,8 |
>0,05 |
|
Число больных, м/ж |
33/57 |
30/70 |
>0,05 |
|
Локализация опухоли: |
|
|
|
|
слепая кишка |
31 (34%) |
40 (40%) |
>0,05 |
|
восходящая кишка |
42 (47%) |
35 (35%) |
>0,05 |
|
печеночный изгиб |
15 (17%) |
18 (18%) |
>0,05 |
|
поперечная ободочная кишка |
2 (2%) |
7 (7%) |
>0,05 |
При всех оперативных вмешательствах использовался линейный сшивающий аппарат Panther (China) со следующими характеристиками: длина 80 мм, использовалась кассета с высотой незакрытой скрепки 3,85 мм, закрытой 1,5 мм, сечением скрепки 0,19 мм х 0,30 мм с лимфодиссекцией D2.
Предоперационная подготовка и критерии обследования в дооперационном периоде применялись в соответствии со стандартами, принятыми в лечебном учреждении с предоперационной очисткой кишечника [10]. Все исследуемые пациенты оперировались в плановом порядке. Послеоперационное ведение и лечение выполнялось согласно принципам, отработанным и принятым в отделении и согласно концепции Fast Track Enchanced Recovery Surgery [11].
В основной группе при наложении илеотрансверзоанастомоза «бок в бок» с использованием линейного сшивающего аппарата производили сближение кишок, фиксацию их серозно-мышечным швом и формировали перфоративные отверстия для введения сшивающих линий аппарата. Затем выполняли сшивание тканей стенок кишок скобками с использованием сшивающей кассеты. Далее производили защиту и укрепление линий продольного и перпендикулярного скобочного шва путем наложения обвивного непрерывного рассасывающегося шовного материала (применялся Полигликолид PGA), с шагом в 5 мм формировался циркулярный шов (рис. 1).
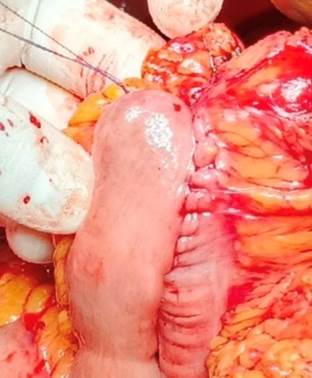
Рис. 1. Интраоперационное фото. Правосторонняя гемиколэктомия. Этап операции с дополнительным укреплением линии скобочного шва
В контрольной группе при формировании илеотрансверзоанастомоза с использованием линейного сшивающего аппарата аналогично прошивали и полнослойно отсекали аппаратом удаляемую часть кишечника и таким образом получали продольный и перпендикулярный скобочные швы без дополнительного укрепления (рис. 2 и 3).
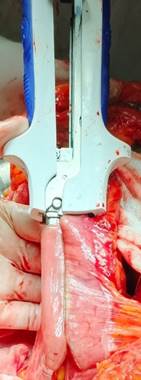
Рис. 2. Интраоперационное фото. Правосторонняя гемиколэктомия. Этап операции без укрепления линий скобочного шва. Продольное формирование скобочного шва
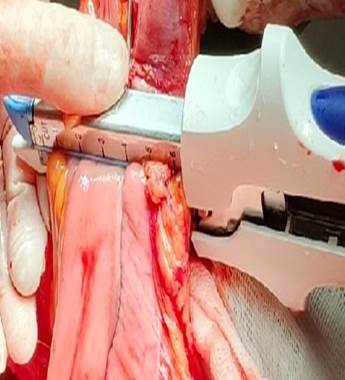
Рис. 3. Интраоперационное фото. Правосторонняя гемиколэктомия. Этап операции без укрепления линий скобочного шва. Перпендикулярное формирование скобочного шва
В исследовании в качестве первичного клинического исхода была выбрана частота несостоятельности анастомоза. Вторичными клиническими исходами исследования были количество и характер послеоперационных осложнений, а также длительность нахождения в стационаре после операции.
При описании количественных данных мы использовали среднее значение и стандартное отклонение. Достоверность различий средних значений мы оценивали с помощью U-теста Манна - Уитни. Достоверность различий качественных показателей в группах оценивали с помощью индекса Пирсона и критерия Фишера.
Результаты исследования и их обсуждение
Из 287 пациентов, согласно выделенным критериям включения, невключения и исключения, исследовано 190 человек.
Обе группы пациентов были сопоставимы по полу, возрасту (18-75 лет), локализации опухоли, шкале ECOG (Eastern Cooperative Oncology Group), индексу массы тела (ИМТ), индексу коморбидности Charlson 1-4 балла, стадии заболевания (рT2-4аN0-1M0G1-3), характеру доступа (лапаротомия), виду операции (гемиколэктомия справа), радикальности вмешательства, качеству лимфодиссекции D2, при этом был использован сшивающий аппарат Panther (China), 80 мм (синяя кассета).
Группы сравнения представлены в таблице 2.
Таблица 2
Непосредственные результаты операции в группах сравнения
|
Показатель |
Группа основная (n= 90) M ± m |
Группа контрольная (n=100) M ± m |
P |
|
Длительность операции, мин. |
115±32 |
100±37 |
>0,05 |
|
Длительность формирования анастомоза, мин. |
9±2,1 |
7±1,2 |
>0,05 |
|
Число послеоперационных койко-дней |
15±5 |
18±6 |
>0,05 |
|
Число больных с осложнениями |
8 (8,88%) |
26 (26,00%) |
>0,05 |
|
Несостоятельность швов анастомоза |
0 |
9 (9,00%) |
>0,05 |
|
Число умерших |
0 |
2 (2,00%) |
>0,05 |
При анализе полученных в ходе исследования данных обращает на себя внимание статистически незначимая разница в интраоперационных хронометрических показателях (табл. 2).
В основной группе отмечается незначительное удлинение (в среднем на 15 мин.) средней продолжительности операции из-за наложения дополнительных укрепляющих швов - 115±32 мин. по сравнению с контрольной группой - 100±37 мин. (p>0,05).
Некоторое увеличение стационарного периода послеоперационной госпитализации и восстановления пациентов в контрольной группе (18±6 койко-дней) объясняется в основном нагноением срединной раны (p>0,05).
Выявлено сокращение количества осложнений послеоперационного периода в основной группе пациентов - 8 (8,88%), при отсутствии несостоятельности анастомоза. В контрольной группе без укрепления анастомоза - 26 (26,0%), из которых - 9 (9,0%) имели несостоятельность анастомоза, 2 (2,0%) случая с летальным исходом (р>0,05).
В контрольной группе 5 (5,0%) человек с несостоятельностью анастомоза «велись на дренаже», закрытие свища примерно на 14±2 суток без релапаротомии, выписаны в удовлетворительном состоянии на 20±3 суток от даты операции. Релапаротомии в 4 случаях на 6±2 суток с разрушением илеотрансверзоанастомоза и выведением в виде 2-ствольной стомы на переднюю брюшную стенку; двое пациентов выписаны на 16-е и 21-е сутки после второй операции - заживление послеоперационной раны вторичным натяжением, в остальных 2 (2,0%) случаях наступил летальный исход из-за нарастания почечной недостаточности и впервые возникшего острого инфаркта миокарда.
В основной группе 8 (8,88%) осложнений связано с нагноением послеоперационной раны (6 (5,4%) пациентов) и 2 (2,22%) пациента перенесли гипертонический криз, потребовалась коррекция лечения с привлечением терапевта.
В контрольной группе у 3 (3,33%) больных отмечались явления анастомозита, что проявлялось клиническими и подтверждалось ультразвуковыми признаками инфильтрата брюшной полости, гипертермией, ослаблением перистальтики. Всем пациентам с данным осложнением потребовалось продолженное консервативное лечение до купирования его симптомов и достижения клинического эффекта.
Клинический пример
Пациентка, 57 лет, обратилась в ГБУЗ СО «ТГКБ № 5» в плановом порядке в августе 2023 г. в приемный покой хирургического отделения с жалобами на периодическое вздутие живота, тошноту, бледность кожного покрова. При осмотре по правому боковому флангу пальпировалось опухолевидное новообразование около 6 см в диаметре. Госпитализирована в хирургическое отделение. При ультразвуковом исследовании органов брюшной полости выявлено гипоэхогенное образование восходящего отдела толстой кишки 58 мм в диаметре. В общем анализе крови - снижение гемоглобина до 87 г/л. Общий анализ мочи и биохимические показатели крови без значимых изменений. Назначено симптоматическое лечение в виде инфузионной и спазмолитической терапии. Начата подготовка к фиброколоноскопии. При фиброколоноскопии выявлена циркулярная опухоль восходящего отдела толстой кишки около 65 мм, занимающая 3/4 ее просвета, выполнена биопсия опухоли. Заключение патогистологического исследования - аденокарцинома G2. На основании проведенного обследования поставлен диагноз: рак восходящего отдела толстой кишки сT4aN0M0G2, частичная обтурационная толстокишечная непроходимость. Больная переведена в специализированное отделение абдоминальной и торакальной онкологии через 6 суток после госпитализации. Получено предварительное согласие пациентки на хирургическое лечение в объеме - лапаротомия, гемиколэктомия справа, дренирование брюшной полости. В течение суток проведена стандартная подготовка пациентки к операции, включающая механическую очистку кишечника препаратом «Фортранс». Осмотр анестезиолога. Комбинированный наркоз. Срединная лапаротомия. Интраоперационно выявлена опухоль восходящего отдела толстой кишки около 6 см в диаметре без распространения на соседние органы и ткани. Петли толстого и тонкого кишечника умеренно дилатированы. Выполнена гемиколэктомия справа с лимфаденэктомией D2. По описанной выше методике наложен аппаратный илеотрансверзоанастомоз «бок в бок» с формированием продольного и перпендикулярного скобочных швов. Выполнено укрепление скобочных швов путем наложения обвивного непрерывного рассасывающегося шовного материала (применялся Полигликолид PGA), с шагом в 5 мм формировался циркулярный шов. Под линии соединения кишок установлен силиконовый двухпросветный дренаж 5 мм диаметром и дополнительный аналогичный дренаж в малый таз через контрапертуру в правой подвздошной области. Лапаротомная рана послойно ушита. Антибактериальная профилактика выполнялась путем в/в введения антибиотика цефазолин натрия 1,0 г за 30 минут до начала операции, далее через 12 ч в течение 2 суток. Послеоперационное ведение и лечение выполнялось согласно принципам, отработанным и принятым в отделении. Первые сутки в отделении реанимации и интенсивной терапии. Со вторых суток перевод в отделение абдоминальной и торакальной онкологии, активизация, дыхательная гимнастика, прием воды, на 3-4-е сутки дробный, до 6-8 раз в сутки прием жидкой и отварной пищи. Ежедневный контроль клинического состояния и отделяемого по дренажам (серозное, в среднем около 60 мл). Лабораторные показатели на 1, 3, 7-е сутки после операции - без значимых изменений. На 5-е сутки отделяемое по дренажу из-под анастомоза отсутствует, данный дренаж удален. На 7-е сутки был оформленный стул. При ультразвуковом исследовании органов брюшной полости на 8-е сутки скопление жидкости в брюшной полости отсутствует, абсцессов не выявлено. Отделяемое по дренажу из малого таза около 10 мл серозного характера, второй дренаж удален. Швы сняты через один. На 10-е сутки пациентка в удовлетворительном состоянии выписана из стационара с рекомендациями постановки на учет в онкополиклинике, консультации химиотерапевта, швы доснять амбулаторно. В онкополиклинике через 8 месяцев при выполнении фиброколоноскопии очаговой патологии не выявлено, анастомоз свободно проходим, около 20 мм в диаметре. Продолжен амбулаторный контроль.
Формирование илеотрансверзоанастомоза с использованием линейных сшивающих аппаратов является надежным и универсальным методом. Но в то же время данные о частоте несостоятельности после степлерного и ручного сшивания анастомозов противоречивы. По данным анализа рандомизированных контролируемых исследований отражено, что при степлерном анастомозе было зафиксировано значительно меньшее количество несостоятельности по сравнению с ручным сшиванием (S=11/441, HS=42/684, OR 0,48 [0,24, 0,95] p=0,03) [12]. Другие результаты: стриктуры, кровотечения из анастомоза, время наложения анастомоза, повторные операции, смертность, развитие внутрибрюшного абсцесса и раневой инфекции, а также продолжительность стационарного периода - не показали статистически значимой разницы. Также описано исследование, где продемонстрировано двукратное увеличение несостоятельности анастомозов именно при их скрепочном формировании (ОШ, 2,91; 95% ДИ, 1,53-5,53; р <0,001) и (ОШ, 2,41; 95% ДИ, 1,24-4,67; р = 0,009) [13].
Из-за отсутствия возможности адекватной индивидуальной оценки толщины стенок тканей кишечника и при отсутствии необходимой степлерной кассеты с надлежащим уровнем закрытия высоты скобки, при формировании илеотрансверзоанастомоза требуется дополнительное укрепление линий соединения анастомоза. Для снижения частоты и предотвращения полной или частичной несостоятельности анастомоза предлагаются различные инструменты и методы для армирования линии скрепок [14]. Дефекты лапароскопического аппаратного анастомоза выявляются в 18% наблюдений, что требует дополнительного укрепления и герметизации линии механического шва [15; 16].
По нашему мнению, результаты представленного исследования продемонстрировали эффективность предложенного способа укрепления илеотрансверзоанастомоза. Это позволило статистически значимо сократить количество осложнений в послеоперационном периоде, избежать его частичной или полной несостоятельности. Об этом свидетельствует и меньшее число анастомозитов (1,10%) в раннем послеоперационном периоде в основной группе пациентов (р=0,02).
Заключение
По данным проведенного анализа, в послеоперационном периоде наблюдалось статистически значимое уменьшение осложнений в основной группе у 8 человек (8,88%) по сравнению с группой контроля – у 26 больных (26,0%). В контрольной группе несостоятельность швов анастомоза развилась у 9 (9,0%) пациентов, в основной группе случаев несостоятельности анастомоза не отмечено.
В основной группе отмечалось незначительное увеличение продолжительности операции - 115±32 мин., обусловлено длительностью формирования анастомоза - 9±2,1 мин., послеоперационный койко-день - 15±5, отсутствие летальности.
В группе контроля длительность операции и формирования анастомоза соответственно 100±37 и 7±1,2 мин., послеоперационный койко-день - 18±6, летальность - 2 (2,0%).
Укрепление линии скобочного шва по запатентованной методике показало статистически значимые результаты эффективности способа защиты линии межкишечного соединения. Применение разработанного способа защиты и укрепления межкишечного анастомоза «бок в бок» при использовании линейного сшивающего аппарата при правосторонней гемиколэктомии позволяет улучшить непосредственные результаты лечения и сократить количество несостоятельности анастомоза и послеоперационных осложнений.
Безусловно, широкое применение и выбор данного способа операции в качестве оптимального требует более полной оценки как непосредственных, так и отдаленных результатов лечения с включением большего числа наблюдаемых случаев.
Конфликт интересов
Библиографическая ссылка
Симатов С.А., Каторкин С.Е. ОСОБЕННОСТИ ФОРМИРОВАНИЯ ИЛЕОТРАНСВЕРЗОАНАСТОМОЗА С ИСПОЛЬЗОВАНИЕМ ЛИНЕЙНОГО СШИВАЮЩЕГО АППАРАТА: СРАВНИТЕЛЬНЫЙ АНАЛИЗ МЕТОДИК ОДНОГО ЦЕНТРА // Современные проблемы науки и образования. 2025. № 3. ;URL: https://science-education.ru/ru/article/view?id=34111 (дата обращения: 27.01.2026).
DOI: https://doi.org/10.17513/spno.34111



