Введение. Имплантат-ассоциированная инфекция (перипротезная инфекция - ППИ) является грозным осложнением операции тотального эндопротезирования коленного сустава [1].
До настоящего времени наиболее распространенным методом лечения пациентов с хронической глубокой ППИ является двухэтапное ревизионное эндопротезирование с промежуточной установкой суставного антимикробного спейсера [2,3].
При проведении ревизионного эндопротезирования по поводу инфекционных осложнений после артропластики сустава применяют блоковидные или артикулирующие антимикробные суставные спейсеры [4,5]. При этом, одним из основных положительных качеств артикулирующего суставного спейсера является возможность осуществления движений в суставе до реимплантации постоянного эндопротеза, что благоприятно сказывается на качестве жизни пациента [6,7].
Помимо интраоперационного изготовления возможно использование официнальных, так называемых преформированных спейсеров [8,9]. Данный вид спейсеров изготовлен в заводских условиях без индивидуального подбора размера компонентов, и каждое изделие содержит в себе ограниченный объем антибиотиков без возможности самостоятельного добавления антимикробных препаратов. Рутинное использование изделий затруднено при наличии обширных дефектов костей, формирующих коленный сустав, а также высокой стоимостью, особенно в условиях экономических санкций.
Существуют заводские формы для интраоперационного изготовления компонентов артикулирующего спейсера коленного сустава [10]. Одним из таких вариантов является форма для изготовления COPAL® knee moulds (Heraeus, Germany), StageOne™ Cement Spacer Molds® (Zimmer-Biomet, USA), форма для изготовления спейсеров для коленного сустава KASM® (Ortho Development Corporation, Draper, UT, USA).
Высокая себестоимость изготавливаемого изделия (спейсер), а также ограничение возможности их использования (закупки) вследствие определенных экономических условий, ограничивают их применение в повседневной клинической практике.
Изготовление артикулирующего спейсера также возможно при помощи силиконовых форм [11]. Недостатками таких спейсеров является необходимость индивидуального изготовления специальных форм до проведения оперативного вмешательства.
Недостатком спейсеров, изготовленных индивидуально при помощи аддитивных технологий (3D-печать), является сложность технологического процесса и высокая себестоимость данных изделий [12].
Так, Митрофанов В.Н. и соавторы приводят две методики интраоперационного изготовления артикулирующего спейсера коленного сустава. Одна из них заключается в использовании нового официнального бедренного компонента и слепленного вручную тибиального компонента спейсера (пара трения «металл-цемент»). Вторая методика заключается в имплантации новых официнальных компонентов эндопротеза по типу «временно-постоянного» (пара трения «металл-полиэтилен»). В обоих случаях для имплантации компонентов спейсера авторы использовали костный цемент с антибиотиками. Однако необходимо отметить, что применение данных методик влечет за собой дополнительные расходы, связанные с использованием новых компонентов эндопротеза, что в современных условиях не всегда экономически возможно, особенно в клиниках, не имеющих финансирования по программе высокотехнологичной медицинской помощи [13].
Одним из наиболее перспективных методов изготовления артикулирующего спейсера коленного сустава является использование ранее удаленного бедренного компонента и интраоперационно изготовленного тибиального компонента из костного цемента импрегнированного антибиотиками [14 с.165-167; 15 с. 158-160].
Цель - демонстрация клинического случая первого этапа лечения пациента с хронической глубокой ППИ после тотальной артропластики коленного сустава с использованием оригинально изготовленного тибиального компонента при помощи формы отпечатка.
Материалы и методы исследования
Приводим клинический пример. Пациент, мужчина, 61 год, обратился за консультативной помощью к травматологу стационарной службы г. Ульяновска с мае 2024 г. с жалобами на постоянные боли в левом коленном суставе, усиливающиеся при физической нагрузке, ограничение объема движений в оперированном суставе, наличие свища с обильным отделяемым, длительное повышение температуры тела до субфебрильных значений. Был госпитализирован в травматологическое отделение в 2024 году с диагнозом “Хроническая глубокая перипротезная инфекция после ТЭКС, свищевая форма. Гипертоническая болезнь 3 стадии, контролируемая артериальная гипертензия. Ожирение 1 степени. Сахарный диабет 2 типа, целевой гликированный гемоглобин < 7,5%. Риск сердечно-сосудистых осложнений высокий. Целевое АД менее 130/80 мм рт ст. Хронический панкреатит. Хронический гастрит. Хроническая железодефицитная анемия легкой степени тяжести”.
Для диагностики были использованы: междисциплинарный осмотр пациента врачом травматологом-ортопедом совместно с врачом хирургом, консультация врача терапевта (с целью предоперационной подготовки), контрастная фистулография, мультиспиральная компьютерная томография, микробиологическое исследования раневого отделяемого, дуплексное сканирование сосудов нижних конечностей (артерий и вен), электрокардиография, базовые лабораторные анализы крови и мочи, расчет и анализ показателей провоспалительных гематологических индексов.
Результаты исследования и их обсуждение
По поводу терминального гонартроза пациенту выполнено первичное тотальное цементное эндопротезирование левого коленного сустава. При имплантации компонентов эндопротеза был использован костный цемент без антибиотиков. Для профилактики инфекции области хирургического вмешательства был введено 2 г антибиотика (Cefazolin) согласно действующих клинических рекомендаций. В послеоперационном периоде пациент получал комплексную терапию, включавшую антикоагулянты, инфузионную терапию, перевязки, лечебную физкультуру. В раннем послеоперационном периоде пациент не соблюдал предписанный ортопедический режим, передвигался с полной нагрузкой на оперированную ногу. Через 5 месяцев пациент обратился в клинику травматологии и ортопедии с жалобами на воспалительный процесс в области протезированного сустава.
Пациент при ходьбе использовал вспомогательные средства опоры (костыли) ввиду болезненности осевой нагрузки на оперированную ногу. Визуально отмечался умеренный отек левого коленного сустава. Послеоперационный рубец по передней поверхности левого коленного сустава был состоятелен. Пальпация левого коленного сустава была болезненная. Отмечалась сгибательно-разгибательная контрактура в суставе: разгибание 170°, сгибание 70–75°. Наблюдалась небольшая гиперемия и гипертермия кожи над левым коленным суставом. Симптом баллотирования надколенника отрицательный. Сосудистых и неврологических расстройств выявлено не было.
По наружной поверхности коленного сустава, на уровне проксимального отдела голени, имелся «губовидный» свищ размером 1 см х 1 см, из которого выделялось обильное серозно-геморрагическим отделяемым без запаха.
При микробиологическом исследовании отделяемого из свищевого хода роста микрофлоры не выявлено. Данный факт может быть обусловлен неконтролируемым приемом антибиотиков на амбулаторном этапе лечения.
Результаты лабораторной диагностики: эритроциты 4,92х1012/л; гемоглобин 112 г/л; гематокрит 35,5%; лейкоциты 7,23х109/л; нейтрофилы (абс.) 3,9; лимфоциты (абс) 2,06; СОЭ 30 мм/ч; С-реактивный белок 70,1 мг/л.
По данным фистулографии обнаружен затек контрастного вещества до компонентов эндопротеза (DESTIKNEETM (Meril, India)), зоны резорбции костной ткани под компонентами эндопротеза (рис. 1).
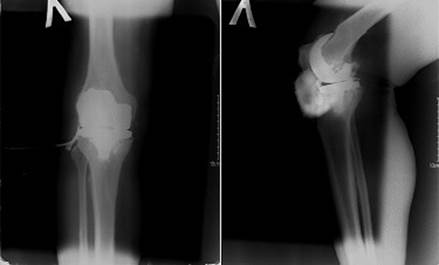
Рис. 1. Фистулография левого коленного сустава в двух проекциях (описание в тексте) (оригинальные данные рентгенологического исследования пациента, выполненные в стационаре до проведения ревизионного эндопротезирования)
Принимая во внимание наличие хронической перипротезной инфекции (наличие сформированной зрелой микробной биопленки на поверхности компонентов эндопротеза), в частности культуронегативную инфекцию, неудовлетворительное состояние параартикулярных мягких тканей, в том числе наличие свищевого хода, сообщающегося с зоной эндопротеза, после согласования с пациентом решено провести радикальное оперативное вмешательство с удалением компонентов эндопротеза и костного цемента с имплантацией антимикробного спейсера.
Под спинальной анестезией выполнена артротомия с иссечением послеоперационного рубца. Расширения оперативного доступа для полноценной визуализации тибиального и бедренного компонентов эндопротеза не потребовалось. Учитывая локализацию свища и свищевого хода вне зоны предполагаемого оперативного доступа, его поверхность была подвергнута обработке острой костной ложкой без радикального иссечения. Данный вариант обработки свищевого хода противоречит общепринятым принципам радикальной санации очага инфекции. Однако в данном клиническом случае дополнительный разрез кожи и параартикулярных тканей для радикального иссечения свищевого хода мог привести к ухудшению кровообращения мягких тканей и возможному их некрозу, что могло способствовать отрицательному результату лечения.
После обработки зоны контакта «протез-цемент» тонкими ревизионными долотами, при помощи экстракторов стабильные компоненты эндопротеза удалены. Далее с использованием фрез и остеотомов удалена цементная мантия с максимальным сохранением нативной костной ткани костей, формирующих коленный сустав (рис. 2).
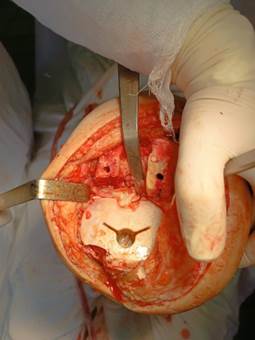
Рис. 2. Интраоперационное фото. Бедренный компонент и цемент удалены. Тибиальный компонент эндопротеза удален экстрактором, цементная мантия частично фрагментирована (оригинальное интраоперационное фото, выполненное во время проведения пациенту оперативного вмешательства)
Для воздействия на микробную биопленку были применены физические факторы воздействия на рану в виде ультразвуковой кавитации в растворе антибиотика и воздействия пульсирующей струей жидкости. В результате рана заполнена йодсодержащим антисептиком до момента имплантации спейсера.
При помощи формы отпечатка, соответствующей форме и размеру удалённого полиэтиленового вкладыша, из Refobacin Revision® (BIOMET, France), содержащего в своем составе клиндамицин и гентамицин, с дополнительным добавлением 2000 мг порошка ванкомицин был изготовлен индивидуальный (F/7-8/9мм LPS) тибиальный компонент суставного спейсера (рис. 3). Для получения формы отпечатка использовали пластичную полимерную массу покрытую стерильной пленкой, а также примерочный вкладыш необходимо размера для стабилизации суставного связочного комплекса. После осушения раны от антисептика компоненты суставного спейсера имплантированы при помощи антибиотиксодержащего костного цемента (Synicem 1 (Synimed, France) + порошок ванкомицина 4000мг). Далее выполнено послойное ушивание раны с установкой перфорированной дренажной трубки подкожно. Дренаж был удален на 2-е сутки с момента операции.

Рис. 3. Вид тибиального компонента спейсера (описание в тексте) (оригинальное интраоперационное фото, выполненное во время проведения пациенту оперативного вмешательства)
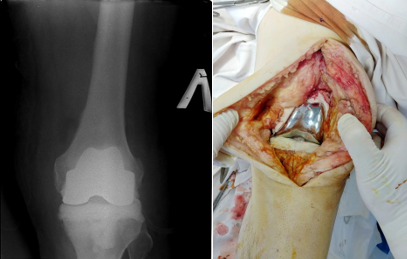
Рис. 4. Слева - рентгенография левого коленного сустава в прямой проекции (имплантирован артикулирующий спейсер) (оригинальные данные рентгенологического исследования пациента, выполненные в стационаре после проведения ревизионной операции); справа – внешний вид имплантированного спейсера (оригинальное интраоперационное фото, выполненное во время проведения пациенту оперативного вмешательства)
В послеоперационном периоде проводилась профилактика венозных тромбоэмболических осложнений, лечебная гимнастика, перевязки, коррекция железодефицитной анемии (железо-гидроксид-сахарозный комплекс 100 мг 1 раз в сутки в/в капельно 5 дней), парентеральная антибактериальная терапия (АБТ) (цефтаролина фосамил 600 мг 2 раза в сутки в/в капельно 14 дней). На амбулаторный этап лечения АБТ не назначалась.
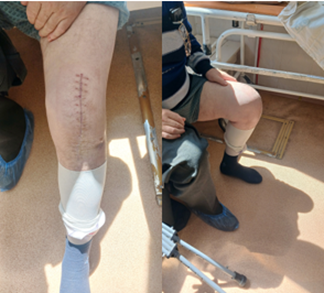
Рис.к 5. Внешний вид коленного сустава (оригинальные фото пациента, выполненные автором во время проведения этапного осмотра пациента)
Отмечено неосложненное течение раневого процесса с заживлением послеоперационной раны первичным натяжением, после чего пациент выписан из стационара. Наличие артикулирующего спейсера позволило улучшить качество жизни пациента путем ранней разработки движений в оперированном суставе (рис. 5) с дозированной осевой нагрузкой и возможностью передвигаться на личном автомобиле. ППИ купирована, что позволило провести ревизионное эндопротезирование с установкой постоянного эндопротеза в федеральной клинике.
В настоящее время для лечения пациентов с хронической перипротезной инфекцией отправляют в федеральные центры, имеющие в своем составе специализированное отделение. Данные клиники благодаря федеральному финансированию имеют возможность применения различных вариантов артикулирующих спейсеров. Однако в ряде случаев, срок ожидания госпитализации в специализированный стационар для проведения этапного лечения может затянуться на несколько месяцев, что в свою очередь может привести к ухудшению не только общего состояния пациента, но и локального статуса в виде развития параартикулярного фиброза мягких тканей и формирования дефектов костной ткани. Учитывая отсутствие необходимости применения дорогостоящих одноразовых расходных материалов, нами был применен оригинальный способ изготовления спейсера, так называемый «handmade», что позволило провести первый этап лечения пациента по программе ОМС на базе многопрофильного стационара без федерального финансирования.
Выводы. Клинический пример демонстрирует индивидуальный пациентоориентированный подход при изготовлении артикулирующего спейсера, импрегнированного антибактериальными препаратами с возможность подбора размеров спейсера и коррекции использования антибиотиков. Простота, воспроизводимость и низкий уровень экономических затрат при изготовлении спейсера данным способом обуславливает возможность широкого применения предлагаемого метода в клинке травматологии и ортопедии.
Конфликт интересов
Библиографическая ссылка
Ефремов И.М., Шевалаев Г.А., Сухих С.С. ОРИГИНАЛЬНЫЙ СПОСОБ ИЗГОТОВЛЕНИЯ АРТИКУЛИРУЮЩЕГО СПЕЙСЕРА КОЛЕННОГО СУСТАВА // Современные проблемы науки и образования. 2025. № 3. ;URL: https://science-education.ru/ru/article/view?id=34089 (дата обращения: 26.01.2026).
DOI: https://doi.org/10.17513/spno.34089



