Сложность и неоднородность изменений, происходящих в миокарде предсердий у больных с фибрилляцией предсердий (ФП), заставляют проводить специальные исследования для того, чтобы выяснить, существует ли различие в электрокардиографических и гемодинамических процессах, которое следовало бы учитывать при выборе медикаментозной терапии [1–3]. Для этого лучше использовать регистрацию электрокардиограммы (ЭКГ) через пищевод и ультразвуковое исследование сердца [4–6].
В настоящее время для профилактики пароксизмов фибрилляции предсердий (ПФП) применяют главным образом бета-адреноблокаторы, пропафенон, амиодарон [7–9]. Однако выбор антиаритмических средств в большинстве случаев осуществляется эмпирически [10–12].
Основной целью данной работы явилась попытка ответить на вопрос о возможности проведения медикаментозной терапии с учетом электрофизиологических и гемодинамических патогенетических механизмов возникновения ФП.
Появление в последние десятилетия большого числа эффективных блокаторов рецепторов ангиотензина-II (БРА) способствовало успешному лечению больных артериальной гипертензией [13, 14]. Однако единой точки зрения в отношении показаний к терапии БРА у больных с ФП и артериальной гипертензией нет. Наряду с этим имеются сообщения, что БРА в результате снижения внутрипредсердного давления увеличивают эффективный рефрактерный период предсердий и, как следствие, снижают эктопическую активность предсердий [15, 16].
В доступной литературе не сообщается о влиянии телмисартана на предсердную проводимость, объем и давление в предсердиях у женщин с ФП и артериальной гипертензией (АГ) I–II степени, I стадии. Можно предположить, что препарат в результате уменьшения объема предсердий снижает внутрипредсердное давление, увеличивает скорость проведения возбуждения по предсердиям и тем самым нивелирует предсердные электрофизиологические субстраты возникновения и поддержания ФП.
Цель исследования. Провести анализ влияния блокаторов рецепторов к ангиотензину II на электрофизиологический и гемодинамический субстрат возникновения фибрилляции предсердий у пациенток с артериальной гипертензией.
Материал и методы исследования. Клиническое исследование было проведено на 148 женщинах, которые были разделены на две группы. В первую (контрольную) группу были включены 68 женщин без аритмического анамнеза, из которых 21 женщина были в репродуктивной стадии (средний возраст 34,7±1,7 года), 24 женщины – в менопаузальном переходе (средний возраст 45,9±2,1 года), 23 – в постменопаузе (средний возраст 56,8±2,4 года). Вторая группа включала 80 женщин с пароксизмальной ФП и артериальной гипертензией I–II степени, I стадии. Из них 23 были в репродуктивной стадии (средний возраст 32,5±1,9 года), 30 – в менопаузальном переходе (средний возраст 44,5±2,2 года) и 27 – в постменопаузе (средний возраст 55,6±2,4 года). У женщин второй группы в репродуктивной стадии ПФП повторялись 2,6±0,21 раза в год и продолжались 19,4±0,89 секунды, в менопаузальном переходе – 3,9±0,29 раза в год и длились 27,3±1,09 секунды, в постменопаузе – 6,4±0,34 и 38,5±1,41 соответственно. Стадии репродуктивного старения установлены на основании классификации STRAW+10 [17].
Методы исследования включали в себя: стандартное клиническое обследование, регистрацию чреспищеводной электрокардиограммы (ЧпЭКГ), трансторакальное ультразвуковое исследование сердца (УЗИ сердца), суточное мониторирование электрокардиограммы, оценку риска кардиоэмболических осложнений согласно шкале CHADS-VASC2.
Для регистрации чреспищеводной электрокардиограммы (ЧпЭКГ) применяли электрофизиологический комплекс «Astrocard» и ультразвуковой аппарат «Рускан-60» (НПО «Сканер»).
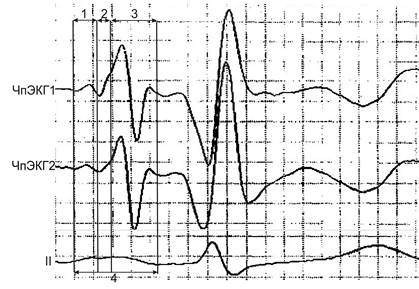
Регистрацию униполярной чреспищеводной электрокардиограммы (ЧпЭКГ) проводили с двух контактов электрода – проксимального и дистального, по стандартной методике: электрод вводили через рот или нос, на расстоянии 40–50 см от передних резцов. Далее проводили регистрацию ЧпЭКГ с последующей записью в память компьютера. Затем в ручном режиме производили измерение временных интервалов с усилением в 50 мм/мВ и фильтром в диапазоне от 1 до 40 Гц. Оценивали ВВПП, ВВЛП, ВВМПП, ОВВ (рис. 1).
|
|
|
Рис. 1. Пример записи ЧпЭКГ Примечание. ЧпЭКГ1 – регистрация униполярной ЧпЭКГ с проксимального контакта электрода. ЧпЭКГ2 – регистрация униполярной ЧпЭКГ с дистального контакта электрода. II–II стандартное отведение ЭКГ. 1 – время возбуждения правого предсердия. 2 – время возбуждения межпредсердной перегородки. 3 – время возбуждения левого предсердия. 4 – общее время возбуждения предсердий. |
По данным ЧпЭКГ, возбуждение правого предсердия имеет форму купола, межпредсердного проведения – косовосходящей линии, левого предсердия – синусоидальную.
Время возбуждения правого предсердия (ВВПП) определяли от точки начала восходящего колена до точки пересечения нисходящего колена с началом косовосходящей линии. Время возбуждения межпредсердной перегородки (ВВМПП) определяли от точки пересечения нисходящего колена с началом косовосходящей линии межпредсердного проведения до точки пересечения конечной точки этой линии с точкой крутого подъема. Время возбуждения левого предсердия (ВВЛП) определяли от начала точки пересечения конечной точки возбуждения межпредсердного проведения с точкой крутого подъема до конечной точки возбуждения левого предсердия во II стандартном отведении. Общее время возбуждения предсердий (ОВВ) оценивали от точки начала возбуждения восходящего колена правого предсердия до конечной точки возбуждения левого предсердия во II стандартном отведении.
По данным эхокардиографии оценивали индекс объема левого предсердия (ЛП), давление в правом (ДПП) и левом (ДЛП) предсердиях.
Оценку влияния телмисартана на ЧпЭКГ и гемодинамические аритмогенные субстраты у пациентов с фибрилляцией предсердий и артериальной гипертензией I–II степени, I стадии, проводили на фоне терапии телмисартаном в индивидуально подобранных дозах от 40 до 80 мг (в среднем 62,4±1,8 мг). Антиаритмическую терапию на фоне терапии телмисартаном считали эффективной при уменьшении частоты и длительности пароксизмов ФП на 70% и больше, снижении клинической выраженности аритмии и/или трансформации в бессимптомную форму. Антикоагулянтную терапию проводили при CHA2DS2-VASc >1. Для купирования редких пароксизмов ФП применяли схему «таблетка в кармане». Эффективность данного метода купирования пароксизмов ФП составила 92,0%. На фоне проводимой терапии контрольное наблюдение проводили каждые 4 месяца в течение 1 года.
Полученные результаты обрабатывали с помощью программы Statistica 13.3. Для каждой выборки вычисляли среднее арифметическое значение (M), среднее квадратичное отклонение (m). Вид распределения оценивали с помощью теста Колмогорова–Смирнова. При расчете статистической значимости в двух связанных группах использовали t-критерий Стьюдента, а в двух несвязанных группах – критерий Манна–Уитни. Для расчета независимых предикторов рецидивирования ФП использовали многофакторный анализ. Для оценки влияния показателей применяли ROC-анализ с площадью под кривой. Пороговые значения для количественных предикторов устанавливали на основе ROC-анализа при оптимальном соотношении чувствительности и специфичности. Различия считали статистически значимыми при р<0,05.
Результаты исследования и их обсуждение
Результаты терапии телмисартаном в группах обследуемых женщин представлены в таблице 1.
Таблица 1
Динамика электрофизиологических и гемодинамических показателей в исследуемых группах на фоне терапии телмисартаном
|
|
Репродуктивная стадия |
Менопаузальный переход |
Постменопауза |
||||||
|
Показатели |
Группа |
Исход |
Телмисартан |
Группа |
Исход |
Телмисартан |
Группа |
Исход |
Телмисартан |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
ВВПП, мс |
36,3±0,88 |
55,9±1,6 |
37,9±0,80 p2-3<0,001 |
39,3±0,48 |
60,1±1,7 |
40,8±0,79 p5-6<0,001 |
43,2±0,91 |
65,1±01,85 |
45,8±1,15 p8-9<0,001 |
|
ВВМПП, мс |
27,6±0,55 |
31,5±1,2 p1-2=0,005 |
28,2±0,58 p1-3=0,462 p2-3=0,017 |
30,8±0,63 |
35,2±0,73 p4-5=0,017 |
31,3±0,67 p4-6=0,612 p5-6=0,041 |
33,9±0,65 |
38,1±0,75 p7-8=0,006 |
34,9±0,59 p7-9=0,276 p8-9=0,028 |
|
ВВЛП, мс |
37,9±0,79 |
53,1±1,62 p1-2<0,001 |
38,1±0,94 p1-3=0,898 p2-3<0,001 |
40,1±1,02 |
57,0±1,72 p4-5<0,001 |
42,0±0,98 p4-6=0,284 p5-6<0,001 |
43,4±0,89 |
61,9±0,73 p7-8<0,001 |
47,8±1,23 p7-9=0,005 p8-9<0,001 |
|
ОВВ, мс |
100,5±1,78 |
138,7±4,2 p1-2<0,001 |
103,2±2,40 p1-3=0,372 p2-3<0,001 |
109,4±1,94 |
150,6±4,6 p4-5<0,001 |
114,1±2,1 p4-6=0,109 p5-6<0,001 |
122,2±2,0 |
159,6±4,9 p7-8<0,001 |
121,0±2,6 p7-9=0,901 p8-9<0,001 |
|
Индекс объема ЛП, мл/м2 |
25,8±1,15 |
29,4±1,4 |
24,8±1,03 p1-3=0,558 p2-3=0,009 |
30,1±0,68 |
33,3±1,2 p4-5=0,043 |
28,1±0,84 p4-6=0,078 p5-6=0,007 |
33,7±0,52 |
37,3±1,2 p7-8<0,001 |
32,7±0,55 p7-9=0,218 p8-9=0,001 |
|
ДПП, mmHg |
4,5±0,58 |
8,3±1,3 p1-2=0,042 |
4,8±0,69 p1-3=0,651 p2-3=0,046 |
4,7±0,057 |
5,6±0,195 p4-5<0,001 |
5,0±0,065 p4-6=0,081 p5-6=0,002 |
5,0±0,072 |
6,0±0,007 p7-8<0,001 |
5,3±0,080 p7-9=0,01 p8-9=0,001 |
|
ДЛП, mmHg |
6,1±0,124 |
12,4±3,2 p1-2=0,046 |
6,4±0,116 p1-3=0,125 p2-3=0,032 |
6,5±0,119 |
8,33±0,26 p4-5=0,045 |
6,7±0,105 p4-6=0,125 p5-6=0,042 |
6,8±0,11 |
8,7±0,273 p7-8<0,001 |
6,4±0,124 p7-9=0,011 p8-9<0,001 |
Примечание: ВВПП – время возбуждения правого предсердия; ВВМПП – время возбуждения межпредсердной перегородки; ВВЛП – время возбуждения левого предсердия; ОВВ – общее время возбуждения предсердий; ЛП – левое предсердие; ДПП – давление в правом предсердии; ДЛП – давление в левом предсердии.
На фоне терапии телмисартаном выявлены уменьшение количества пароксизмов ФП у 26 (32,5%), длительности ФП у 29 (36,3%) и трансформация симптомной ФП в бессимптомную у 18 (22,5%) женщин.
Анализ представленных данных показывает, что уменьшение количества ПФП связано с уменьшением давления и объема в предсердиях, а также с увеличением скорости проведения возбуждения по предсердиям.
В таблице 2 представлены результаты регрессионного анализа показателей ФП с электрофизиологическими и гемодинамическими показателями в исследуемых группах.
Таблица 2
Результаты проведенного регрессионного анализа в исследуемых группах
|
Показатели |
Количество ПФП у женщин |
Количество ПФП у женщин |
Количество ПФП у женщин |
||||||
|
Коэффициент множественной |
|
0,994 |
|
|
0,965 |
|
|
0,991 |
|
|
Коэффициент |
|
0,989 |
|
|
0,976 |
|
|
0,987 |
|
|
Значение критерия |
|
338,9 |
p<0,001 |
|
93,9 |
p<0,001 |
|
267,2 |
p<0,001 |
|
ВВПП, мс |
ß=–0,328 |
t=–1,3 |
p=0,2 |
ß=–1,601 |
t=3,7 |
p=0,001 |
ß=–1,027 |
t=–3,2 |
p=0,004 |
|
ВВМПП, мс |
ß=0,488 |
t=2,4 |
p=0,03 |
ß=0,198 |
t=0,9 |
p=0,353 |
ß=0,097 |
t=0,3 |
p=0,778 |
|
ВВЛП, мс |
ß=–0,126 |
t=–0,4 |
p=0,7 |
ß=0,367 |
t=0,7 |
p=0,479 |
ß=1,215 |
t=2,5 |
p=0,021 |
|
ОВВ, мс |
ß=0,488 |
t=1,7 |
p=0,1 |
ß=1,883 |
t=4,2 |
p=0,0003 |
ß=0,273 |
t=0,6 |
p=0,557 |
|
Индекс объема ЛП, |
ß=0,429 |
t=2,9 |
p=0,007 |
ß=0,527 |
t=2,2 |
p=0,036 |
ß=–0,059 |
t=–0,1 |
p=0,889 |
|
ДПП, mmHg |
ß=–0,223 |
t=–0,7 |
p=0,5 |
ß=–0,366 |
t=–1,3 |
p=0,189 |
ß=0,942 |
t=4,1 |
p=0,0003 |
|
ДЛП, mmHg |
ß=0,253 |
t=–0,8 |
p=0,4 |
ß=–0,142 |
t=–0,5 |
p=0,607 |
ß=–0,578 |
t=–1,7 |
p=0,101 |
Примечание: ВВПП – время возбуждения правого предсердия; ВВМПП – время возбуждения межпредсердной перегородки; ВВЛП – время возбуждения левого предсердия; ОВВ – общее время возбуждения предсердий; ЛП – левое предсердие; ДПП – давление в правом предсердии; ДЛП – давление в левом предсердии.
На основании результатов регрессионного анализа (табл. 2) можно заключить, что коэффициент множественной корреляции R у женщин второй группы в репродуктивной стадии равен 0,994, в менопаузальном переходе – 0,965, в постменопаузе – 0,991, коэффициент детерминации R2 – 0,989, 0,976, 0,987, значение критерия Фишера (F) – 338,9 (p<0,001), 93,9(p<0,001) и 267,2 (p<0,001) соответственно. Полученные данные указывают на тесную взаимосвязь и высокие доли в вариации ПФП гемодинамических и ЧпЭКГ-показателей, а также на адекватность регрессионной модели.
Полученные данные регрессии также свидетельствуют, что в репродуктивной стадии наибольшее значение для увеличения частоты пароксизмов ФП имеют ВПМП (ß=0,49, t=2,4 p=0,03) и индекс объема ЛП (ß=–0,43, t=–2,9 p=0,007), в менопаузальном переходе – ВППП (ß=–1,6, t=3,7, p=0,001), ОВВП (ß=1,8, t=4,2, p=0,0003) и индекс объема ЛП (ß=0,53, t=2,2 p=0,036), а в постменопаузе – ВППП (ß=–1,03, t=3,2, p=0,004), ВППП (ß=1,2, t=2,5, p=0,021) и ДПП (ß=0,94, t=4,1 p=0,0003).
В таблице 3 представлены данные ROC-анализа числа ПФП с ЧпЭКГ и гемодинамическими показателями у женщин второй группы в репродуктивной стадии.
Таблица 3
ROC-анализ ПФП с ЧпЭКГ и гемодинамическими показателями у женщин второй группы
|
Показатели |
Репродуктивная |
Менопаузальный переход |
Постменопауза |
||||
|
Число ПФП, в год |
Число ПФП, в год |
Число ПФП, в год |
|||||
|
|
|
ВВПП, мс |
|
ВВПП, мс |
|
ВВПП, мс |
|
|
ПЗ |
AUC |
>60,5 |
0,929 |
>64,5 |
0,937 |
>70,4 |
0,839 |
|
TPR |
FPR |
82,4 |
80,0 |
86,7 |
70,6 |
78,6 |
61,1 |
|
|
|
ВВМПП, мс |
|
ВВМПП, мс |
|
ВВМПП, мс |
|
|
ПЗ |
AUC |
>33,0 |
0,992 |
>36,5 |
0,973 |
>40,2 |
0,897 |
|
TPR |
FPR |
70,6 |
100,0 |
86,7 |
100,0 |
78,4 |
83,3 |
|
|
|
ВВЛП, мс |
|
ВВЛП, мс |
|
ВВЛП, мс |
|
|
ПЗ |
AUC |
>55,5 |
0,939 |
>63,2 |
0,953 |
>64,9 |
0,893 |
|
TPR |
FPR |
82,4 |
93,3 |
73,3 |
100,0 |
78,0 |
77,8 |
|
|
|
ОВВ, мс |
|
ОВВ, мс |
|
ОВВ, мс |
|
|
ПЗ |
AUC |
>143,5 |
0,941 |
>155,5 |
0,950 |
>165,0 |
0,905 |
|
TPR |
FPR |
82,1 |
80,0 |
86,7 |
82,4 |
78,6 |
61,1 |
|
|
|
Объем ЛП, индекс, мл/м2 |
|
Объем ЛП, индекс, мл/м2 |
|
Объем ЛП, индекс, мл/м2 |
|
|
ПЗ |
AUC |
>31,0 |
0,998 |
>33,5 |
0,978 |
>39,1 |
0,891 |
|
TPR |
FPR |
76,5 |
100,0 |
86,7 |
100,0 |
78,9 |
77,4 |
|
|
|
ДПП, mmHg |
|
ДПП, mmHg |
|
ДПП, mmHg |
|
|
ПЗ |
AUC |
>5,5 |
0,959 |
>5,6 |
0,908 |
>6,5 |
0,940 |
|
TPR |
FPR |
82,4 |
100,0 |
86,7 |
82,4 |
75,6 |
94,4 |
|
|
|
ДЛП, mmHg |
|
ДЛП, mmHg |
|
ДЛП, mmHg |
|
|
ПЗ |
AUC |
>8,5 |
0,941 |
>8,7 |
0,894 |
>9,2 |
0,889 |
|
TPR |
FPR |
88,2 |
100,0 |
86,7 |
76,5 |
78,3 |
77,8 |
Примечание: ВВПП – время возбуждения правого предсердия; ВВМПП – время возбуждения межпредсердной перегородки; ВВЛП – время возбуждения левого предсердия; ОВВ – общее время возбуждения предсердий; ЛП – левое предсердие; ДПП – давление в правом предсердии; ДЛП – давление в левом предсердии. ПЗ – пороговое значение, AUC – площадь под ROC-кривой, TPR – чувствительность, FPR – специфичность.
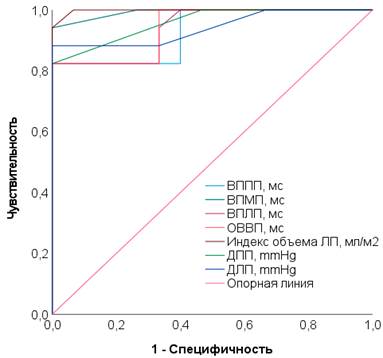
ROC-график, отражающий пороговый характер ЧпЭКГ и гемодинамических показателей сердца при применении телмисартана у женщин в репродуктивной стадии, представлен на рисунке 2.
|
|
|
Рис. 2. ROC-график, отражающий пороговый характер ЧпЭКГ и гемодинамических показателей сердца при применении телмисартана у женщин в репродуктивной стадии |
В репродуктивной стадии (табл. 3, рис. 2) анализ ЧпЭКГ показателей выявил, что увеличение ВВПП более 60,5 мс (TPR 82,4%, FPR 80,0%, AUC=0,929 (95%, ДИ 0,842–1,0, p<0,05)); ВВМПП – более 33,0 мс (TPR 70,6%, FPR 100,0%, AUC=0,992 (95% ДИ 0,971–1,0, p<0,05)); ВВЛП – более 55,5 мс (TPR 82,4%, FPR 93,3%, AUC=0,939 (95% ДИ 0,861–1,0, p<0,05)); ОВВ – более 143,5 мс (TPR 82,1%, FPR 80,0%, AUC=0,941 (95% ДИ 0,864–1,0, p<0,05)) прогнозируют ПФП. В результате оценки данных ЭхоКГ также установлено, что индекс объема ЛП более 31,5 мл/м2 (TPR 76,5%, FPR 100,0%, AUC=0,998 (95% ДИ 0,990–1,0, p<0,05)); ДПП – более 5,5 mmHg (TPR 82,4%, FPR 100,0%, AUC=0,959 (95% ДИ 0,898–1,0, p<0,05)); ДЛП – более 8,5 mmHg (TPR 88,2%, FPR 100,0%, AUC=0,941 (95% ДИ 0,856–1,0, p<0,05)) предвещают начало ПФП.
В таблице 3, на рисунке 3 представлены данные ROC-анализа числа ПФП с ЧпЭКГ и гемодинамическими показателями у женщин второй группы в менопаузальном переходе.
ROC-график, отражающий пороговый характер электрофизиологических и гемодинамических показателей сердца при применении телмисартана у женщин в менопаузальном переходе, представлен на рисунке 3.
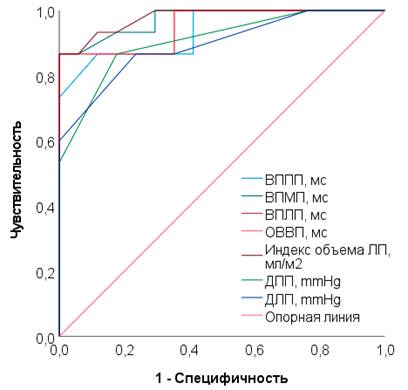
Рис. 3. ROC-график, отражающий пороговый характер электрофизиологических и гемодинамических показателей сердца при применении телмисартана у женщин в менопаузальном переходе
В менопаузальном переходе (табл. 3, рис. 3) анализ ЧпЭКГ показателей выявил, что увеличение ВВПП более 64,5 мс (TPR 86,7%, FPR 70,6%, AUC=0,937 (95%, ДИ 0,855–1,0, p<0,05)); ВВМПП – более 36,5 мс (TPR 86,7%, FPR 100,0%, AUC=0,973 (95% ДИ 0,925–1,0, p<0,05)); ВВЛП – более 63,2 мс (TPR 73,3%, FPR 100,0%, AUC=0,953 (95% ДИ 0,880–1,0, p<0,05)); ОВВ – более 155,5 мс (TPR 86,7%, FPR 82,4%, AUC=0,950 (95% ДИ 0,882–1,0, p<0,05)) позволяет ожидать возникновения ПФП. В результате оценки данных ЭхоКГ также установлено, что индекс объема ЛП более 33,5 мл/м2 (TPR 86,7%, FPR 100,0%, AUC=0,978 (95% ДИ 0,939–1,0, p<0,05)); ДПП – более 5,6 mmHg (TPR 86,7%, FPR 82,4%, AUC=0,908 (95% ДИ 0,804–1,0, p<0,05)); ДЛП – более 8,7 mmHg (TPR 86,7%, FPR 76,5%, AUC=0,894 (95% ДИ 0,781–1,0, p<0,05)) прогнозируют появление ПФП.
В таблице 3, на рисунке 4 представлены данные ROC-анализа числа ПФП с ЧпЭКГ и гемодинамическими показателями у женщин второй группы в постменопаузе.
ROC-график, отражающий пороговый характер электрофизиологических и гемодинамических показателей сердца при применении телмисартана у женщин в постменопаузе, представлен на рисунке 4.
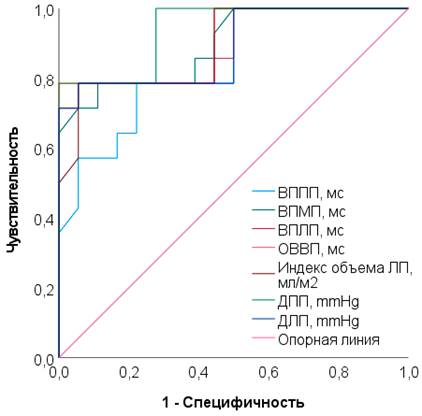
Рис. 4. ROC-график, отражающий пороговый характер электрофизиологических и гемодинамических показателей сердца при применении телмисартана у женщин в постменопаузе
В постменопаузе (табл. 3 рис. 4) анализ ЧпЭКГ-показателей выявил, что увеличение ВВПП более 70,4 мс (TPR 78,6%, FPR 61,1%, AUC=0,839 (95%, ДИ 0,703–0,976, p<0,05)); ВВМПП более 40,2 мс (TPR 78,4%, FPR 61,1%, AUC=0,897 (95% ДИ 0,786–1,0, p<0,05)); ВВЛП более 64,9 мс (TPR 78,0%, FPR 77,8%, AUC=0,893 (95% ДИ 0,775–1,0, p<0,05)); ОВВ более 165,0 мс (TPR 78,6%, FPR 61,1%, AUC=0,905 (95% ДИ 0,794–1,0, p<0,05)) предвещает начало ПФП. В результате оценки данных ЭхоКГ также установлено, что индекс объема ЛП более 39,1 мл/м2 (TPR 78,9%, FPR 77,4%, AUC=0,891 (95% ДИ 0,776–1,0, p<0,05)); ДПП более 6,5 mmHg (TPR 75,6%, FPR 94,4%, AUC=0,940 (95% ДИ 0,863–1,0, p<0,05)); ДЛП более 9,2 mmHg (TPR 78,3%, FPR 77,8%, AUC=0,889 (95% ДИ 0,767–1,0, p<0,05)) позволяют прогнозировать возникновение ПФП.
В настоящее время установлена тесная связь между уровнем давления в предсердиях и уровнем мозгового натрийуретического пептида (МНП) [18, 19]. Также выявлена взаимосвязь между давлением в предсердиях и МНП с фиброзом предсердий [20, 21]. Вероятно, рост концентрации МНП, повышение давления в предсердиях, увеличение площади фиброза способствуют аритмогенному ремоделированию предсердий. С учетом патогенетических механизмов возникновения и поддержания аритмии от терапии БРА следует ожидать значимо меньшую вероятность возникновения ФП.
Таким образом, на основании полученных данных установлено, что репродуктивное старение сопровождается увеличением внутрипредсердного давления и растяжением предсердий, что является аритмогенными субстратами возникновения и/или учащения ПФП. Антагонисты рецепторов ангиотензина-II снижают давление в предсердиях, что приводит к уменьшению их объема, укорочению времени проведения по предсердиям, в итоге уменьшаются число пароксизмов ФП и их продолжительность.
Выводы
1. У женщин на этапах репродуктивного старения выявлены электрокардиографические и гемодинамические субстраты аритмии при сочетании пароксизмов фибрилляции предсердий (ПФП) с рефрактерной к немедикаментозной терапии артериальной гипертензией I–II степени без поражения органов-мишеней. По результатам регрессионного анализа установлено влияние времени проведения возбуждения по предсердиям, объема предсердий и внутрипредсердного давления на частоту ПФП. По результатам ROC-анализа определены пороговые значения времени проведения возбуждения по предсердиям, объема предсердий и внутрипредсердного давления для увеличения частоты ПФП.
2. Лечение женщин с ПФП и рефрактерной к немедикаментозной терапии артериальной гипертензией I–II степени без поражения органов-мишеней телмисартаном является эффективным и безопасным. Препарат в результате увеличения скорости проведения возбуждения по предсердиям, уменьшения объема предсердий и внутрипредсердного давления приводит к уменьшению количества ПФП на 32,5%, длительности ПФП на 36,3% и трансформации симптомных ПФП в бессимптомные на 22,5%.
Библиографическая ссылка
Рахматуллов Р.Ф. ВЛИЯНИЕ БЛОКАТОРОВ РЕЦЕПТОРОВ АНГИОТЕНЗИНА II НА АРИТМОГЕННЫЕ СУБСТРАТЫ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ // Современные проблемы науки и образования. 2025. № 3. ;URL: https://science-education.ru/ru/article/view?id=34077 (дата обращения: 26.01.2026).
DOI: https://doi.org/10.17513/spno.34077