Введение
Метастатическое поражение головного мозга (МПГМ) является наиболее часто диагностируемой злокачественной патологией центральной нервной системы и фактором неблагоприятного прогноза [1, 2]. МПГМ встречается более чем у 2% всех онкологических больных, при этом наиболее часто – при раке легкого, раке молочной железы и меланоме [2, 3, 4]. В целом МПГМ развивается у 10–35% пациенток с прогрессирующим раком молочной железы [4, 5, 6]. Однако по мере улучшения показателей выживаемости ожидается, что это число будет увеличиваться. В среднем медианное время возникновения МПГМ составляет 2–3 года после первоначальной диагностики рака молочной железы [4, 7]. У пациенток с раком молочной железы выделяют три модели МПГМ: в первой модели мозг является начальным или единственным местом метастазирования, встречается у 10% женщин с диагнозом «метастатический рак молочной железы», медианное время до появления метастазов составляет около 12,8 месяца с момента первичной диагностики опухоли; во второй и третьей – мозг поражается наряду с метастатическим поражением других органов – в течение 1–2 лет или через 4–5 лет соответственно после первоначальной диагностики рака молочной железы [8]. Одиночные метастазы в головной мозг обнаруживаются примерно у 39% онкологических больных, что составляет 47% от всех случаев МПГМ. Множественные церебральные метастазы возникают примерно в 41–47% случаев [4].
Факторами риска развития МПГМ при раке молочной железы являются характеристики пациенток, включающие молодой возраст, этническую принадлежность, а также особенности опухоли: низкую степень дифференцировки, отсутствие рецепторов эстрогенов и прогестерона, наличие рецепторов эпидермального фактора роста 2 (HER2) и некоторые генетические особенности. HER2-положительный и трижды отрицательный рак молочной железы (TNBC) чаще метастазирует в головной мозг, чем люминальный рак молочной железы [9, 10]. Наличие МПГМ связано с уменьшением выживаемости и снижением качества жизни больных раком молочной железы [11].
Несмотря на совершенствование передовых методов лечения, таких как хирургическое вмешательство, лучевая терапия, химиотерапия и таргетная терапия, продолжительность жизни при МПГМ составляет в среднем от 1,0 года до 2,0 лет после постановки диагноза [8, 12]. Тем не менее, метастатический рак молочной железы – это заболевание, которое можно лечить, и основными целями лечения являются увеличение продолжительности жизни пациенток и управление симптомами при минимизации побочных эффектов, связанных с лечением, для сохранения или улучшения качества жизни женщин [13]. Все вышесказанное объясняет необходимость совершенствования подходов и разработки новых стратегий в лечении МПГМ, контроля их эффективности с учетом не только динамики опухолевого процесса, но и состояния больного.
Дистанционная лучевая терапия (ДЛТ) являлась стандартом лучевого лечения для всех пациентов с МПГМ в конце XX – начале XXI веков, обеспечивая дополнительный контроль опухолевого роста после радикального хирургического удаления церебральных метастазов, и подразумевала облучение всего головного мозга [7, 8, 14]. Однако в ряде случаев от нее начали отходить, отдавая предпочтение другим, более эффективным методам лучевого воздействия, которые, к тому же, не ухудшали качество жизни пациентов. В качестве альтернативы ДЛТ были разработаны методы стереотаксической лучевой терапии, одним из которых является стереотаксическая радиотерапия (СРТ), которая так же, как и ДЛТ, проводится после хирургического удаления МПГМ, но при этом учитывает изменяющиеся объемы метастатической опухоли и размеры перифокального отека тканей мозга по данным магнитно-резонансной томографии (МРТ) на этапах облучения. К положительным сторонам СРТ можно отнести и более четкую фокусировку луча, что позволило снизить проявления нейротоксичности, развивающиеся при облучении всего головного мозга [7, 10, 15]. Этот тип лучевого воздействия предполагает применение умеренно дозированных фракций: 20 Гр за 2 фракции, 24–27 Гр за 3 фракции, 25–40 Гр за 5 фракций [14].
Еще одним методом стереотаксической лучевой терапии МПГМ является стереотаксическая радиохирургия (СРХ), которая применяется чаще всего при олигометастатических поражениях головного мозга. СРХ точно и концентрированно за счет использования нескольких хорошо коллимированных пучков радиации для нацеливания на определенные области мозга доставляет высокую дозу облучения в зону интереса – однократная фракция высококонформного лечения высокой дозой обычно составляет 18–24 Гр [14]. СРХ может использоваться как после проведения радикальной операции (при условии радикального удаления 1–2 очагов), так и при невозможности ее выполнения (при наличии 1–4 и более нерезецированных очагов) [8].
Однако и СРХ в ряде случаев не может помочь пациентам с МПГМ, например тогда, когда метастатические опухоли имеют очень крупные размеры (более 3 см в диаметре) и/или располагаются близко к критически важным зонам головного мозга, из-за высокого риска их повреждения. Поэтому в настоящее время начинают разрабатывать и внедрять методики стажированной (этапной) радиохирургии (ССРХ). Так, авторами данной статьи был разработан способ ССРХ в отношении МПГМ. Данный способ лучевого воздействия позволяет подвести высокую разовую дозу радиации (РОД) – 10 Гр – к церебральному метастатическому очагу размером более 3 см в 3 этапа (при этом суммарная доза (СОД) облучения составляет 30 Гр) и тем самым добиться хорошего локального контроля МПГМ при минимальной лучевой нагрузке на немалигнизированные ткани мозга [16].
Цель исследования – представить результат клинического наблюдения за пациентом женского пола с крупным метастазом головного мозга при проведении стажированной радиохирургии в 3 этапа.
Материал и методы исследования Пациент Ж., женского пола, 66 лет, находился на лечении в отделении радиотерапии № 2 ФГБУ «НМИЦ онкологии» Минздрава России с 14.05.2024 по 15.05.2024 по поводу рака левой молочной железы, cT2N1M0 (состояние после комплексного лечения), прогрессирование, метастатическое поражение головного мозга, стадия 2, клиническая группа 2. Протокол исследования был подготовлен в соответствии с этическими стандартами Декларации Хельсинки [C1](1964 г., в редакции 2013 г.) и одобрен этическим комитетом при ФГБУ «НМИЦ онкологии» Минздрава России (Протокол № 27 от 09.09.2022 г.). Предварительно у пациента было получено информированное согласие на проведение ССРХ по поводу метастатического поражения головного мозга и обработку персональных данных, а также публикацию материалов статьи.
МРТ-исследование исходно проводили на томографе General Electric SIGNA 1.5 ТHDт. Топометрическую топографию на этапах ССРХ выполняли с помощью компьютерного томографа Siemens Somatom Definition. МРТ-исследование головного мозга выполняли с внутривенным контрастным усилением в режиме 3D BRAVO. Для установления рентгенконтрастных меток и определения изоцентра использовали систему лазерной навигации LAP Laser. Обработку предварительной топометрии осуществляли на станции виртуальной симуляции Singo Via. Сегментирование проводили с помощью программного обеспечения Elements (BrainLab). Облучение МПГМ осуществляли на линейном ускорителе Novalis Tx Varian. Для уменьшения побочных проявлений в виде перифокального отека тканей мозга в зоне облучения до проведения лучевого воздействия и сразу после его окончания на каждом этапе ССРХ пациенту внутримышечно вводили дексаметазон в разовой дозе 4,0 мг/мл. Таким образом, за курс ССРХ было выполнено 6 введений дексаметазона. Оценка клинических данных была реализована с помощью шкалы Карновского и рекомендаций [17].
Результаты исследования и их обсуждение
На профилактическом осмотре в 2023 году пациенту женского пола Ж. был поставлен предварительный диагноз: злокачественное новообразование левой молочной железы. Пациент женского пола Ж. обследована онкологом по месту жительства, где на маммографии от 21.04.2023 г. было выявлено объемное образование левой молочной железы BI-RADS4C. Данные спиральной компьютерной томографии (СРКТ) от 27.04.2023 г. подтвердили наличие солидного образования левой молочной железы и аденопатию многочисленных лимфатических узлов левой аксиллярной области. Гистологический анализ препарата опухоли, полученного при трепанбиопсии от 02.05.2023 г., определил инвазивную карциному неспецифического типа G2. В ходе иммуногистохимического анализа опухолевой ткани были установлены отсутствие экспрессии рецепторов эстрадиола, прогестерона и наличие экспрессии HER2 и Ki67 (60%). Цитологический анализ аксиллярного лимфоузла слева выявил метастаз низкодифференцированной карциномы. Был поставлен диагноз: рак левой молочной железы, cT2N1M0, стадия 2, клиническая группа 2. По решению консилиума ФГБУ «НМИЦ онкологии» Минздрава России от 30.05.2023 г. рекомендовано госпитализировать пациента и провести комплексное лечение.
Первым этапом лечения (с 01.06.2023 г. по 25.10.2023 г.) пациенту женского пола Ж. проведено 8 курсов неоадъювантной химиотерапии (НАПХТ) по схеме АС: доксорубицин 60 мг/м2 и циклофосфамид 600 мг/м2 внутривенно 4 курса и 4 курса доцетаксел 75мг/м2 внутривенно капельно. С учетом статуса HER2+ химиотерапия проведена с таксанами: препаратами трастузумаб 6 мг/кг и пертузумаб 420 мг. Вторым этапом (11.11.2023 г.) выполнена радикальная мастэктомия по Маддену слева. Третьим этапом (с 29.11.2023 г. по 25.12.2023 г.) проведен курс адъювантной лучевой терапии на пути регионарных лимфоузлов в курсовой дозе облучения 50 Гр. Пациент женского пола Ж. был выписан под наблюдение онколога по месту жительства, где продолжил курс таргетной терапии.
С 05.03.2024 г. у пациента женского пола появились жалобы на головокружение, шаткость походки, онемение конечностей, тремор рук. Районным онкологом была рекомендована консультация в ФГБУ «НМИЦ онкологии» Минздрава России, где при проведении МРТ-исследования головного мозга 11.03.2024 г. обнаружен крупный – более 3 см3 – солитарный солидный метастатический очаг в левой лобной области на уровне прецентральной извилины конвекситально (рис. 1). До начала ССРХ бóльшую часть времени пациент женского пола Ж. проводил в постели, ему были необходимы специальный уход и посторонняя помощь – оценка тяжести состояния пациента по шкале Карновского составила 40%. Консилиумом врачей по определению дальнейшей тактики лечения пациента Ж. в составе нейрохирурга, радиотерапевта и химиотерапевта рекомендовано проведение ССРХ на метастатический очаг головного мозга.
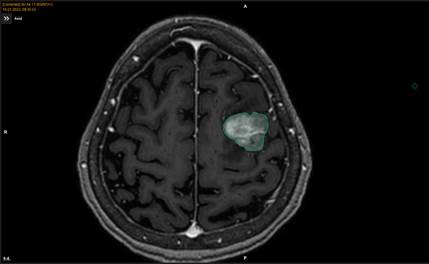 |
Рис. 1. Данные МРТ-исследования пациента женского пола Ж. перед началом ССРХ, объем метастаза составил 12,6 см3
09.05.2024 г. проведена предварительная топометрическая подготовка: изготовлено индивидуальное фиксирующее устройство – трехслойная термопластическая маска для ССРХ, установлены рентгенконтрастные метки и определен изоцентр, выполнена топометрическая томография, эффективная доза за исследование составила 3,7 мЗв. Выполнена обработка предварительной топометрии, произведено сегментирование. Контуры клинически определяемой метастатической опухоли головного мозга (gross tumor volume, GTV) определяли на основании данных МРТ головного мозга с контрастным усилением в трехмерном режиме по данным T1 контрастных и FLAIR режимов. Отступ от GTV для клинического объема мишени (clinical target volume, CTV) составлял 1 см, отступ от CTV для планируемого объема мишени (planning target volume, PTV) был 0,1 см. Первоначальный топометрический план лучевого лечения для пациента женского пола Ж. представлен на рисунке 2.
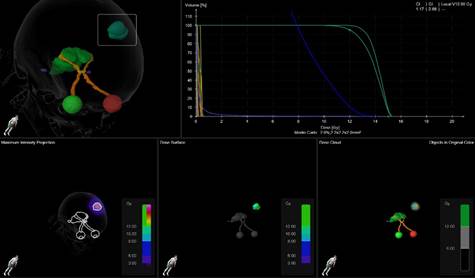
Рис. 2. Первоначальный топометрический план ССРХ крупного солитарного метастаза рака молочной железы в правой лобной доле головного мозга пациента женского пола Ж.
14.05.2024 г. проведен первый сеанс ССРХ на метастатический очаг головного мозга РОД 10 Гр, СОД 10 Гр. Следующее МРТ-исследование головного мозга было выполнено через 14 дней после первого сеанса лучевой терапии с целью контроля эффективности методики. Отмечено почти двукратное сокращение объема метастатического образования головного мозга – с 12,6 см3 до 6,76 см3 (рис. 3). Клинически отмечалось улучшение состояния пациента Ж. – он не нуждался в посторонней помощи и мог обслуживать себя сам, оценка по шкале Карновского составила 60%.
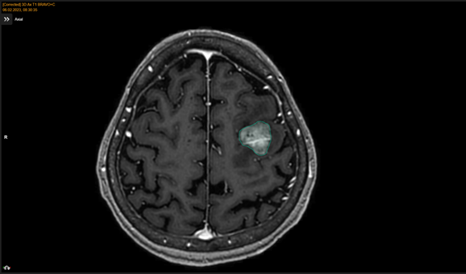
Рис. 3. Данные МРТ-исследования пациента женского пола Ж. перед вторым этапом ССРХ
31.05.2024 г. проведен второй сеанс ССРХ на метастатический очаг, с коррекцией фокусировки луча в связи с изменившимися целевыми объемами, РОД 10 Гр, СОД 10 Гр. На контрольном МРТ-исследовании головного мозга, проведенном через 2 недели после второго сеанса ССРХ, установлено сокращение объема метастатической опухоли до 4,01 см3, что было в 3,1 раза меньше ее первоначального объема (рис. 4).
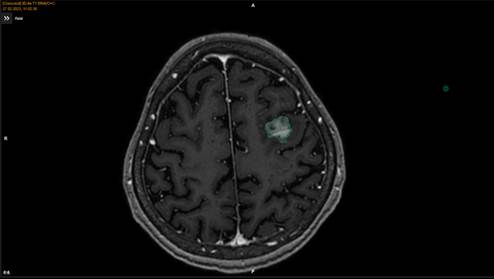
Рис. 4. Данные МРТ-исследования пациента женского пола Ж. перед третьим этапом ССРХ
Клинически отмечалось улучшение состояния пациента женского пола Ж. в виде уменьшения ранее предъявляемых жалоб, улучшения настроения, увеличения бытовой активности, однако сохранялась слабость, физическая нагрузка давалась с трудом, что по шкале Карновского было оценено в 70%. 15.06.2024 г. проведен третий сеанс ССРХ на метастатический очаг головного мозга, с коррекцией фокусировки луча на изменившиеся целевые объемы, РОД 10 Гр, СОД 10 Гр. Пациента женского пола выписали из стационара на 2-е сутки после 3-го этапа облучения с уменьшением неврологического дефицита: цефалгии, тошноты, шаткости походки, головокружения, онемения конечностей и тремора рук.
Через 3 месяца (15.09.2024 г.) после окончания ССРХ пациент женского пола Ж. поступил в ФГБУ «НМИЦ онкологии» Минздрава России на контрольное обследование. При выполнении МРТ-исследования отмечено сокращение объема метастатического очага в головном мозге до 2,6 см3, что было в 4,9 раза меньше первоначального объема метастаза до лучевого лечения. Иными словами, первоначальный объем метастатической опухоли уменьшился на 81,2% (рис. 5).
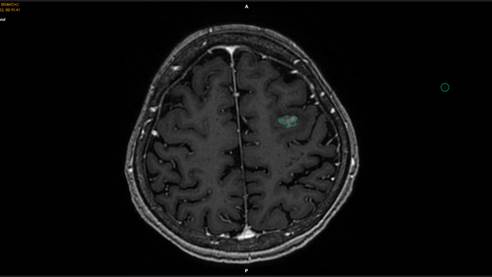
Рис. 5. Данные контрольного МРТ-исследования пациента женского пола Ж. через 3 месяца после окончания ССРХ
В настоящее время пациент женского пола Ж. находится под динамическим наблюдением. Оценка по шкале Карновского по-прежнему составляет 70%. При выписке: общее состояние относительно удовлетворительное: сознание ясное, контакт и ориентация во времени и в пространстве не нарушены, критика к своему состоянию сохранена, эмоционально лабильна. Курсы таргетной терапии выполняются по месту жительства по схеме: трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) в 1-й день совместно с препаратом пертузумаб 420 мг (нагрузочная доза 840 мг) внутривенно в день 1 раз в 3 недели. Данных за прогрессирование заболевания на данный момент не выявлено.
Заключение
По сравнению со стандартными методами лечения ССРХ имеет тенденцию к раннему купированию клинической симптоматики и выраженному противоопухолевому эффекту при наличии МПГМ, а также позволяет контролировать изменение целевых объемов облучения. Таким образом, описан случай эффективного применения методики ССРХ крупного неоперабельного церебрального метастаза, который показывает целесообразность использования такого лучевого воздействия и перспективность дальнейших исследований в плане усовершенствования вариантов конформной лучевой терапии метастатического поражения головного мозга размером более 3 см.
Библиографическая ссылка
Бабасинов А.А., Каплиева И.В., Власов С.Г., Сакун П.Г., Розенко Л.Я., Вошедский В.И., Казьменкова Э.М., Лесной М.Н., Горошинская И.А. СТАЖИРОВАННАЯ РАДИОХИРУРГИЯ – УСПЕШНЫЙ МЕТОД ЛЕЧЕНИЯ КРУПНЫХ МЕТАСТАЗОВ ГОЛОВНОГО МОЗГА (ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ) // Современные проблемы науки и образования. 2025. № 2. ;URL: https://science-education.ru/ru/article/view?id=34046 (дата обращения: 12.02.2026).
DOI: https://doi.org/10.17513/spno.34046



