Введение
Феномен нарушения целостности эпителиального барьера детально описан в принятом в 2021 году в России первом мультидисциплинарном национальном консенсуcе «Синдром повышенной эпителиальной проницаемости в клинической практике» [1]. Повреждения и нарушение целостности эпителиальных тканей делают возможным проникновение в кровоток антигенных субстанций микробного и пищевого происхождения, что способно вызывать воспалительные реакции – как местные, так и системного характера, а также аллергические реакции.
Любое заболевание органов пищеварения сопровождается нарушением его моторной или секреторной функции, влечет за собой нарушение выработки или своевременности поступления ферментов в процессе пищеварения. В норме последовательный ферментативный процесс ведет к расщеплению полимерных соединений пищевого комка до мономерных фрагментов, элементарных частиц (аминокислот, жирных кислот, моносахаров), лишенных антигенных свойств. Особенно значимые нарушения наступают при анацидных и гипоацидных гастритах, снижении функции поджелудочной железы, вследствие чего изменяются процессы переработки пищевого субстрата до мономеров и деструкции антигенных эпитопов пищеварительными ферментами, что увеличивает размер и соответственно патогенность пищевых антигенов [2]. При желудочно-кишечных заболеваниях страдают все звенья защитного эпителиального барьера и его регуляторные функции, что может приводить к нарушению его проницаемости и одномоментному поступлению большого количества пищевых и бактериальных антигенов из просвета кишечника во внутреннюю среду макроорганизма. Следствием повышенной проницаемости слизистой желудочно-кишечного тракта для макромолекул является развитие поливалентной пищевой сенсибилизации [3, с. 101–107].
Важным является то, что при заболеваниях желудочно-кишечного тракта достаточно часто встречаются и «псевдоаллергические» реакции, обусловленные, вероятно, снижением дезактивационной функции желудочно-кишечного тракта по отношению к некоторым биологически активным веществам (БАВ), избыточным их поступлением с пищевыми продуктами и избыточным эндогенным продуцированием путем синтеза тирамина кишечной флорой вследствие суперинфекции, что может влиять на течение болезни. Этот фактор был учтен авторами при составлении гипоаллергенных диет [4].
В связи с широкой распространенностью болезней органов пищеварения непрерывно растущая частота регистрации пищевой аллергии среди детей и взрослых является прогнозируемой.
Иммуногенность аллергенных протеинов определяется размером белка и способностью преодолевать барьер слизистой оболочки кишечника. Таким образом, степень пищевой сенсибилизации будет больше при значимых повреждениях слизистой оболочки, пропускающих более крупные молекулы, обладающие большей иммуногенностью, что может предполагать более выраженные степень и спектр пищевой иммунизации у больных язвенным колитом (ЯК) [5]. Выделяют системные и локальные аллергические реакции. Системные аллергические реакции на пищу протекают с преимущественным поражением различных органов и систем, нередко имеют неспецифический характер и могут проявляться симптомами острых и хронических заболеваний органов пищеварения, что часто недооценивается в клинической практике.
Выдвинута гипотеза о возможности воздействия на иммунопатологические механизмы хронических болезней органов пищеварения с хроническим воспалительным синдромом путем элиминации из диет пациентов пищевых антигенов, вызывающих реакции гиперчувствительности.
Исследование является актуальным в связи с тем, что в литературных источниках отсутствуют конкретные диетические рекомендации для этой группы больных.
Цель исследования
Предложить новый принцип составления диет для больных с ЯК, учитывающий патогенетические (иммунопатологические) механизмы болезни, основанный на комплексном подходе к диагностике пищевой сенсибилизации.
Материалы и методы исследования
Проведено обследование 60 пациентов с ЯК, обратившихся за амбулаторным лечением в Центральную поликлинику ФГБУ СЗОНКЦ им. Л.Г. Соколова ФМБА России. Сформированы две группы пациентов: основная и сравнения, по 30 человек в каждой, которые получали различную диетическую терапию.
Средний возраст пациентов основной группы – 25,07±6,49 года; мужчин – 12 (40%), женщин – 18 (60%). 80% пациентов (24 человека) имели стаж болезни от 6 месяцев до 3 лет, у 5 пациентов (17%) стаж болезни от 3 до 4 лет, у 3% (1 пациента) стаж болезни составил более 5 лет. Все пациенты имели как минимум 1 рецидив заболевания. По распространенности, согласно Монреальской классификации, ЯК составлял [6, с. 7]: левосторонний колит зарегистрирован у 24 пациентов (80,0%), проктит – у 2 (6,7%), тотальный колит – у 4 пациентов (13,3%). По степени тяжести обострения согласно критериям Truelove-Witts больные распределились следующим образом: легкая степень – у 17 пациентов (56,7%), средней степени тяжести – у 13 пациентов (43,3%). Пациенты, обратившиеся с тяжелым обострением, направлялись на госпитализацию.
Средний возраст пациентов группы сравнения составил 24,7±6,3 года; мужчин – 10 (33,5%), женщин – 20 (66,5%). В группе сравнения 19 пациентов (63%) имели обострение легкой степени тяжести, 11 пациентов (37%) – средней степени тяжести. По протяженности – проктит зарегистрирован у 4 человек (14%), левосторонний колит – у 25 человек (83%), у 1 человека (3%) – тотальный колит.
Две группы пациентов с ЯК, сопоставимые по полу, возрасту и характеру заболевания, получали стандартную медикаментозную терапию согласно клиническим рекомендациям [6, с.16–23]. Различия касались диетического лечения. В данном исследовании основной группе пациентов с ЯК в период обострения была назначена индивидуальная специфическая элиминационная гипоаллергенная диета (ИСЭГ-диета), подобранная лабораторным способом. Группа сравнения получала вариант стандартной диеты с механическим и химическим щажением [7].
Для формирования ИСЭГ-диет проводилась диагностика причинно-значимых аллергенов комбинированной лабораторной методикой, позволяющей определить наибольшее число реакций иммунной системы на каждый конкретный пищевой антиген. Для этого использовали усовершенствованный метод РТМЛ (реакция торможения миграции лейкоцитов) Н.Н. Матышевой и Л.С. Косицкой, регистрирующий миграционную активность клеток и образование циркулирующих иммунных комплексов с пищевыми антигенами [8], а также дополнительно регистрировали образование специфических антител методом иммуноферментного анализа (определение иммуноглобулинов E специфических). Этот комплексный подход дает возможность учесть иммунопатологические реакции I, III и IV типов, то есть выявить наиболее полный спектр потенциальных пищевых антигенов и использовать полученные данные для составления индивидуальной специфической гипоаллергенной диеты. Изучение спектра и степени пищевой сенсибилизации у больных ЯК выявило статистически значимое преобладание у них IV типа реакций гиперчувствительности (гиперчувствительность замедленного типа) [9].
Осмотры пациентов с ЯК проводили каждые 2 недели при наличии симптомов обострения, при отсутствии симптомов – каждые 3 месяца в первый год наблюдения, затем – каждые 6 месяцев обязательно и дополнительно по желанию.
При появлении симптомов обострения заболевания у пациентов оценивали жалобы (частоту стула, наличие гематохезии, болей в животе, учащение симптомов диспепсии), определяли вес пациентов и выполняли общеклинические лабораторные исследования по стандартным методикам (клинический анализ крови, С-реактивный белок высокочувствительный, фекальный кальпротектин). Для подтверждения обострения заболевания пациентам выполняли фиброколоноскопию. Оценку эндоскопической активности ЯК проводили с использованием признаков шкалы Schroeder [6, с. 9]. Эндоскопическую ремиссию регистрировали при отсутствии контактной кровоточивости, отсутствии язвенных дефектов, эрозий и активной гиперемии (заживление слизистой).
Эффективность диетических мероприятий в профилактике обострений ЯК изучали в течение 4 лет.
Принципы формирования ИСЭГ-диеты заключались в исключении из рациона питания тех продуктов, на антигены которых при обследовании была выявлена хотя бы одна иммунная реакция (выявлена положительной одна и более из трех определяемых реакций гиперчувствительности I, III и/или IV типов). Рацион должен быть составлен только из проверенных продуктов (в среднем проверялась гиперчувствительность к 50 промышленным пищевым аллергенам). Дополнительно всем пациентам рекомендовали исключить из питания все возможные непищевые аллергены, поступающие вместе с продуктами питания (консерванты, красители, Е-добавки). Указанные субстраты не имеют физиологической ценности, в то же время могут являться аллергенами (гаптенами) или вызывать псевдоаллергические реакции, сопровождающиеся выделением медиаторов воспаления. Устранение непищевых аллергенов сделало используемую элиминационную диету максимально гипоаллергенной (иммунологически щадящей).
При назначении гипоаллергенной диетотерапии учитывали калорийность назначенных продуктов и содержание в них необходимых витаминов, макро- и микроэлементов для формирования полноценного рациона. Учитывали состояние больных: вес пациентов, наличие диареи, белково-калорийной недостаточности, стадию, локализацию заболевания, фазу процесса (обострение или ремиссия). С учетом выявленных факторов пациенту давали рекомендации о необходимости химической и механической обработки пищи [10, c. 550].
В периоде ремиссии пациенты основной группы использовали только ИСЭГ-диету, разрешалось употреблять пищевые продукты без дополнительной термической и механической обработки. Больные могли применять в питании и известные потенциальные аллергены, если они не реализовывали положительные специфические реакции при исследовании у данного конкретного больного (шоколад, клубнику, рыбу, цитрусовые и др.). Пациенты группы сравнения в период ремиссии использовали основной вариант стандартной диеты системы стандартных диет.
В случае необходимости исключения из диеты по результатам тестирования большого количества продуктов пациенту предлагали дополнительный перечень антигенов для исследования, что позволяло включать в рацион новые продукты (всего в списке 120 промышленных аллергенов). Таким образом, пациенты получали сбалансированное по химическому составу и энергетической ценности питание, без ухудшения качества их жизни.
На метод лечения болезней органов пищеварения ИСЭГ-диетой получен патент Российской Федерации [11].
Сравнения двух групп по количественным шкалам проводили на основе непараметрического критерия Манна–Уитни. Статистическую значимость различных значений для бинарных и номинальных показателей определяли с использованием критерия Хи-квадрат Пирсона. Уровень статистической значимости был зафиксирован на уровне р<0,05.
Результаты исследования и их обсуждение
Анализ эффективности ИСЭГ-диеты в профилактике обострений заболевания проведен путем сравнения клинических и лабораторных показателей у пациентов основной группы и группы сравнения. Ранее была продемонстрирована эффективность ИСЭГ-диеты в индукции клинико-лабораторной и эндоскопической ремиссии [12].
По итогам исследования получены данные о частоте случаев обострений заболевания у пациентов обеих групп и числе пациентов, имеющих и не имеющих обострений заболевания в течение всего периода наблюдения. Данные представлены в таблице 1.
Таблица 1
Частота обострений ЯК у пациентов основной группы и группы сравнения за период наблюдения 4 года
|
Период |
Показатель |
Основная группа n=30 |
Группа сравнения n=30 |
Уровень р |
||
|
абс. |
% |
абс. |
% |
|||
|
1-й год наблюдения |
Число случаев обострения |
1 |
3 |
24 |
80 |
<0,0001 |
|
2-й год наблюдения |
Число случаев обострения |
2 |
7 |
25 |
83 |
<0,0001 |
|
3-й год наблюдения |
Число случаев обострения |
2 |
7 |
24 |
80 |
<0,0001 |
|
4-й год наблюдения |
Число случаев обострения |
1 |
3 |
24 |
80 |
<0,0001 |
|
1–4-й год |
Число случаев обострения в группе |
6 |
- |
97 |
- |
<0,0001 |
|
1–4-й год |
Количество пациентов, имеющих обострения |
3 |
10 |
30 |
100 |
<0,0001 |
|
1–4-й год |
Количество пациентов, имеющих обострения при соблюдении диеты |
1 |
3 |
30 |
100 |
<0,0001 |
|
1–4-й год |
Количество пациентов, не имеющих обострений за период наблюдения |
27 |
90 |
0 |
0 |
<0,0001 |
В таблице 2 представлен анализ числа обострений в группах в пересчете на одного пациента в течение всего периода исследования.
Таблица 2
Число обострений на 1 человека за период наблюдения 4 года
|
|
Основная группа n=30 |
Группа сравнения n=30 |
|
Среднее число обострений на 1 человека за период наблюдения 4 года |
0,2 |
3,2 |
|
Абсолютное число обострений в группе за 4 года наблюдения |
6 |
97 |
Анализ данных показал, что в основной группе пациентов с ЯК, получающих ИСЭГ-диету, зарегистрировано всего 6 обострений у 10% пациентов (3 человека), при этом в группе сравнения обострения (одно или более) были зарегистрированы у всех 30 (100%) пациентов.
Одним из наиболее информативных лабораторных показателей, подтверждающих эффективность проводимого лечения, является фекальный кальпротектин, динамика которого представлена в таблице 3.
Таблица 3
Динамика средних значений фекального кальпротектина в группах сравнения
за 4 года наблюдения, мкг/г
|
Период |
Показатель |
Основная группа (n=30), m±s |
Группа сравнения (n=30), m±s |
Уровень p* |
|
Первое обращение |
Фекальный кальпротектин |
702,2±101,7 |
629,2±87,9 |
0,0017 |
|
1-й год наблюдения |
Фекальный кальпротектин |
262,8±84,0 (–62,6%) |
530,9±141,9 (–15,6%) |
<0,0001 |
|
2-й год наблюдения |
Фекальный кальпротектин |
186,4±147,7 (–73,5%) |
424,1±110,4 (–32,6%) |
<0,0001 |
|
3-й год наблюдения |
Фекальный кальпротектин |
86,0±46,6 (–87,8%) |
465,0±172,7 (–26,0%) |
<0,0001 |
|
4-й год наблюдения |
Фекальный кальпротектин |
46,1±31,3 (–93,4%) |
296,7±139,8 (–52,8%) |
<0,0001 |
Высокие показатели средних значений фекального кальпротектина на протяжении всего исследования в группе сравнения обусловлены частыми обострениями заболевания. В связи с длительной ремиссией у пациентов основной группы показатели фекального кальпротектина постепенно снижаются (максимально к 4-му году наблюдения) и с 3-го года наблюдения не превышают референсных значений (30–100 мкг/г).
Динамика восстановления и стабилизации показателей фекального кальпротектина в зависимости от тяжести обострений и протяженности процесса наглядно представлена на диаграммах (рис. 1 и 2).
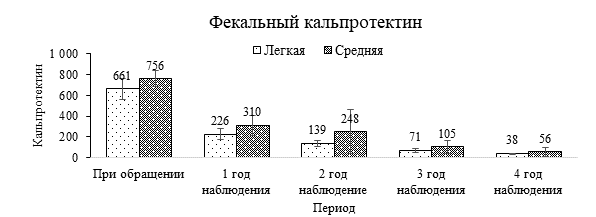
Рис. 1. Динамика показателей фекального кальпротектина в зависимости от степени тяжести в основной группе, мкг/г
Анализ показателей фекального кальпротектина в зависимости от степени тяжести у пациентов основной группы показал, что при обращении уровни кальпротектина пропорциональны степени тяжести (у пациентов средней степени тяжести статистически значимо превышают показатели кальпротектина у пациентов легкой степени (р<0,05)). Снижение значений на фоне лечения к концу исследования происходит равномерно у пациентов как с легкой, так и со средней степенью тяжести, и к 4-му году наблюдения показатели достигли референсных значений в обеих группах.

Рис. 2. Динамика показателей фекального кальпротектина в зависимости от протяженности процесса в основной группе, мкг/г
Диаграмма демонстрирует, что значения фекального кальпротектина пропорциональны протяженности процесса и снижаются равномерно к 4-му году наблюдения.
Заключение
В результате данного исследования были предложены новые принципы диетотерапии у пациентов с язвенным колитом, основанные на комплексном подходе к диагностике пищевой сенсибилизации. Исключение из рационов питания этих пациентов пищевых антигенов, вызывающих реакции гиперчувствительности, способствует индукции и поддержанию ремиссии заболевания. Представленные данные подтверждают эффективность диетических мероприятий в профилактике обострений язвенного колита легкой и средней степени тяжести.
Библиографическая ссылка
Крюкова О.А., Дрыгин А.Н., Симутис И.С. ПРИНЦИПЫ ПРИМЕНЕНИЯ И ЭФФЕКТИВНОСТЬ ИНДИВИДУАЛЬНЫХ ГИПОАЛЛЕРГЕННЫХ ДИЕТ В ПРОФИЛАКТИКЕ ОБОСТРЕНИЙ ЗАБОЛЕВАНИЙ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА НА ПРИМЕРЕ ЯЗВЕННОГО КОЛИТА // Современные проблемы науки и образования. 2025. № 2. ;URL: https://science-education.ru/ru/article/view?id=34013 (дата обращения: 06.03.2026).
DOI: https://doi.org/10.17513/spno.34013



