Введение
В последние десятилетия наблюдается неуклонный рост заболеваемости раком эндометрия (РЭ) [1], остающимся одной из лидирующих онкологических патологий и характеризующимся высоким приростом абсолютного числа пациенток (15,6%) за последние 5 лет [2]. В 2021 г. было выявлено 25 482 случая заболевания раком тела матки (РТМ). «Грубый» показатель заболеваемости в 2021 г. составил 32,62 cлучая на 100 тыс. женского населения. За 10 лет этот показатель вырос на 21,93%, средний темп прироста составил около 1,96% в год [3].
Общепризнанными факторами прогноза течения РЭ на текущий момент являются стадия заболевания, морфологические варианты опухоли, наличие лимфоваскулярной инвазии [2, 4]. При этом у пациенток с одинаковыми морфологическими формами РЭ могут быть достигнуты разные результаты лечения, что определяет важность прогнозирования исхода заболевания [2].
В связи с ростом заболеваемости остается актуальным вопрос о наличии иммунных предикторов, а также непосредственно об особенностях локального иммунитета опухоли, ее микроокружения. Известно, что основную роль в обеспечении нормального иммунного ответа, в частности в контроле за пролиферацией клеток, играет, с одной стороны, триада иммуноцитов (макрофаги, NK-клетки, антигенспецифические эффекторные Т-лимфоциты), а с другой – гуморальные факторы иммунитета (специфические антитела, IL-1, IL-2, фактор некроза опухоли, интерфероны) [5, 6]. Однако в случае развития опухоли на первый план выступают так называемые факторы иммунорезистентности, которые позволяют опухоли ускользать от иммунного надзора [7]. Несмотря на множество различных исследований, имеются ограниченные доклинические и клинические данные о функции иммунных клеток как в нормальном, так и в опухолево-измененном эндометрии. Так, в некоторых исследованиях авторы прослеживают взаимосвязь клеточного состава Т-клеток нормального эндометрия с фазой менструального цикла, связывая данные различия с влиянием прогестерона и эстрогенов на иммунные клетки [8].
Значимость иммунологического микроокружения опухоли для диагностики и лечения РЭ важна и потому, что выделяемые молекулярные подтипы РЭ различаются как по плотности иммунных клеток, инфильтрирующих опухоль, так и по прогнозу [9]. Количество и пропорции иммунных клеток были исследованы как возможный прогностический маркер РЭ, но в настоящее время исследователями признается необходимость дальнейшего накопления данных для определения того, какие соотношения иммунных клеток обеспечивают прогностические преимущества или недостатки в каждом подтипе РЭ, прежде чем эти данные смогут принести клиническую пользу. Дальнейшее изучение вариантов инфильтрации иммунными клетками, а также градиента концентрации регуляторных молекул (цитокинов) непосредственно в опухоли при РЭ и соседних тканях, с последующим соотношением этих данных с клиническими исходами заболевания, послужит основой для разработки новых, в том числе персонализированных, подходов к диагностике и лечению РЭ [10].
В связи с этим целью работы явилось определение показателей локального иммунитета с выявлением особенностей популяционного состава иммунокомпетентных клеток (ИКК) и параметров цитокинового статуса в тканях опухоли при раке эндометрия на фоне различного клинического течения заболевания.
Материалы и методы исследования
За период с 2021 г. по 2024 г. на базе онкогинекологического отделения ФГБУ «НМИЦ онкологии» МЗ РФ (г. Ростов-на-Дону) было проведено клинико-лабораторное исследование 38 больных, получавших хирургическое лечение с исследованием «сторожевых» лимфатических узлов (СЛУ) по поводу рака тела матки. Средний возраст пациенток составил 64 года. Практически все больные находились в периоде менопаузы (97,3%). Всем больным на догоспитальном этапе выполнялось раздельное лечебно-диагностическое выскабливание полости матки и цервикального канала с последующим гистологическим исследованием полученного материала. Согласно протоколу исследования, критериями включения больных в исследование явились: добровольное согласие пациентки на участие, морфологически подтвержденный диагноз РЭ, а именно эндометриоидная аденокарцинома различной степени дифференцировки (G1–G3), возраст старше 18 лет. Из исследования исключались пациентки, у которых был иной гистологический тип от эндометриоидной аденокарциномы (серозный, светлоклеточный, плоскоклеточный и др.), с первично-множественным онкологическим процессом, хроническими заболеваниями в стадии обострения.
Больным за 18–20 часов перед хирургическим вмешательством в ткань шейки матки вводили радиофармпрепарат, меченный 99mTc (Сентискан), в дозе 120 МБк. Интраоперационно с помощью гамма-детектора определяли СЛУ с последующим удалением и патоморфологическим исследованием. После определения СЛУ выполняли стандартный запланированный объем: тотальную гистерэктомию с придатками, тазовую лимфаденэктомию. Полученный макропрепарат отправляли на патоморфологический анализ.
На основании результатов гистологического исследования больные были разделены на 2 группы: 1-я – без метастазов в тазовые ЛУ (n=26), 2-я группа – с метастазами в тазовые ЛУ (n=12).
Интраоперационно в стерильные емкости осуществляли забор фрагментов опухолевой ткани, лимфатического узла, а также участка условно здоровой ткани матки. Полученные фрагменты тканей непосредственно после забора и доставки в лабораторию нарезали небольшими кусочками по 1–2 мм3. Ткань дезагрегировали в 2 мл буфера для отмывания клеток «Cell Wash» в медиконах с помощью BD Medimachine (BD, USA) в течение 30 с. Полученную суспензию клеток осаждали с помощью лабораторной центрифуги ЦЛМН-Р10-01 (Элекон М, Россия) при 1500 об/мин в течение 10 мин. Надосадочную жидкость (супернатант) отбирали, аликвотировали с последующей заморозкой (–30°С) до определения содержания цитокинов.
Клеточный осадок ресуспендировали в 100 мкл буфера «Cell Wash» с последующим окрашиванием и анализом для определения процентного содержания отдельных клеточных популяций методом проточной цитометрии. Для этого образцы клеточных экстрактов исследуемых тканей окрашивали с использованием следующей панели моноклональных антител: CD3 FITC/CD15+56 PE/CD45 PerCP-Cy5.5/CD4 PE-Cy7/CD19 APC/CD8 APC-Cy7, согласно протоколу производителя (Becton Dickinson, США). Оценку результатов проводили на проточном цитометре FacsCanto (Becton Dickinson, США). Инструментальные настройки прибора проводили с помощью стандартизированных флуоресцентных частиц (CS&T Research Beads, BD Biosciences, США). В каждом образце для анализа данных накапливали не менее 100 000 клеток. Рассчитывали процентное содержание основных популяций и субпопуляций лимфоцитов: общая популяция T-лимфоцитов (CD45+CD3+); Т-лимфоциты хелперы/индукторы (CD45+CD3+CD4+); цитотоксические Т-лимфоциты (CD45+CD3+CD8+); B-лимфоциты (CD45+ CD3-CD19+); NK-лимфоциты (CD45+CD3-CD16/56+). Кроме того, рассчитывали процентное содержание двойных негативных (DN, CD3+CD4-CD8-) и двойных позитивных (DP, CD3+CD4+CD8+) лимфоцитов. Для углубленного изучения NK-клеточного звена, кроме уровня CD16/56+, определяли содержание NKT-клеток (CD3+CD16/56+). Результаты определения T, B, NK, NKT, DN, DP клеток выражали в процентах от общего количества лимфоцитов.
В образцах супернатантов тканей концентрацию цитокинов (интерлейкинов, ИЛ) – ИЛ-1β, ИЛ-4, ИЛ-6, ИЛ-8, ИЛ-10 и фактора некроза опухоли α (ФНО-α) – определяли с помощью «сэндвич»-варианта иммуноферментного анализа (ИФА), согласно инструкции производителя (АО «Вектор-Бест», Россия). Для выполнения анализа использовали аппаратный комплекс, включающий планшетный анализатор иммуноферментных реакций MR-96A (Shenzhen Mindray Bio Medical Electronics, China); автоматическое промывочное устройство StatFax-2600 (Awareness Techology, USA), шейкер-термостат StatFax-2200 (Awareness Techology, USA). Концентрацию общего белка в образцах супернатанта тканей определяли биуретовым методом на полуавтоматическом биохимическом анализаторе с проточной кюветой BS-3000Р (SINNOWA Medical Science & Technology, Китай) с использованием набора «Общий белок-Ольвекс» (ООО «Ольвекс Диагностикум», Россия). Содержание цитокинов выражали в удельной концентрации в пересчете на концентрацию общего белка в пробе (пг/мг белка).
Первичный сбор и анализ результатов проводили в MS Excel, а дальнейшую статистическую обработку данных осуществляли с помощью пакета Statistica 13 (StatSoft Inc., США). Статистическая обработка предполагала расчет основных статистических характеристик выборок, установление характера распределения определяемых показателей с использованием критерия Шапиро–Уилка. Вследствие того что полученные результаты не подчинялись закону нормального распределения, они представлены в виде медианы и интерквартильного размаха – 25-го и 75-го процентилей (Ме [LQ; UQ]). Для оценки достоверности отличий между выборками использовали непараметрический критерий Манна–Уитни. При p<0,05 результаты считали статистически значимыми.
Результаты исследования и их обсуждение. Клинические характеристики обследованных, полученные на первом этапе проведенного исследования, представлены в таблице 1.
Таблица 1
Распределение обследованных больных РЭ по степени дифференцировки опухоли и клиническим характеристикам
|
|
Группа 1 (без метастазирования в тазовые ЛУ) |
Группа 2 (с метастазированием в тазовые ЛУ) |
|
Количество больных Всего 38 |
26 |
12 |
|
Степень дифференцировки |
||
|
G1 |
9 |
0 |
|
Лимфоваскулярная инвазия |
1 |
– |
|
Ангиоваскулярная инвазия |
1 |
– |
|
Признаков лимфо/ангиваскулярной инвазии не наблюдается |
7 |
– |
|
G2 |
15 |
10 |
|
Лимфоваскулярная инвазия |
1 |
7 |
|
Ангиоваскулярная инвазия |
– |
3 |
|
Признаков лимфо/ангиваскулярной инвазии не наблюдается |
14 |
– |
|
G3 |
2 |
2 |
|
Лимфоваскулярная инвазия |
1 |
2 |
|
Ангиоваскулярная инвазия |
– |
– |
|
Признаков лимфо/ангиваскулярной инвазии не наблюдается |
|
– |
|
|
1 – наличие опухолевых эмболов в просвете сосудов |
|
|
Ожирение (ИМТ кг/м2) |
||
|
Норма (от 18,5 до 25,0) |
3 |
– |
|
Избыточная масса тела (от 25,0 до 29,9) |
6 |
2 |
|
Ожирение I степени (от 30,0 до 34,9) |
8 |
7 |
|
Ожирение II степени (от 35,0 до 39,9) |
4 |
2 |
|
Ожирение III степени (от 40,0) |
5 |
1 |
Примечание: составлено авторами.
В 1-й группе больных преобладающим морфологическим типом дифференцировки опухоли являлся вариант G2 – 15 (57,6%), n=26. Но при этом признаки лимфоваскулярной инвазии были определены только у 1 пациентки. Также данную группу составили больные, у которых степень дифференцировки опухоли была G1 – 9 (34,6%), G3 – 2 (7,6%). В 88,4% случаев у больных данной группы ИМТ более 25,0 кг/м2.
При проведении исследования СЛУ были получены следующие данные: у 30 (78,9%) пациенток сторожевые лимфатические узлы определялись с двух сторон, что свидетельствует о правильности выполнения техники. У 3 (7,8%) сторожевой узел был обнаружен только справа и у 3 (7,8%) – слева. Сторонность определения СЛУ может быть связана, по мнению авторов, как с анатомо-физиологическими особенностями больной, так и с технической погрешностью введения радиофармпрепарата.
При гистологическом исследовании метастатическое поражение с одной стороны было выявлено в 11 случаях (91,6%) из 12. В 100% случаев у пациенток, у которых морфологически был подтверждено метастазирование в тазовые лимфатические узлы, в сторожевом ЛУ были обнаружены метастазы.
У больных, у которых были обнаружены метастазы в тазовых лимфатических узлах, гистологический тип дифференцировки эндометриодной аденокарциномы чаще всего соответствовал G2 – 83,3% (n=12), из них в 70% случаев (n=10) определяли лимфоваскулярную инвазию, в 30% – ангиоваскулярную инвазию. У 2 (16,6%, n=12) больных с гистологическим вариантом G3 эндометриоидной аденокарциномы отличительной чертой стало наличие лимфо/ангиоваскулярной инвазии. Так, у 1 пациентки с эндометриоидной аденокарциномой G3 инвазии в лимфатические и кровеносные сосуды не наблюдалось, однако в лимфатических сосудах были обнаружены множественные опухолевые эмболы. Также авторами отмечено, что во 2-й группе у преобладающего большинства больных наблюдалось ожирение различной степени, и только у 2 пациенток была избыточная масса тела (ИМТ от 25,0 до 29,9 кг/м2). Известно, что ожирение служит одним из главных факторов развития РТМ. Это связано с тем, что РТМ является гормонально-зависимым раком, одним из молекулярных механизмов развития РТМ у больных с ожирением служит выработка адипоцитами ароматазы, которая является ферментом для расщепления андрогенов на эстрогены, что и объясняет данную зависимость [11].
На втором этапе проведенного исследования осуществляли определение содержания в тканях отдельных популяций ИКК и концентрации важнейших цитокинов.
На рисунке 1 представлены отличия показателей локального клеточного иммунитета в тканях больных РЭ у больных 2-й группы от соответствующих значений 1-й группы – без метастатического поражения.
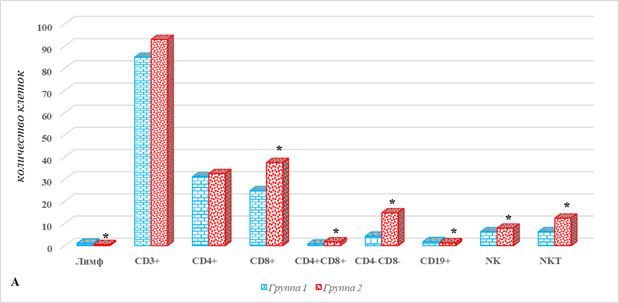
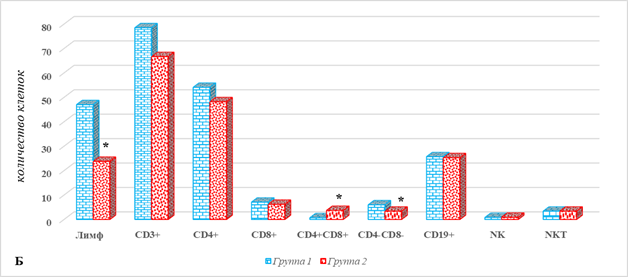
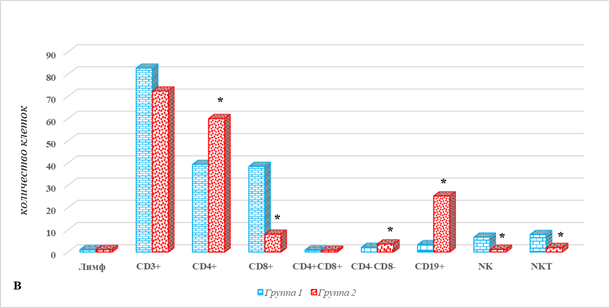
Рис. 1. Параметры локального клеточного иммунитета у больных РЭ в зависимости от наличия метастатического поражения ЛУ: А – ткань опухоли; Б – ткань лимфатического узла; В – условно здоровая ткань матки; * – р˂0,05.
Примечание: составлено авторами
Из представленных результатов видно, что у больных 2-й группы в ткани опухоли по сравнению с показателями 1-й группы наблюдается снижение общего количества лимфоцитов и В-лимфоцитов на 54% и 28%, что составляет соответственно 0,5 (0,3;0,6) против 1,1 (0,8;4,3) и 1,3 (1,1;1,4) против 1,8 (1,8;2,7), р˂0,05 (рис. 1А). На этом фоне выявлено увеличение на 51% количества цитотоксических CD8+ Т-лимфоцитов, что составило 37,5 (31,4;43,5) во 2-й группе против 24,8 (13;30,9) в 1-й группе, р˂0,05 (рис. 1А). Особенностью опухоли пациентов с метастазами является накопление таких популяций, как DP (CD4+CD8+) и DN (CD4-CD8-) лимфоциты, количество которых в образцах 2-й группы превышало соответствующие значения в 1-й группе на 143%, 1,7 (1,6;1,8) против 0,7 (0,4;0,7), и 244%, 14,8 (11,3;18,4) против 4,3 (1,1;4,6), р˂0,05. Обращает на себя внимание выраженное увеличение в ткани опухоли 2-й группы по сравнению с 1-й содержания клеток врожденного иммунитета – NKT-лимфоцитов – на 97%, и менее выраженное в случае NK-лимфоцитов – на 25%, что составило соответственно 12,4 (10,9;13,9) против 6,3 (5,8;6,5), и 7,9 (7,5;10,9) против 6,3 (2;6,9), р˂0,05 (рис. 1А).
В лимфатических узлах больных 2-й группы общее количество лимфоцитов было ниже соответствующего показателя в группе 1 на 49%, составив 23,8 (17,3;25,8) против 47,0 (41,4;58,8), р˂0,05 (рис. 1Б). Обращают на себя внимание разнонаправленные изменения содержания в таких клеточных популяциях, как DP- и DN-лимфоциты. Так, если относительное количество CD4+CD8+ в ЛУ больных 2-й группы превышало соответствующие значения 1-й группы на 429%, составив 3,7 (2,4;4,5) против 0,7 (0,5;0,9), то содержание CD4-CD8- Т-лимфоцитов, напротив, оказалось ниже на 43%, составив 3,4 (2,7;4,7) против 6,0 (5,7;7,7), р˂0,05 (рис. 1Б). Значимых отличий в содержании остальных определяемых популяций ИКК не выявлено.
Несомненный интерес представляет также определение популяционного состава ИКК в условно здоровой ткани матки, результаты которого представлены на рисунке 1В. Из представленных результатов видно, что наибольшие отличия в этом случае характерны для В-лимфоцитов, количество которых у больных 2-й группы превышало аналогичные значения больных без метастазов на 663%, 25,2 (21,3;29,8) против 3,3 (1,8;5,4), р˂0,05. Кроме того, необходимо отметить наличие разнонаправленных изменений таких взаимосвязанных клеточных популяций, как CD4+ и CD8+, а также DP- и DN-лимфоциты. Показано, что наличие метастатических поражений сочетается с увеличением относительного количества Т-хелперов и DN-лимфоцитов – на 52% и 71% соответственно, составив соответственно 60 (58,3;67,8) против 39,4 (24,2;44,7) и 3,6 (3,5;4,6) против 2,1 (1,1;2,9), р˂0,05 (рис. 1В). При этом количество цитотоксических Т-лимфоцитов было ниже на 79%, составив 8,0 (7,3;8,9) против 38,5 (31,1;47,4), р˂0,05, в то время как количество DP-лимфоцитов практически не изменялось (рис. 1В).
Еще одной выявленной особенностью условно здоровой ткани матки в случае наличия метастазов является меньшее количество таких клеток врожденного иммунитета, как NK- и NKT-лимфоциты. Их содержание оказалось ниже соответствующих значений в 1-й группе на 82% и 75% соответственно, что составило 1,2 (0,9;1,7) против 6,7 (6,3;7,2) и 2,0 (1,5;2,4) против 7,9 (5;8,5), р˂0,05 (рис. 1В).
Согласно текущим представлениям, иммунная система имеет важнейшее значение для поддержания функционального состояния практически всех систем жизнеобеспечения организма человека, в том числе и эндометрия. Показано, что эндометрий имеет целый ряд особенностей организации подсистемы иммунитета (VALT – Vulvovaginal-Associated Lymphoid Tissue, лимфоидная ткань, ассоциированная с женскими половыми путями), характеризующийся определенными закономерностями распределения отдельных ИКК в различных участках матки. Кроме того, ИКК могут формировать своеобразные функциональные единицы (комплексы) или лимфоидные агрегаты, популяционный состав которых закономерно изменяется и обусловливает быстрое восстановление регенерирующего эндометрия после менструации [10]. Роль обозначенных структур в возникновении и дальнейшем развитии различных видов неоплазий эндометрия остается слабо изученной, однако показано, что в зависимости от вида опухоли, стадии ее развития, биологических особенностей можно выделить ряд прогностических факторов, которые предлагается учитывать и при планировании использования новых подходов к лечению, в частности иммунотерапии. Так, показано, что увеличение инфильтрации эндометрия CD8+ Т-лимфоцитами является благоприятным прогнозом [12], но на более поздних стадиях РЭ отмечается снижение плотности Т-лимфоцитов [10]. По мнению ряда исследователей, принципиальной является не просто степень инфильтрации цитотоксическими Т-лимфоцитами (ЦТЛ), а степень их активности или способность реализовывать собственный противоопухолевый потенциал, в том числе и уровень экспрессии на их поверхности различных ингибиторов контрольных точек иммунного ответа – белка-рецептора запрограммированной гибели клеток /programmed cell death-1 (PD-1), лиганда рецептора запрограммированной гибели клеток / programmed death-ligand 1 (PD-L1) и др. [10, 13].
В литературе отсутствует единое мнение относительно роли инфильтрирующих В-лимфоцитов РЭ, хотя количество последних чаще уступает числу различных популяций Т-лимфоцитов, но их роль в прогрессировании РЭ требует дальнейшего изучения. Это представление базируется на том, что В-лимфоциты являются центром в лимфоидных агрегатах, отсутствие которых связывают с прогрессией заболевания [14, 15].
Важное место в реализации противоопухолевого иммунитета, в том числе и при РЭ, отводят и отдельным популяциям клеток врожденного иммунитета, в частности NK-лимфоцитам и опухоль-ассоциированным макрофагам, для которых показаны высокая пластичность и функциональная гетерогенность с неоднозначной ролью в развитии патологического процесса [16, 17].
Обращает на себя внимание также и тот факт, что в опухолевом микроокружении особую роль приобретают различные регуляторные клеточные подмножества, в частности Т-регуляторные и В-регуляторные лимфоциты, секреторные NK-клетки и миелоидные супрессорные клетки, которые способствуют формированию иммуносупрессивного фенотипа, доминирующего в условии прогрессирования заболевания [10, 18].
Таким образом, проведенное исследование позволяет с определенной вероятностью говорить о наличии ряда особенностей распределения клеточных популяций ИКК при различных вариантах течения заболевания. Формирование метастатических поражений у больных РЭ характеризуется увеличением в опухоли количества CD8+-, DP-, DN-, NK- и NKT-лимфоцитов, а также снижением содержания В-лимфоцитов. Полученные результаты согласуются с приведенными в литературе данными [10, 12, 14, 16], но не позволяют в полной мере говорить о функциональном состоянии клеток с потенциальной цитотоксичностью. Особенностью популяционного состава условно здоровой ткани эндометрия является накопление числа CD4+ и В-лимфоцитов на фоне более низкого количества NK- и NKT-лимфоцитов, разнонаправленного изменения числа DP- (без изменения) DN- (увеличение) клеток, последнее аналогичная тенденция и в ткани лимфатического узла. Указанные изменения могут свидетельствовать о перераспределении ИКК при РЭ с выраженной аккумуляцией клеток с цитотоксическим потенциалом, который не может быть реализован вследствие формирования иммуносупрессивного фенотипа.
Результаты определения цитокинового статуса отдельных тканей представлены на рисунке 2.
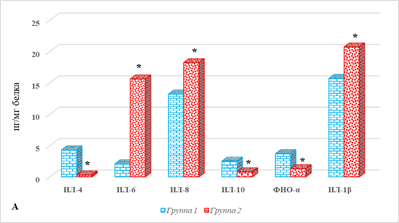
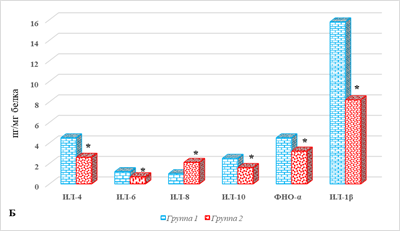
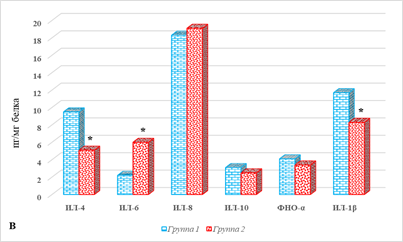
Рис. 2. Параметры локального цитокинового статуса тканей больных РЭ в зависимости от наличия метастатического поражения ЛУ: А – ткань опухоли; Б – ткань лимфатического узла; В – условно здоровая ткань матки; * – р˂0,05. Примечание: составлено авторами
Из представленных результатов видно, что ткань опухоли больных РЭ 2-й группы характеризовалась выраженным увеличением содержания ИЛ-6, количество которых превышало аналогичный показатель в образцах 1-й группы (без метастатического поражения) на 643%, составив 15,6 (13,2;18,5) против 2,1 (1,9;2,5) пг/мг белка, р<0,05 (рис. 2А). Менее выраженное увеличение концентрации наблюдалось в случае ИЛ-8 и ИЛ-1β, соответственно на 38% и 32%, что составило 18,2 (17,6;23,4) против 13,2 (8,6;15,4) и 20,7 (19,8;29,5) против 15,7 (14,7;18,5) пг/мг белка, р<0,05 (рис. 1А). На этом фоне отмечено значимое снижение концентрации ИЛ-4, ИЛ-10 и ФНО-α – соответственно на 93%, 68% и 65%, р<0,05.
Особенностью цитокинового профиля ЛУ больных 2-й группы явилось то, что из всего спектра определяемых регуляторных молекул только концентрация ИЛ-8 превышала значения группы 1 на 110%, составив 2,1 (1,7;2,8) против 1,0 (0,9;1,3) пг/мг белка, р<0,05 (рис. 2Б). Содержание остальных цитокинов было значимо ниже в образцах ЛУ больных РЭ с метастатическими поражениями (на 48% в случае ИЛ-1β, на 42% – в случае ИЛ-4 и ИЛ-6, на 36% – в случае ИЛ-10 и на 29% в случае ФНО-α), составив соответственно 8,2 (7,7;9,5) против 15,8 (14,9;16,1), 2,6 (2,2;3,3) против 4,5 (4,1;6,8), 0,7 (0,5;0,8) против 1,2 (1,1;1,6), 1,6 (1,3;1,8) против 2,5 (2,4;2,6) и 3,2 (2,8;3,5) против 4,5 (4;5,1), пг/мг белка, р<0,05 (рис. 2Б).
В случае условно здоровой ткани эндометрия у больных РЭ 2-й группы выявлено значимое увеличение концентрации ИЛ-6 – на 173%, 6,0 (4,9;7,2) против 2,2 (1,7;2,8), на фоне снижения содержания ИЛ-4 и ИЛ-1β – соответственно на 46%, 5,1 (4,1;5,9) против 9,5 (7,5;13,1) и 29%, 8,3 (7,7;9,5) против 11,7 (10,6;13,9) пг/мг белка, р<0,05 (рис. 2В).
В настоящее время не вызывает сомнения тот факт, что мультифункциональные регуляторные молекулы, в том числе и разнообразные цитокины, принимают непосредственное участие не только в поддержании физиологического антигенного гомеостаза организма человека, но и в развитии заболеваний, в частности при опухолях различной локализации. Показано, что при опухолевом росте формируется своеобразный вариант цитокиновой сети, который сопряжен с одновременным проявлением иммуностимуляции и иммуносупрессии. В данном случае наблюдаемая иммунная стимуляция обусловлена опухолью, опосредует иммуноредактирование с одновременной первоначально местной, а на более поздних стадиях – системной (генерализованной) иммуносупрессией, защищающей опухолевые клетки [19]. В данных условиях образуется своеобразный цитокиновый хаос, который является одним из основных компонентов иммуносупрессивной среды при опухолях [20].
В настоящем исследовании показано, что отличительными чертами локального цитокинового статуса при РЭ в случае возникновения метастатических поражений в ткани опухоли служат резкое увеличение ИЛ-6 (основного провоспалительного цитокина) и менее выраженное – ИЛ-1β, а также хемоаттрактанта ИЛ-8. При этом содержание остальных определяемых цитокинов были значимо ниже. Важно отметить, что параметры цитокинового статуса, концентрация отдельных представителей на локальном, тканевом уровне имеют несомненную связь с их содержанием в системном кровотоке, но направление и выраженность изменений для отдельных молекул не всегда однонаправленные и пропорциональные.
Так, в работе Л.И. Дятловой и соавторов показано стойкое увеличение содержания ИЛ-4, ФНО-α и ИФН-γ в сыворотке крови больных РЭ, причем авторы указывают на корреляцию содержания указанных цитокинов со стадией распространения неоплазии эндометрия и считают, что это может иметь прогностическое значение [20]. В других исследованиях показано увеличение концентрации в тканях при РЭ таких цитокинов, как ИЛ-6, ИЛ-8, ИЛ-31, ИЛ-33, ИЛ-10, и ряда других молекул, что согласуется с полученными результатами [21].
Вероятно, показанное разнонаправленное изменение содержания исследуемых регуляторных молекул может отражать дисбаланс в цитокиновой регуляторной сети, что оказывает влияние на возможность ИКК реализовывать противоопухолевый потенциал и модулирует биологические свойства опухоли.
Обращает на себя внимание высокая концентрация ИЛ-6 как в ткани опухоли, так и в условно здоровой ткани эндометрия. По мнению ряда исследователей, ИЛ-6 занимает особое место в регуляторной системе, так как для него характерна роль в большей степени модулятора, чем, собственно, про- или противовоспалительного цитокина: он способен подавлять образование ФНО-α и ИЛ-1, стимулируя при этом синтез некоторых белков острой фазы воспаления [22].
Заключение
Таким образом, наличие метастатического поражения у больных РЭ сопровождается перераспределением клеточных популяций как врожденного, так и адаптивного иммунитета, что характеризуется накоплением в ткани опухоли лимфоцитов с выраженным противоопухолевым потенциалом. Тем не менее, в анализируемых условиях высока вероятность реализации иммуносупрессивного фенотипа с преобладанием супрессорных регуляторных клеток, что препятствует реализации цитотоксического потенциала ИКК. Кроме того, в опухолевой ткани при РЭ наблюдается дисбаланс цитокинов, которые могут продуцироваться не только ИКК, но и опухолью и различными клеточными группами микроокружения. В данных условиях повышается вероятность образования такого варианта клинического цитокинового паттерна, который характеризуется одновременной иммуностимуляцией и иммуносупрессией у онкологических больных с повышением содержания ФНО-α, ИЛ-6, ИЛ-8, ИЛ-10 и иных, что согласуется с полученными результатами. Следствием образования данного паттерна является индуцированная опухолью иммунная стимуляция, опосредующая иммуноредактирование, с одновременной первоначально местной, а на более поздних стадиях – генерализованной иммуносупрессией, которая модифицирует биологические свойства раковых клеток, способствуя их дальнейшему росту и прогрессированию.
Полученные данные дополняют современные представления о сложных, противоречивых взаимодействиях между опухолью и иммунной системой, а определение рассматриваемых показателей локального клеточного и цитокинового статуса может служить дополнительным прогностическим фактором развития РЭ для более эффективного выбора стратегии дальнейшего лечения.
Библиографическая ссылка
Половодова В.В., Сагакянц А.Б., Бондаренко Е.С., Вереникина Е.В., Шульгина О.Г., Закарян К.М., Максимова Н.А., Черкасова А.А., Женило В.М. ЛОКАЛЬНЫЙ ИММУННЫЙ СТАТУС ПРИ РАЗЛИЧНОМ КЛИНИЧЕСКОМ ТЕЧЕНИИ РАКА ЭНДОМЕТРИЯ // Современные проблемы науки и образования. 2025. № 2. ;URL: https://science-education.ru/ru/article/view?id=34006 (дата обращения: 06.03.2026).
DOI: https://doi.org/10.17513/spno.34006



