Введение. В настоящее время уровень развития здравоохранения и социальных услуг позволил увеличить среднюю продолжительность жизни людей, вследствие чего выросла доля пожилого населения. Это привело к увеличению распространенности заболеваний, характерных для лиц пожилого возраста, среди которых одно из важных мест занимает деменция [1]. Согласно статистическим данным, в структуре выраженных когнитивных нарушений деменция сосудистого генеза занимает второе место после болезни Альцгеймера [2]. Когнитивные расстройства негативно влияют на социальную адаптацию пациентов, создают выраженные психологические и экономические трудности не только самим пациентам, но и их родственникам. В связи с этим своевременное назначение лечения и применение методов профилактики с целью коррекции когнитивных функций являются одной из актуальных тем в последние годы. Сосудистые когнитивные нарушения (СКН) – это общий термин для состояний, связанных с острым или хроническим нарушением мозгового кровотока и последующим снижением когнитивных функций [3].
Цель работы. Проанализировать данные литературы, посвященные изучению этиологии, патогенеза и терапии сосудистых когнитивных нарушений (КН).
Материал и методы исследования. Проанализированы 35 источников литературы (содержащихся в базах данных eLibrary, PubMed), включающих в себя оригинальные исследования, метаанализы, систематические обзоры за период 2008–2024 гг. Проанализированы данные об этиологии, патогенезе, терапии сосудистых когнитивных нарушений.
Результаты исследования и их обсуждение. СКН включают в себя весь спектр когнитивных расстройств, от легких до выраженных (сосудистой деменции), вызванных сосудистыми факторами отдельно или в сочетании с нейродегенерацией, в частности с болезнью Альцгеймера (БА). В мировых масштабах распространенность сосудистой деменции в 2018 г. оценивалась в 50 млн человек, и ожидается, что к 2050 г. она утроится [4].
Сосудистая деменция представляет собой второй по распространенности тип когнитивных нарушений после болезни Альцгеймера. В Северной Америке и Европе она составляет примерно 15–20% от общего числа случаев деменции, в то время как в Азии этот показатель достигает 30% [5]. В 2019 г. в России зарегистрированы 1 949 811 человек с деменцией различного генеза, что составило 1,3% от всего населения [6]. Можно предположить, что на долю сосудистой деменции приходится примерно 389 962 случая.
СКН наиболее распространены у лиц пожилого и старческого возраста в связи с высокой частотой сосудистых и нейродегенеративных заболеваний. В развитых странах около 5–10% людей старше 65 лет страдают от деменции, при этом примерно в 20% случаев ее причинами являются цереброваскулярные заболевания. Распространенность недементных форм СКН (легких и умеренных) значительно превышает распространенность самой деменции, но оценить их распространенность сложно в связи с отсутствием общепринятых критериев диагностики [7].
Факторы риска СКН. Основными модифицируемыми факторами риска формирования сосудистой деменции являются артериальная гипертензия, гиподинамия, депрессия, курение, сахарный диабет, заболевания сердца, избыточная масса тела и ожирение, гиперлипидемия. Согласно исследованию 2017 г., повышение артериального давления в среднем возрасте увеличивает риск развития деменции в течение 18-летнего периода наблюдения на 60%. Ожирение связано с повышением риска развития деменции в позднем возрасте на 30% [8]. Не только артериальная гипертензия, но и пониженные цифры систолического артериального давления и частые эпизоды его резкого снижения у пожилых людей коррелируют с более чем двукратным увеличением риска развития деменции [9].
Сахарный диабет в 2,5 раза повышает риск развития сосудистой деменции. До развития деменции диабет связан с ускоренным снижением когнитивных функций, повышенным риском когнитивных нарушений и их прогрессированием до деменции. Состояния, приводящие к глобальной гипоперфузии головного мозга, также повышают риск развития СКН. К данным факторам риска относят хроническую сердечную недостаточность, постоянные и пароксизмальные формы аритмий, в частности фибрилляцию предсердий, наличие аномалий сосудов головного мозга, шеи, аорты, выраженный атеросклероз сонных артерий. Всесторонний метаанализ популяционных когорт показал, что ишемическая болезнь сердца и сердечная недостаточность связаны с повышением риска деменции на 26% и 59% соответственно. Шведское исследование группы пожилых людей в возрасте ≥60 лет показало, что фибрилляция предсердий ускоряет скорость снижения когнитивных функций и ассоциируется с повышением риска развития деменции на 40%. Курение и алкоголь как вредные привычки повышают риск развития КН. Существует большое число эпидемиологических исследований, подтверждающих связь между курением и повышенным риском КН и деменции. Чрезмерное употребление алкоголя является известным фактором риска развития КН, сердечно-сосудистых и метаболических заболеваний, однако отдельные исследования показывают, что умеренное употребление алкоголя замедляет снижение когнитивных функций и снижает риск развития деменции. Во многих исследованиях показано, что физическая активность снижает риск развития КН. Это может быть связано с положительным влиянием физической активности на профилактику сердечно-сосудистых и метаболических заболеваний, которые выступают факторами риска развития деменции. Пищевой рацион может влиять на мозг через ось «кишечник – мозг», которая соединяет желудочно-кишечный тракт и центральную нервную систему. Ряд авторов допускают, что измененные пути в системе «кишечник – мозг» могут способствовать воспалительным процессам, которые приводят к СКН. Однако вопрос о том, как изменения в микробиоме кишечника могут привести к патологии сосудов головного мозга и в конечном итоге – к СКН, еще не изучен. Группой авторов на основании данных, накопленных за последние годы, представлена концепция СКН как многофакторного комплексного синдрома, который развивается в течение всей жизни человека. Процесс изменений, способных повлиять на когнитивный резерв, начинается с внутриутробного периода, когда здоровье матери и внешние факторы влияют на плод, далее оказывают свое воздействие генетические факторы и факторы окружающей среды, такие как нездоровый образ жизни, гипертония, сердечно-сосудистые заболевания, нарушения обмена веществ. Совокупный результат воздействия данных факторов приводит к сосудистым КН (рис. 1) [10].
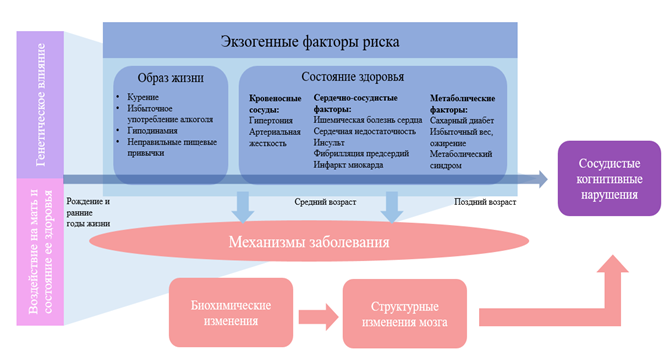
Рис. 1. Концепция СКН как многофакторного комплексного синдрома (составлено авторами по источнику [10]
Инсульт – один из ключевых факторов, вызывающих сосудистую деменцию. Вероятность развития деменции после инсульта варьирует от 5% через год после транзиторной ишемической атаки до 34% через год после тяжелого инсульта [11].
Помимо факторов, которые оказывают негативное влияние на когнитивные функции, можно выделить и ряд протективных факторов, которые способны увеличить когнитивный резерв. Одним из таких факторов является уровень образования. Пожилые люди с высшим образованием показывают лучшие результаты при выполнении диагностических тестов, направленных на выявление КН. Установлено, что у них ниже риск развития деменции, в том числе и после инсульта [12].
Занятия, стимулирующие когнитивные способности, защищают от снижения КН и деменции. У людей, вовлеченных в активную когнитивную деятельность (чтение книг, наличие хобби, активный отдых, владение современными гаджетами для получения новой информации), риск развития деменции на 40% ниже. Социальная активность выступает фактором, влияющим на КФ. Более редкие социальные контакты, высокий уровень одиночества, низкий уровень социального взаимодействия на 26% увеличивают риск развития когнитивного снижения [13].
Активно изучается влияние особенностей питания на КН. Было высказано предположение, что соблюдение диет, таких как средиземноморская, скандинавская, может помочь сохранить когнитивный резерв. В этих диетах особое внимание уделяется потреблению продуктов, богатых полиненасыщенными жирными кислотами омега-3 и витаминами, которые могут обладать нейропротективными свойствами [14].
Патогенез СКН. Патофизиологической основой СКН является хроническая дизрегуляция мозгового кровотока, что морфологически отражается в виде поражения церебральных артерий небольшого калибра, приводящего к лакунарным инфарктам и диффузному повреждению белого вещества головного мозга. За рубежом данные изменения обозначаются как «церебральная микроангиопатия (ЦМА)» или «болезнь мелких сосудов» (англ.: small vessel disease / cerebral microangiopathy), в России чаще используют понятие «дисциркуляторная энцефалопатия». Реже в качестве ведущей основы СКН может выступать церебральная макроангиопатия, развивающаяся вследствие множественных обширных инфарктов мозга (мультиинфарктная деменция), единичного инфаркта «стратегических зон» или внутримозгового кровоизлияния. Церебральная микроангиопатия, или болезнь малых сосудов (БМС) – это понятие, которое описывает изменения в структуре микрососудов головного мозга, включая артерии малого диаметра, артериолы, капилляры и венулы [15].
Поражение при БМС локализовано преимущественно в области микроциркуляторного русла, которое является структурным компонентом нейроваскулярной единицы, к которой относятся нейроны, астроциты, гематоэнцефалический барьер (ГЭБ), перициты, гладкомышечные клетки сосудов и внеклеточный матрикс. При поражении данных структур возникает каскад нарушений, связанных с нарушением регуляции кровотока, проницаемостью сосудов и ГЭБ, клиренсом продуктов метаболизма. Пролонгированное воздействие повреждающих факторов приводит к ремоделированию стенок сосудов, ишемическим и геморрагическим поражениям, накоплению белков в периваскулярном пространстве, включая β-амилоид, активации процессов хронического нейровоспаления, вторичной нейродегенерации (рис. 2) [16, 17].
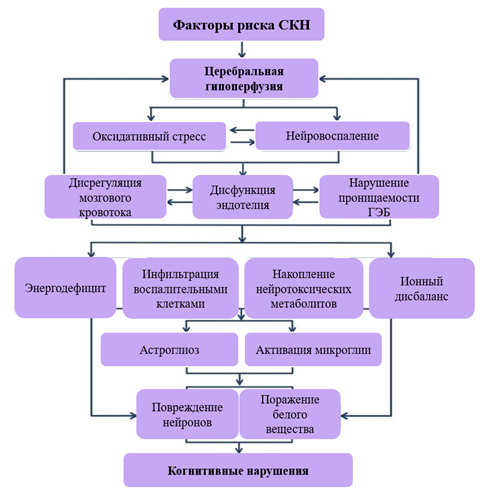
Рис. 2. Патогенез сосудистых когнитивных нарушений (составлено авторами по источнику [16])
Данные изменения на уровне микроциркуляторного русла преимущественно белого вещества головного мозга приводят к феномену «разобщения», который заключается в нарушении связей лобных долей и подкорковых структур головного мозга, что клинически проявляется когнитивными нарушениями [18].
Патогенетические подтипы СКН. Большое количество накопленных данных по этиологии и патогенезу СКН обусловило необходимость их систематизации. В этих целях в 2017 году были опубликованы консенсусные экспертные критерии и согласованная классификация СКН – VICCCS (Vascular Impairment of Cognition Classification Consensus Study) на основании международного опыта. В данном консенсусе определены основные механизмы формирования СКН (таблица).
Основные механизмы возникновения СКН
|
Механизмы возникновения СКН, предложенные участниками VICCCS |
Процент поддержки участниками консенсуса, % |
|
Церебральная амилоидная ангиопатия |
93 |
|
Смешанные формы (цереброваскулярное и нейродегенеративные заболеваниея в сочетании) |
93 |
|
Гиперинтенсивность белого вещества (лейкоэнцефалопатия) |
93 |
|
Микрокровоизлияния/микрогеморрагии |
89 |
|
Микроинфаркты |
89 |
|
Артериит/васкулит, включая локальные и системные |
82 |
|
Субдуральное или субарахноидальное кровоизлияния |
70 |
Примечание. Составлено авторами по [19].
Морфофункциональные изменения мозга при СКН. Традиционно считается, что для когнитивных нарушений сосудистой этиологии характерны нейродинамические (внимание, скорость обработки информации) и регуляторные (планирование и принятие решений, когнитивная динамичность, выявление и коррекция ошибок, оценка новой информации) нарушения. Однако очаги поражения при СКН локализуются в разных отделах мозга, и, следовательно, симптомы могут варьировать от практически полного их отсутствия до поражения нескольких сфер когнитивных функций, что затрудняет диагностику СКН по конкретным критериям. В ряде исследований изучались преимущественные типы когнитивной дисфункции при воздействии разных сосудистых факторов риска. Сердечно-сосудистые заболевания, в частности гипертония, неизменно связаны со снижением внимания и скоростью обработки информации, и это наиболее актуально для гипертонии в среднем возрасте, но не в пожилом [20].
В ряде других исследований было показано, что гипертония у лиц среднего возраста коррелирует с прогрессирующим снижением объема серого вещества в дополнительной моторной коре, передней поясной извилине и левой средней височной извилине, что проявляется нарушением планирования, снижением кратковременной рабочей памяти. У испытуемых лиц также установлено двустороннее поражение белого вещества верхних продольных пучков мозга, клиническим проявлением которого является замедление скорости обработки информации. В обзоре от 2021 года была отмечено, что, несмотря на поражение теменных долей и их связей с лобными долями при СКН, упомянутое во многих публикациях, в нейрокогнитивное тестирование редко включается оценка теменной дисфункции, заключающейся в нарушении эгоцентрической пространственной ориентации. Таким образом, исследования пространственной ориентации могут стать потенциально новым и более специфичным подходом к диагностике СКН. Есть данные, что эгоцентрическая (относящаяся к себе) пространственная ориентация действительно чувствительна и избирательна к СКН и может использоваться в качестве маркера для выявления сосудистой патологии, а также критерия для различения пациентов с СКН и БА [21].
Результаты лонгитюдного когортного исследования показывают выраженное снижение зрительно-пространственных функций и скорости обработки информации у лиц с длительным течением сахарного диабета 2-го типа. Степень нарушения зрительно-пространственных функций положительно коррелировала с объемом пораженного белого вещества [22].
Нарушения памяти обычно характерны для БА. Однако в исследовании у людей среднего возраста с диабетом 2-го типа были обнаружены низкие показатели немедленной и отсроченной памяти. Анализ МРТ-снимков головного мозга у данных лиц показал микроструктурные изменения белого вещества лобных и височных долей, потерю серого вещества передней поясной извилины [23, 24].
В недавно проведенном исследовании установлено, что у пациентов с перенесенным ТИА / инфарктом мозга наблюдалась более высокая годовая скорость атрофии как левого, так и правого гиппокампа по сравнению со здоровыми людьми в контрольной группе в течение 3-летнего периода. При этом скорость атрофии гиппокампа коррелировала с нарушением эпизодической памяти и исполнительных функций [25].
При изучении биоэлектрической активности мозга с помощью показателей электроэнцефалографии (ЭЭГ), таких как потенциалы, связанные с событиями, установлено, что у пациентов с СКН нарушена связь между теменными и лобными долями. Эти данные свидетельствуют о том, что такая реакция ЭЭГ отражает нарушение связи между задними и передними структурами головного мозга вследствие дисфункции белого вещества у людей с доклинической и клинической стадией СКН [26].
Рассмотренные данные свидетельствуют о преимущественном нарушении нейродинамических и регуляторных когнитивных функций, обусловленном дисфункцией лобно-теменных связей. Однако стоит принимать во внимание и нарушения памяти, что связано с поражением вещества височных долей и атрофией гиппокампа при воздействии отдельных сосудистых факторов риска.
Диагностика СКН. Согласно критериям, принятым в 2014 году рабочей группой Международного общества по сосудистым поведенческим и когнитивным расстройствам (VASCOG), на первом этапе у пациента устанавливается факт наличия КН, затем подтверждается их сосудистая этиология. Среди инструментов нейропсихологического тестирования Монреальская шкала оценки когнитивных функций (MoCA-тест, Montreal Cognitive Assessment) является наиболее чувствительным тестом для диагностики СКН. В качестве дополнительного скрининга возможно использование батареи тестов на лобную дисфункцию, тестов, требующих учета времени («символы и цифры», тест Струпа) [27].
Инструментальным методом диагностики, подтверждающим наличие ЦМА, является магнитно-резонансная томография (МРТ). Существуют стандарты описания сосудистых изменений по данным МРТ – STandards for ReportIng Vascular changes on nEuroimaging (STRIVE), опубликованные рабочей группой исследователей нейродегенеративных заболеваний (Centres of Excellence in Neurodegeneration) в 2013 году. К данным изменениям относятся: недавние малые субкортикальные инфаркты, лакуны, гиперинтенсивность белого вещества (ГИБВ), микрокровоизлияния (МКР), периваскулярные пространства (ПВП), атрофия мозга, поверхностный сидероз коры головного мозга, корковые микроинфаркты (рис. 3) [28].
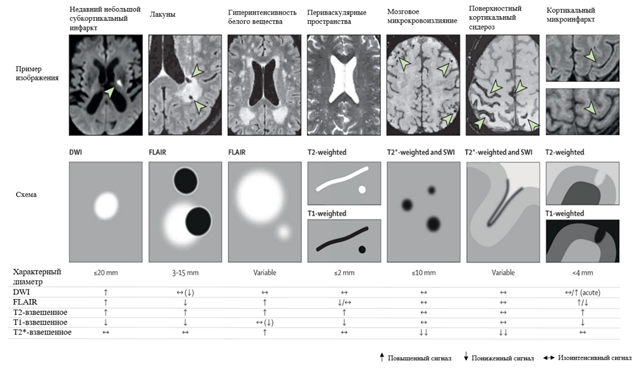
Рис. 3. Особенности МРТ-поражений, связанных с заболеванием мелких сосудов мозга (составлено авторами по источнику [28])
Основные направления терапии и профилактики СКН. Одной из стратегий профилактики и лечения СКН являются устранение и коррекция модифицируемых сосудистых факторов риска с уделением особого внимания комплексному подходу. Помимо медикаментозных направлений терапии, активное внимание уделяется модификации образа жизни пациентов. Результаты рандомизированного контролируемого исследования, проведенного в Финляндии, убедительно доказали положительные изменения в когнитивной сфере и потенциал для профилактики СКН при комплексном подходе с коррекцией сосудистых факторов риска, приверженностью диете, регулярной физической активностью, когнитивными тренировками [29].
В отношении факторов риска в первую очередь необходимы контроль и коррекция гипертонии, ожирения, курения и диабета. В настоящее время не получено доказательств эффективности применения ингибиторов холинэстеразы и мемантина при когнитивных нарушениях после инсульта или сосудистой деменции, но их целесообразно использовать при сочетании БА и сосудистой деменции [30].
Направления будущих исследований. По мнению специалистов по сосудистым когнитивным расстройствам из Ассоциации по борьбе с болезнью Альцгеймера, будущие исследования в области СКН должны быть направлены на разработку новых биомаркеров для раннего выявления людей, подверженных риску СКН [31]. В настоящее время изучаются биомаркеры крови, ликвора, генетические биомаркеры, которые связаны с повреждением эндотелия и гематоэнцефалического барьера, нейрональным повреждением и воспалением, окислительным стрессом. Среди потенциальных маркеров СКН можно отметить следующие: липокалин-2, основной белок миелина, легкая цепь нейрофиламента, фибриноген, тромбомодулин, активированные VII и VIII факторы свертывания крови, астроцитарный белок S100P [32, 33].
В последние годы растет число доказательств половых различий в развитии цереброваскулярных заболеваний. В исследовании 2020 года приведены данные, указывающие на разные паттерны поражения головного мозга в зависимости от пола. Так, у женщин более выражена церебральная микроангиопатия, приводящая к поражению белого вещества, в то время как у мужчин развивается преимущественно макроангиопатия с инфарктами в бассейнах крупных артерий [34]. Наряду с определением биологических различий требуется более подробное изучение влияния социальных факторов (таких как образование, профессия, социальная активность) на когнитивный резерв [35].
Заключение. СКН включают в себя широкий спектр когнитивных нарушений – от легких, которые проявляются только при когнитивном тестировании, до выраженных, значительно нарушающих активность пациентов. Цереброваскулярные факторы риска, распространенные среди пожилых людей, вносят основной вклад в развитие СКН. Протективные факторы, способствующие сохранению когнитивного резерва, активно изучаются в настоящее время. Патогенез КН в большей части случаев представляет собой сочетание сосудистого и нейродегенеративного компонентов, которые накладываются друг на друга и повышают риск когнитивной дисфункции. СКН проявляются в основном нарушением нейродинамических и регуляторных когнитивных функций, обусловленных дисфункцией лобно-теменных связей. Определение сосудистой этиологии КН значительно упрощается благодаря нейровизуализации, в частности МРТ. В настоящее время специальных методов лечения СКН не существует, но рекомендуются стандартные меры коррекции факторов риска. Таким образом, мультимодальные вмешательства, включающие коррекцию сосудистых факторов риска и образа жизни, в настоящее время являются наиболее многообещающей стратегией лечения и профилактики СКН.
Библиографическая ссылка
Мустафаева Ю.А., Бойнова И.В., Токарева Н.Г., Филина Е.А., Макарова Е.А., Серебрякова Ю.А. СОВРЕМЕННЫЙ ВЗГЛЯД НА ЭТИОЛОГИЮ, ПАТОГЕНЕЗ И ТЕРАПИЮ СОСУДИСТЫХ КОГНИТИВНЫХ НАРУШЕНИЙ // Современные проблемы науки и образования. 2025. № 2. ;URL: https://science-education.ru/ru/article/view?id=34004 (дата обращения: 12.02.2026).
DOI: https://doi.org/10.17513/spno.34004



