Введение
Сигнальный путь трансформирующего фактора роста бета (TGFβ) участвует во многих клеточных процессах как у взрослых организмов, так и у развивающихся эмбрионов. К этим процессам относятся рост клеток, дифференцировка, миграция, апоптоз, поддержание гомеостаза и другие функции. Сигнальные пути TGFβ являются высококонсервативными [1]. Несмотря на широкий спектр процессов, которые они регулируют, механизм их действия достаточно прост. Лиганды суперсемейства TGFβ связываются с рецептором типа II, который привлекает и фосфорилирует рецептор типа I. Рецептор типа I затем фосфорилирует рецептор-регулируемые SMAD-белки (R-SMAD), которые связываются с ко-SMAD (например, SMAD4). SMADs представляют собой семейство структурно сходных белков, которые являются основными передатчиками сигналов для рецепторов суперсемейства трансформирующего фактора роста бета (TGF-B). SMADs критически важны для регуляции развития и роста клеток. Аббревиатура SMAD относится к гомологиям генов Caenorhabditis elegans SMA (фенотип «маленького» червя) и MAD family («Матери против декапентаплегии») у дрозофилы. Комплексы R-SMAD/ко-SMAD накапливаются в ядре, где действуют как факторы транскрипции, регулируя экспрессию целевых генов [2].
Суперсемейство TGFβ включает такие лиганды, как костные морфогенетические белки (BMPs; bone morphogenetic proteins), факторы роста и дифференцировки (GDFs), антимюллеров гормон (AMH), активин, Nodal и TGFβ [3, 4, 5]. Сигнализация начинается с связывания лиганда суперсемейства TGFβ с рецептором типа II. Этот рецептор представляет собой серин/треониновую киназу, которая катализирует фосфорилирование рецептора типа I. Каждый класс лигандов связывается со специфическим рецептором типа II. Активины, которых существует три типа (A, B и AB), участвуют в эмбриогенезе, остеогенезе и регулируют гормоны гипофиза, гонад и гипоталамуса, а также инсулин [6–8]. Они также являются факторами выживания нервных клеток. BMPs связываются с рецептором типа 2 для костных морфогенетических белков (BMPR2) и регулируют остеогенез, дифференцировку клеток, спецификацию переднезадней оси, рост и гомеостаз.
Регуляция сигнального пути TGFβ осуществляется через антагонисты лигандов, ингибиторы SMAD-белков, псевдорецепторы и процессы убиквитинирования. Например, Chordin (белок, играющий важную роль в формировании дорсально-вентрального паттерна на ранних стадиях эмбрионального развития) и Noggin (белок, который участвует в развитии многих тканей организма, включая нервную ткань, мышцы и кости) ингибируют BMPs, связываясь с ними и предотвращая их взаимодействие с рецепторами И-SMAD, такими как SMAD6 и SMAD7, выполняют функцию отрицательной обратной связи, предотвращая фосфорилирование R-SMAD. Уровень I-SMAD увеличивается при активации TGFβ, что говорит об их роли в регуляции сигнала. SMAD-белки также регулируются через убиквитинирование. E3 убиквитин-лигазы, такие как SMURF1 и SMURF2, участвуют в убиквитинировании и деградации R-SMAD, снижая их активность и регулирование экспрессии генов. Эта многоуровневая система контроля обеспечивает точную настройку сигнального пути TGFβ для выполнения его многочисленных функций в клетке [9].
Цель исследования
Изучение особенностей экспрессии трансформирующего фактора роста бета и его рецептора первого типа при гиперпластических процессах эндометрия, сочетающихся с лейомиомой матки и аденомиозом. Исследование направлено на выявление взаимосвязи между уровнем экспрессии этих маркеров и патогенезом данных заболеваний, а также на определение их роли в процессах пролиферации и ремоделирования тканей эндометрия в условиях сочетанной патологии.
Материал и методы исследования
В гинекологическом отделении отдела оперативной гинекологии «НМИЦ АГиП им. В.И. Кулакова» было проведено комплексное обследование 90 пациенток с гиперпластическими процессами эндометрия, из них: 15 – с полипом эндометрия (ПЭ) (1-я группа), 15 – с гиперплазией эндометрия (ГЭ) (2-я группа), 15 – с полипом эндометрия и аденомиозом (3-я группа), 15 – с полипом эндометрия и миомой (4-я группа), 15 – с гиперплазией эндометрия и аденомиозом (5-я группа) и 15 – с гиперплазией эндометрия и миомой (6-я группа). Дооперационное консультирование пациентов включало: сбор анамнеза, жалобы, оценку клинико-лабораторных и инструментальных данных с последующей интраоперационной оценкой гистологического материала, которое было проведено в 1-м патологоанатомическом отделении ФГБУ «НМИЦ АГиП им. академика В.И. Кулакова» Минздрава России по стандартным методикам в комплексе с иммуногистохимическими исследованиями. Далее была проведена послеоперационная оценка состояния эндометрия с помощью инструментальных методов, гистологического и иммуногистохимического исследований с помощью оценки экспрессии TGF-и его рецептора 1-го типа (TGF-betaR1).
Критериями включения являются: репродуктивный возраст от 18 до 45 лет; наличие гиперпластических процессов эндометрия (полип или гиперплазия эндометрия), определенных при ультразвуковом исследовании, подтверждено интраоперационно и окончательно верифицировано при патологоанатомическом исследовании; наличие миомы матки или аденомиоза, выявленное при гинекологическом и ультразвуковом исследовании, подтверждено интраоперационно и окончательно верифицировано при патологоанатомическом исследовании; наличие информированного согласия на участие в исследовании.
Критериями исключения являются: злокачественные новообразования любой локализации, гормональная терапия в течение 6 месяцев до оперативного лечения, воспалительные заболевания органов малого таза в стадии обострения, наличие тяжелой соматической патологии, применение антибактериальных препаратов за 1 месяц до исследования.
Пациенты в исследуемых группах значимо не различались по возрасту. Возраст всех женщин в среднем составил 35,1±5,5 года. Ожирение отмечалось у 18 (20%) пациенток из 90 (100%). Авторы не выявили статистически значимых различий по наступлению менархе, длительности менструального цикла и длительности менструаций (p>0.05)
Непосредственным материалом для исследования являлись образцы эндометрия, полученные с помощью пайпель-биопсии и раздельного диагностического выскабливания. Для всех образцов была проведена химическая фиксация в 10%-ном нейтральном забуференном формалине в течение 24 ч. Затем образцы были обезвожены в автоматическом режиме при помощи гистологического процессора замкнутого цикла с вакуумом TissueTek VIP5 (Sakura, Япония). Дегидратацию образцов тканей производили с использованием 10%-ного забуференного формалина и раствора для гистологической проводки на основе изопропанола IsoPrep («Биовитрум», Россия), на заключительном этапе проводки выполняли вакуумную пропитку парафином МистерВакс («Биовитрум», Россия). Затем образцы тканей были залиты в парафин Гистомикс Экстра («Биовитрум», Россия) на станции заливки гистологического материала Tissue Tek TEC 5 (Sakura, Япония). Далее из парафиновых блоков были получены срезы толщиной 5 мкм, которые были нанесены на предметные стекла. С помощью аппарата для автоматической окраски Leica Autosteiner XL ST5010 (Leica, Германия) стекла были депарафинированы ксилолом и этанолом, окрашены гематоксилином и эозином; просветление производили с помощью ксилола. Стекла были заключены под покровное стекло с использованием автоматического прибора для заключения срезов Leica CV5030 (Leica, Германия) [10].
Для проведения иммуногистохимического исследования с парафиновых блоков изготавливали срезы толщиной 5 мкм, которые наносили на предметные стекла с положительным зарядом поверхности SuperFrost Plus (Thermo Scientific, США). Затем микропрепараты окрашивали при помощи иммуностейнера BenchMark XT (Ventana, Roche, Швейцария) и панели детекции DAB Universal ultraView (Ventana, Roche, Швейцария). Методика была использована для каждого из антител в соответствии с протоколом, представленным производителем: антитело TGF-beta (клон E-AB-16094; разведение 1:200, производитель: Elabscience (Китай); антитело TGF-R1 (клон E-AB-40049; разведение 1:100, производитель: Elabscience (Китай)). На начальном этапе выполняли отработку титров антител [10].
Оценку иммуногистохимических маркеров авторы проводили полуколичественным методом с подсчетом показателя IRS-score (показатель иммунореактивности), в соответствии с которым IRS вычисляли по формуле: IRS = А˟В, где А – процент позитивных клеток (0 – нет позитивных клеток, 1 – <10% позитивных клеток, 2 – 10–50% позитивных клеток, 3 – 51–80% позитивных клеток, 4– >80% позитивных клеток), а B – интенсивность экспрессии (0 – нет окрашивания, 1 – слабое окрашивание, 2 – умеренное окрашивание, 3 – сильное окрашивание). Итоговый IRS составил от 0 до 12 баллов (0–1 – негативная экспрессия, 2–3 – слабая экспрессия, 4–8 – умеренная экспрессия, 9–12 – сильная экспрессия) [11].
Статистическую обработку данных авторы проводили с помощью программ Microsoft Office Excel 2015, MedCalc v. 12. Нормальность распределения значений в выборках оценивали с применением тестов Шапиро–Уилка и Колмогорова–Смирнова. При нормальном распределении количественных данных, выраженных средним арифметическим и стандартным отклонением, при отклонении от нормального распределения – медианой и размахом отклонения от минимального до максимального. Для качественных данных приводили абсолютные и относительные величины, наличие различий между группами определяли с помощью теста Хи-квадрат. Различия между непрерывными величинами оценивали с использованием t-теста или U-теста Манна–Уитни. Наличие взаимосвязи между факторами риска и исходом определяли путем расчета показателя относительного риска с 95%-ным доверительным интервалом. Различия считали статистически значимыми при уровне значимости р<0,05 [12].
Результаты исследования и их обсуждение
По данным иммуногистохимического исследования, экспрессия TGF-бета составила 5,00 (3,5–7,0) баллов в группе ПЭ, 7,00 (6,0–8,0) баллов в группе ГЭ, 8,00 (7,0–8,0) баллов в группе сочетания ПЭ и аденомиоза, 6,00 (6,0–7,5) баллов в группе сочетания ГЭ и аденомиоза, 8,00 (8,0–8,0) баллов в группе сочетания ПЭ и лейомиомы, 7,00 (6,0–8,0) баллов в группе сочетания ГЭ и лейоимомы (где показатели выражены следующим образом: Ме(Q1-Q3)). Статистически значимая разница была выявлена между 1-й и 3-й группами (р=0,001), 5-й и 1-й группами (р=0,001) и между 4-й и 5-й группами (р=0,034) (используемый метод: критерий Краскела–Уоллиса) (рис. 1А, 2).
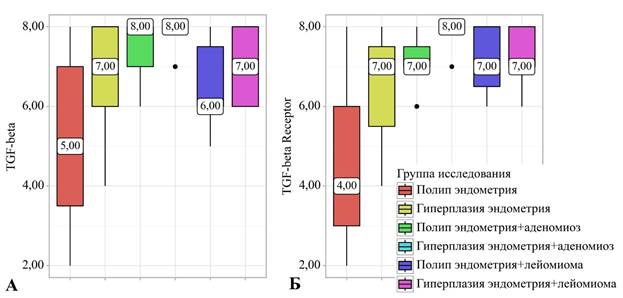
Рис. 1. Анализ TGF-beta (A) и TGF-beta рецептора 1-го типа (TGF-betaR1) (Б) в зависимости от группы исследования. В группе пациенток с полипом эндометрия отмечается самая низкая экспрессия как TGF-beta, так и TGF-betaR в эндометрии, наиболее высокие показатели экспрессии отмечаются в группах пациентов, в которых имеется сочетание полипа эндометрия и аденомиоза, а также гиперплазии эндометрия и аденомиоза
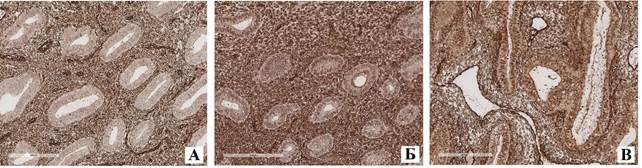
Рис. 2. Иммуногистохимическая экспрессия TGF-beta в эндометрии пациенток с полипом эндометрия (А), в эндометрии пациенток с сочетанием полипа эндометрия и лейомиомы (Б), в эндометрии пациенток с сочетанием гиперплазии эндометрия и аденомиоза. Обращают на себя внимание наиболее низкая экспрессия TGF-beta в эндометрии у пациенток с полипом эндометрия, промежуточные (средние) показатели экспрессии – у тех пациенток, у которых имеется сочетание полипа эндометрия и лейомиомы, наиболее высокие показатели экспрессии – в группе пациенток, у которых отмечается сочетание гиперплазии эндометрия и аденомиоза. Увеличение х100
По иммуногистохимической экспрессии TGF-betaR1 получены следующие данные: 4,00 (3,0–6,0) баллов в группе ПЭ, 7,00 (5,5–7,5) – в группе ГЭ, 7,00 (7,0–7,5) – в группе сочетания ПЭ и аденомиоза, 8,00 (8,0–8,0) – в группе сочетания ГЭ и аденомиоза, 7,00 (6,5– 8,0) – в группе сочетания ПЭ и лейомиомы, 7,00 (7,0–8,0) – в группе сочетания ГЭ и лейоимомы (где показатели выражены следующим образом: Ме(Q1-Q3)). Статистически значимая разница была выявлена между 1-й и 3-й группами (р=0,023), 4-й и 1-й группами (р<0,001), между 5-й и 1-й группами (р=0,009) и между 6-й и 1-й группами (р=0,006) (используемый метод: Критерий Краскела–Уоллиса) (рис. 1Б, 3).
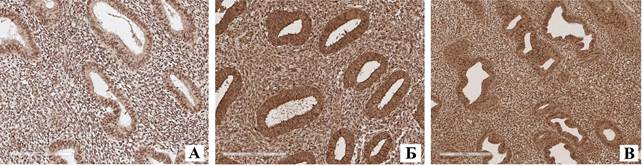
Рис. 3. Иммуногистохимическая экспрессия рецептора TGF-beta в эндометрии пациенток с полипом эндометрия (А), в эндометрии пациенток с сочетанием полипа эндометрия и лейомиомы (Б), в эндометрии пациенток с сочетанием гиперплазии эндометрия и аденомиоза. Обращают на себя внимание наиболее низкая экспрессия TGF-beta в эндометрии у пациенток с полипом эндометрия, средние показатели экспрессии – у тех пациенток, у которых отмечается сочетание полипа эндометрия и лейомиомы, наиболее высокие показатели экспрессии – в группе пациенток, у которых отмечается сочетание гиперплазии эндометрия и аденомиоза. Увеличение х100
Кроме того, авторами был выполнен корреляционный анализ взаимосвязи TGF-beta и TGF-beta R1. Коэффициент корреляции составил 0,739 (теснота связи по шкале Чеддока – высокая) (р<0,001) (рис. 4).
При оценке связи TGF-beta Receptor1 и TGF-beta была установлена высокой тесноты прямая связь. Наблюдаемая зависимость TGF-beta R1 от TGF-beta описывается уравнением парной линейной регрессии:
YTGF-beta Receptor = 0,908 × XTGF-beta + 0,54.
При увеличении TGF-beta на 1 следует ожидать увеличения TGF-beta R1 на 0,908. Полученная модель объясняет 73,8% наблюдаемой дисперсии TGF-beta R1.
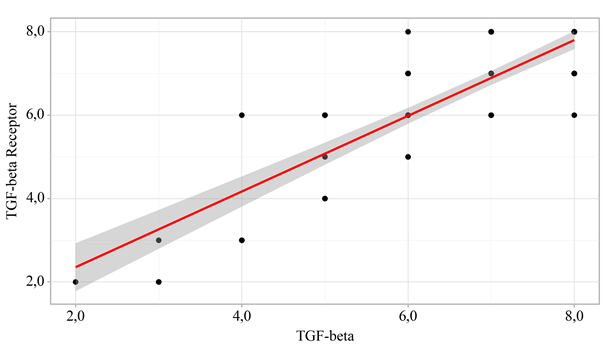
Рис. 4. График регрессионной функции, характеризующий зависимость TGF-beta R1 от TGF-beta
Этиология и патогенез гиперпластических процессов эндометрия остаются не до конца изученными. В отношении полипа эндометрия (ПЭ) было высказано предположение о том, что ПЭ формируется в результате аномальной экспрессии рецепторов эстрогена и прогестерона [13]. Другие авторы выдвинули гипотезу апоптоза на основе наблюдений за белками Bcl-2 и ki67 и предположили, что ПЭ является результатом дисрегуляции, при которой не происходит ожидаемой пролиферации, дифференциации и отторжения тканей в течение менструальной фазы, а не развивается в результате накопления массы ткани с избыточной способностью к пролиферации. Некоторые исследователи также считают, что пролиферация клеток и ангиогенез могут способствовать образованию ПЭ через аномальную экспрессию ферментов и цитокинов, таких как ароматаза, циклооксигеназа (COX), матриксные металлопротеиназы (MMP) и интерферон-гамма (IFN-g) [14-16]. Относительно экспрессии TGF-b в эндометрии ситуация является значительно более спорной. В одном исследовании установлено, что экспрессия этого фактора сильнее в железистых клетках [13], тогда как другие исследования показали, что она сильнее в стромальных клетках [17, 18]. Кроме того, некоторые исследователи обнаружили, что экспрессия зависит от стадии менструального цикла, усиливаясь в поздней пролиферативной фазе и в ранней или средней секреторной фазе либо только в секреторной фазе [19, 20, 21].
В проведенном авторами данной статьи исследовании оценивали экспрессию TGF-b комплексно, не разделяя на железистую и стромальную, так как в первую очередь задачей данного исследования было показать влияние на регуляцию TGF-b-зависимого сигнального пути сопутствующей доброкачественной патологии матки (лейомиомы и аденомиоза). Авторы выявили, что как TGF-beta, так и его рецептор первого типа демонстрируют более высокую экспрессию в группах пациенток с сочетанной патологией матки, особенно с аденомиозом. Следует отметить, что зарубежными авторами уже предпринимались попытки изучить состояние компонентов TGF-b-зависимого сигнального пути при аденомиозе и лейомиоме матки. Были получены противоречивые данные: A. Jacobo и соавт. установили, что экспрессия TGF-β1 между эктопическим эндометрием у пациенток с аденомиозом и эутопическим эндометрием контрольной группы не различалась [22]. Однако другая группа авторов показала, что TGF присутствовал и имел отличную от контрольной группы экспрессию в гладкомышечных клетках пациенток с аденомиозом. Этот результат был подтвержден в эксперименте на модели аденомиоза у мышей с использованием анти-TGF-терапии: противовоспалительный эффект TGF был блокирован, что открывает новые перспективы для будущего лечения данного заболевания. Авторы отмечают, что в будущем, если будут найдены возможности различать диффузный аденомиоз с положительным и отрицательным TGF, лечение может быть различным, например с использованием препаратов, направленных на TGF. В другом исследовании, используя ту же методологию, X. Liu и соавт [23] выявили значительное увеличение агрегации тромбоцитов, экспрессии TGF-β1 и фосфорилированного Smad3 у пациенток с эндометриозом и аденомиозом по сравнению с контрольной группой. В данной работе, помимо изучения экспрессия TGF-β, авторы также исследовали экспрессию его рецептора первого типа (TGF-betaR1). Сопоставление полученных результатов является крайне важным, поскольку регуляция конечных эффектов TGF-β – сигнального пути является сложнорегулируемым процессом, и важно понимать, как изменяется экспрессия наиболее высоко расположенных компонентов при развитии той или иной патологии (рис. 5).
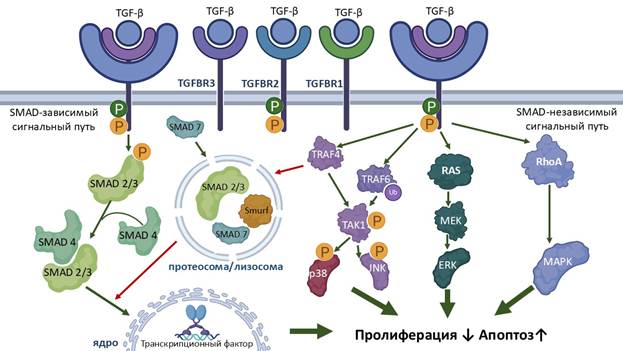
Рис. 5. Сигнальный путь TGF-beta: реализация SMAD-зависимого и SMAD-независимого путей через фосфорилирование рецепторов TGF-beta (оригинальная иллюстрация, созданная на платформе BioRender)
В данном исследовании наблюдалась высокая корреляция между экспрессией TGF-beta и его рецептором первого типа. Важная роль в синергической регуляции этих двух важнейших компонентов TGF-beta зависимого пути в патогенезе гиперплазии эндометрия уже была продемонстрирована ранее. Также проведены и наблюдения за изменением экспрессии рецепторов TGF-beta при развитии ПЭ. Показано, что повышение не только экспрессии самого TGF-beta, о котором уже упоминалось выше, но и его рецепторов, главным образом именно TGF-betaR1, может вносить вклад в развитие ПЭ наряду с дисбалансом стероидных рецепторов и прангиогенных факторов [24–26].
Заключение
Результаты изучения иммуногистохимической экспрессии трансформирующего фактора роста бета (TGF-β) и его рецептора первого типа (TGF-βR1) при гиперпластических процессах эндометрия в сочетании с лейомиомой матки и аденомиозом позволяют предположить, что сочетание гиперпластических процессов эндометрия с сопутствующей патологией тела матки, особенно с аденомиозом, затрагивает функциональную активность регулируемого TGF-β сигнального пути, что приводит к усилению экспрессии как самого TGF-β, так и его рецептора первого типа. Это может свидетельствовать о важной роли TGF-β-зависимого сигнального пути в патогенезе данных состояний.
Библиографическая ссылка
Асатурова А.В., Саркисян Р.М., Гаврилова Т.Ю., Бадлаева А.С., Трегубова А.В., Рогожин Д.В., Адамян Л.В. ИММУНОГИСТОХИМИЧЕСКАЯ ЭКСПРЕССИЯ ТРАНСФОРМИРУЮЩЕГО ФАКТОРА РОСТА БЕТА И ЕГО РЕЦЕПТОРА ПРИ ГИПЕРПЛАСТИЧЕСКИХ ПРОЦЕССАХ ЭНДОМЕТРИЯ В СОЧЕТАНИИ С ЛЕЙОМИОМОЙ МАТКИ И АДЕНОМИОЗОМ // Современные проблемы науки и образования. 2025. № 2. ;URL: https://science-education.ru/ru/article/view?id=33995 (дата обращения: 06.03.2026).
DOI: https://doi.org/10.17513/spno.33995



