Введение
Малоинвазивные косметологические процедуры, по данным мировой статистики, показывают неуклонный рост как по количеству запросов среди пациентов, так и по количеству выполненных манипуляций. Не исключением этого роста является и практическое применение коллагеностимуляторов, в частности на основе полимолочной кислоты (ПМК) [1]. В целом, частота нежелательных явлений после применения полимолочной кислоты, по данным разных авторов, варьирует от 7,7 до 50,6% [2, 3]. При этом частота серьезных осложнений, таких как узлы и гранулемы, варьирует от 0,0075 до 2% [4, 5]. С увеличением количества процедур ожидаемо увеличивается и количество нежелательных явлений и осложнений.
При применении коллагеностимуляторов в тканях отмечается слабая хроническая воспалительная реакция как ответ организма на имплантацию инородного материала [6]. В результате происходит активация фибробластов с повышением их синтетической активности [7, 8]. При нарушении регуляции участия большого количества иммунокомпетентных клеток может развиваться гранулематозное воспаление [9].
Развитие гранулематозного воспаления начинается с быстрой инфильтрации нейтрофилов, сопровождающейся мгновенной адсорбцией различных белков организма-хозяина на инородном материале. Циркулирующие в крови моноциты медленно мигрируют в мягкие ткани и дифференцируются в макрофаги. В случае когда размер частиц введенных филлеров превышает размеры макрофагов, выполнение последними их основной функции (захват и лизис) становится невозможным. Активированные макрофаги сливаются в многоядерные гигантские клетки инородного тела посредством влияния цитокинов, контролирующих механизмы клеточного слияния. Макрофаги также выделяют факторы, привлекающие и активирующие фибробласты, и вокруг материала образуется фиброзная капсула [9]. Клинически данный процесс проявляется в виде формирования подкожных образований узлового характера, плотной консистенции, не спаянных с окружающими тканями, определяющихся как визуально, так и пальпаторно. Гранулематозная реакция – это отсроченная реакция, которая, как правило, развивается, по данным G. Lemperle и соавт., через 6–24 месяца после имплантации препарата. Дифференциальный диагноз, в частности, проводится с узлами невоспалительного характера, обусловленными скоплением препарата. Невоспалительные узлы манифестируют раньше – через 14–60 дней после имплантации препарата, чаще всего являются следствием нарушения техники введения [10]. Достоверная дифференциальная диагностика может быть проведена лишь на основании гистологического (патоморфологического) исследования биоптата образования.
Для лечения гранулематозного воспаления предложены различные методы, такие как внутриочаговое введение глюкокортикостероидов (ГКС), 5-фторурацила, лазерная терапия [9, 11, 12]. Однако применение ГКС и 5-фторурацила имеет, в свою очередь, некоторые побочные эффекты и осложнения. Поэтому в настоящее время ведется поиск более благоприятных методов лечения гранулем. Ранее группой авторов был предложен способ лечения гранулем инъецированием аутологической плазмы крови человека [13]. Такой подход пригоден и для профилактики рецидива гранулематозного процесса. Патогенетическое действие аутологической плазмы крови человека на гранулемы заключается в разобщении плотных клеточных контактов основных клеточных элементов внутри гранулемы ввиду различия рН образования и вводимого субстрата. В результате уменьшается размер гранулемы, вплоть до полного регресса.
Другими авторами показана эффективность лечения гранулем, появившихся через 3 недели после имплантации препарата на основе поли-D,L-молочной кислоты, посредством применения монополярного радиочастотного воздействия [12], вызывающего их деградацию.
Принцип действия радиочастотного лифтинга основан на возможности непрерывной радиоволны генерировать локальное эндогенное повышение температуры, при котором происходит частичная денатурация коллагена с последующим его сокращением. В дерме образуются микробласты, которые стимулируют неоколлагенез [13]. Проходя через ткани, радиоволновой ток вызывает колебания молекул тканей на своем пути с частотой 1000000Гц. В результате микроосцилляций молекул тканей, межмолекулярного и внутримолекулярного движения образуется кинетическая энергия, переходящая в термическую. Нагрев тканей может происходить до высоких температур и носить аблятивный характер, при меньшем температурном показателе — неаблятивный. В последнем случае термостимуляция индуцирует воспаление, запускающее неоколлагеногенез, неоэластогенез и выработку основного вещества соединительной ткани. Ведущей задачей в этом процессе является обеспечение прицельного дозированного нагрева структур-мишеней в условиях максимально деликатного воздействия на окружающие ткани [14]. При радиочастотном воздействии на частицы полимолочной кислоты изменяются ее кристаллические свойства, что косвенно может влиять на сроки биодеградации [15].
Несмотря на появляющиеся данные о разных методах лечения нежелательных явлений после применения коллагеностимуляторов, проблема их лечения остается актуальной. В настоящей статье авторы представляют свой клинический опыт ведения пациентов с осложнениями после использования полимолочной кислоты.
Цель исследования – продемонстрировать возможности клинического использования мультиполярного фракционного микроигольчатого радиочастотного лифтинга в лечении осложнений после применения препаратов на основе полимолочной кислоты.
Материалы и методы исследования. Представлены 2 клинических случая успешного использования мультиполярного фракционного микроигольчатого радиочастотного лифтинга в лечении отсроченного и раннего осложнений после применения препаратов на основе полимолочной кислоты.
Публикация данных выполнена на основании информированного добровольного согласия пациенток.
Результаты исследования и их обсуждение
Клинический кейс №1: применение аутологической плазмы крови человека и мультиполярного фракционного микроигольчатого радиочастотного лифтинга в лечении гранулематозного воспаления после введения препарата ПМК.
Пациентка И., 55 лет, обратилась с жалобами на плотные узлы и неровности в области нижней трети лица и шеи, появившиеся в течение последних двух месяцев (рис. 1).
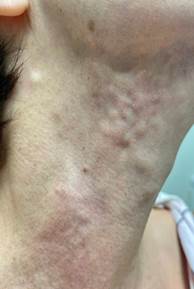
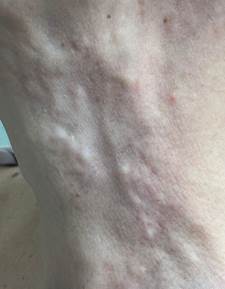
Рис. 1. Изменение мягких тканей области шеи. Пациентка И., 55 лет, через 5 месяцев после проведения процедуры филлером на основе поли-D,L-молочной кислоты (Aesthefill, Корея)
Из анамнеза: за 3 и 8 месяцев до появления указанных образований пациентке в области нижней трети лица и шеи были проведены процедуры эстетической коррекции препаратом на основе поли-D,L-молочной кислоты (Aesthefill, Корея). После выполнения процедур жалоб не предъявляла. До этого 1,5 и 3 года назад в области лица и шеи была проведена коллагеностимуляция препаратом на основе гидроксиапатита кальция. Соматический анамнез: без особенностей, в аллергологическом анамнезе отмечет наличие поливалентной аллергии (на цветение, мед, цитрусовые и другие компоненты).
По данным ультразвуковой сонографии в области подкожно-жировой клетчатки отмечены гипоэхогенные образования (рис. 2). На основании данных анамнеза, клинической картины и результатов ультразвукового исследования был поставлен предварительный диагноз: гранулематозное воспаление.
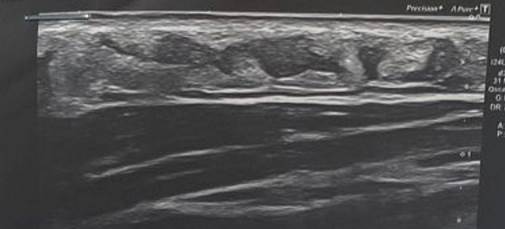
Рис. 2. Результаты ультразвукового сканирования мягких тканей шеи пациентки И., с жалобами на наличие плотных узлов: гипоэхогенные образования с неровными краями на уровне подкожно-жировой клетчатки
С целью верификации диагноза выполнено гистологическое исследование образования, выявившее наличие воспаления кожи. Характеристика эпидермиса: обычного гистологического строения. Характеристика дермы: воспалительная инфильтрация, фиброз. Локализация воспалительной инфильтрации: сосочковый слой дермы, ретикулярный слой дермы. Клеточный состав инфильтрата: гигантские многоядерные клетки. Комментарий: в цитоплазме гигантских многоядерных клеток определяется инородный эозинофильный материал (рис. 3). Патоморфологическое заключение: морфологическая картина кожи с гранулематозным воспалением, наличием фрагментов инородных тел.
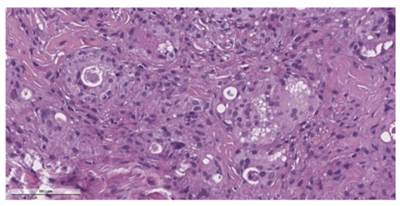
Рис. 3. Патоморфологическое исследование образований кожи нижней трети лица. Микропрепарат операционного биоптата кожи. Окраска гематоксилином и эозином, увеличение 10х40. Гигантские многоядерные клетки, в цитоплазме которых определяется инородный эозинофильный материал
На первом этапе пациентке были проведены инъекции аутологической плазмы крови человека, в результате чего была достигнута инфильтрация всех узлов и мягких тканей, окружающих их. Введение аутологической плазмы крови человека проводилось 1 раз в неделю. После первых трех процедур была отмечена положительная динамика: значительное уменьшение размеров узлов и их визуализации на поверхности кожи. Визуально были заметны лишь единичные узлы, в большей степени в области шеи. Пальпаторно сохранялись плотные образования в области нижней трети лица и шеи (меньшего размера). После четвертой и пятой процедур введения аутологической плазмы крови человека было отмечено отсутствие динамики лечения по данным визуального, пальпаторного и ультразвукового исследования. Было решено сменить тактику лечения.
На втором этапе для лечения был применен аппарат для мультиполярного фракционного микроигольчатого радиочастотного лифтинга. Перед каждой процедурой было проведено ультразвуковое исследование мягких тканей нижней трети лица и области шеи (рис. 4). При этом измерялась глубина узловых образований. Длина игл менялась в зависимости от расположения узлов: иглы направлялись в центр узлов.
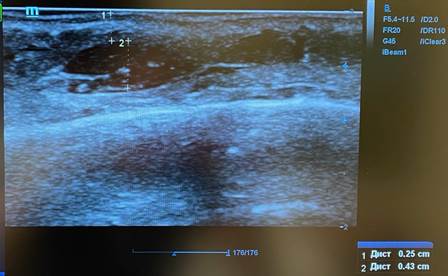
Рис. 4. Результаты ультразвукового сканирования мягких тканей шеи пациентки И. перед проведением мультиполярного фракционного микроигольчатого радиочастотного лифтинга: отмечены дистанции от поверхности кожи до гипоэхогенного образования и высота узлов
Процедуры мультиполярного фракционного микроигольчатого радиочастотного лифтинга через неделю были дополнены инъекциями аутологической плазмы крови человека. Всего было проведено 3 процедуры, с интервалом 1 раз в 1 месяц. Результат лечения: полная инволюция узлов по данным визуального и пальпаторного исследования (рис. 5).
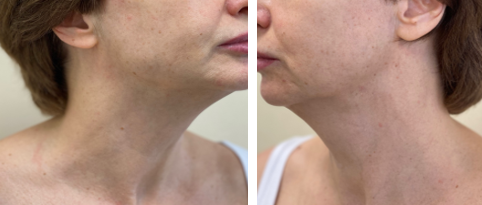
Рис. 5. Состояние мягких тканей пациентки И., 55 лет, через 5 месяцев после лечения инъекциями аутологической плазмы крови человека и применения мультиполярного фракционного микроигольчатого радиочастотного лифтинга
Клинический кейс № 2: применение изотонического раствора NaCl и мультиполярного фракционного микроигольчатого радиочастотного лифтинга в лечении узлового образования после введения препарата ПМК.
Пациентка Т., 57 лет, обратилась в клинику с жалобами на единичное сформировавшееся узловое уплотнение в мягких тканях переднебоковой поверхности шеи слева (рис. 6). Образование плотной консистенции, безболезненное, не спаяно с окружающими тканями, с неизмененной кожей в проекции.
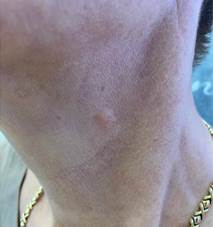
Рис. 6. Пациентка Т., 57 лет, через 3 недели после имплантации коллагеностимулятора на основе ПМК
Из анамнеза: 3 недели назад была выполнена субдермальная имплантация коллагеностимулятора на основе PLLA (Sculptra). Инъекция произведена канюльной веерной техникой, концентрация PLLA-суспензии 7,5 мг/мл, распределение препарата равномерное 0,1 мл/см2. Реабилитационный постпроцедурный период без особенностей. Рекомендованный массаж после процедуры выполняла в течение 5 дней.
Соматический анамнез: без особенностей.
По данным ультразвуковой сонографии, в области подкожно-жировой клетчатки отмечено неоднородное изоэхогенное образование, без признаков васкуляризации (рис. 7).
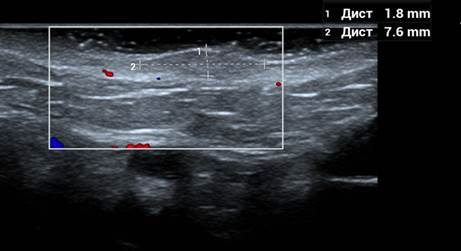
Рис. 7. Результаты ультразвукового сканирования мягких тканей шеи пациентки И.
На основании данных анамнеза, клинической картины и данных ультразвукового исследования был поставлен диагноз: образование кожи, подкожная гранулема?
Начата терапия в виде внутриочагового введения 0,9%-ного раствора NaCl с целью «размывания» локального скопления частиц PLLA. Выполнено 5 сеансов инъекций с интервалом в 1–2 дня. После выполненных манипуляций образование уменьшилось в размерах и стало более мягким.
Было принято решение вторым этапом терапии применить мультиполярный фракционный микроигольчатый радиочастотный лифтинг неизолированным картриджем на глубину 2,0 мм (исходя из данных ультразвукового исследования) с целью термической биодеградации образования.
Выполнен один сеанс терапии, через месяц после которого была отмечена значительная положительная динамика: практически полное визуальное исчезновение образования, едва пальпируемое при мануальном исследовании (рис.8). По данным УЗИ – изменение интенсивности эхогенности и размеров образования.
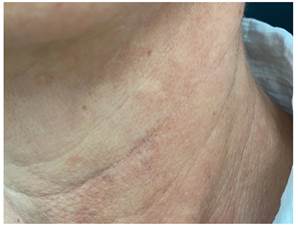
Рис. 8. Пациентка Т., 57 лет, через 1 месяц после проведения мультиполярного фракционного микроигольчатого радиочастотного лифтинга
В настоящий момент пациентка продолжает находиться под наблюдением, планируется проведение второй процедуры мультиполярного фракционного микроигольчатого радиочастотного лифтинга.
Заключение
Поскольку происходит рост количества процедур коллагеностимуляции препаратами на основе ПМК, а также имеется наличие риска развития нежелательных косметических дефектов, основой которых являются подкожные гранулемы, пациенты должны быть полностью проинформированы о возможных последствиях этой процедуры, а врачи – иметь современные представления о методах восстановления кожного покрова. Представленные клинические кейсы демонстрируют эффективность применения мультиполярного фракционного микроигольчатого радиочастотного лифтинга с целью коррекции отсроченных нежелательных явлений после инъекций ПМК. Этот вопрос нуждается в последующем изучении для принятия решения о возможном включении метода в протоколы коррекции данных состояний.
Библиографическая ссылка
Борзых О.Б., Захаров Д.Ю., Карпова Е.И., Первых С.Л., Грекова Ю.Н. ПРИМЕНЕНИЕ МУЛЬТИПОЛЯРНОГО ФРАКЦИОННОГО МИКРОИГОЛЬЧАТОГО РАДИОВОЛНОВОГО ЛИФТИНГА В ЛЕЧЕНИИ ОСЛОЖНЕНИЙ ПОСЛЕ ВВЕДЕНИЯ ПРЕПАРАТОВ НА ОСНОВЕ ПОЛИМОЛОЧНОЙ КИСЛОТЫ // Современные проблемы науки и образования. 2025. № 2. ;URL: https://science-education.ru/ru/article/view?id=33983 (дата обращения: 12.02.2026).
DOI: https://doi.org/10.17513/spno.33983



