Введение
За последние 20 лет в РФ количество больных с подтверждённым диагнозом хронической сердечной недостаточности (ХСН) увеличилось с 7,18 до 12,35 млн человек [1; 2]. Увеличение больных с ХСН обусловлено несколькими факторами: увеличение продолжительности жизни населения в целом, увеличение числа больных с артериальной гипертонией и ишемической болезнью сердца, доступность современных методик диагностики. Также специалистами выделена так называемая предстадия сердечной недостаточности – синдром, характеризующийся отсутствием симптомов и признаков сердечной недостаточности, но с имеющимися морфофункциональными изменениями миокарда и повышением натрийуретического пептида. На фоне увеличения количества пациентов с ХСН закономерно увеличивается количество пациентов, имеющих различные коморбидные ассоциации. В последнее время активно обсуждается ассоциация ХСН с ревматической патологией. Течение ХСН на фоне системного неинфекционного воспаления низкой степени интенсивности представляет собой новый коморбидный фенотип [3-5]. Значительный интерес представляет изучение течения ХСН на фоне ревматоидного артрита (РА). На сегодняшний день известно, что пациенты с ревматоидным артритом имеют более высокие риски декомпенсации течения сердечно-сосудистых заболеваний. В первую очередь, это связано с более интенсивным развитием атеросклероза [6; 7]. Регулярный прием нестероидных противовоспалительных средств связан с рисками дестабилизации артериального давления [8]. Хроническое неинфекционное воспаление низкой степени интенсивности, на примере РА, может ускорять развитие миокардиального фиброза и приводить к более быстрому развитию диастолической дисфункции [9; 10]. Актуальной задачей является разработка методик, позволяющих на досимптомных стадиях выявлять риск имеющейся декомпенсации сердечной недостаточности. Определение уровней натрийуретических пептидов у пациентов с ХСН на фоне РА может давать некорректные значения на фоне системного аутоиммунного воспаления ввиду сложных иммунологических реакций и влияния противовоспалительной терапии РА на значения пептидов.
По данным современных исследований, изучение свойств иммунологических цитокинов имеет значимый научно-практический потенциал в ведении пациентов с ХСН. В представленной работе использован пентраксин-3 (PTX3) – белок острой фазы, играющий важнейшую роль в развитии сердечно-сосудистой патологии. Его повышенный уровень ассоциирован с развитием и прогрессированием эндотелиальной дисфункции, прогрессией окислительного стресса и процессов вторичного ангиогенеза [11]. По имеющимся данным, данный цитокин может быть использован как терапевтическая мишень в лечении РА [12].
Также активно обсуждается вопрос о роли противовоспалительной терапии РА в изменении параметров сердечной недостаточности. По данным M.S.J. Mangan и соавторов, отмечается снижение вероятности возникновения острых сердечно-сосудистых осложнений у больных с ССЗ и ревматоидным артритом (РА) при использовании метотрексата. Тем не менее с увеличением данных от исследований становятся явными противоречивые данные. Исследователи связывают это со специфическим действием препарата: его защитные свойства проявляются лишь в случае умеренной или высокой степени активности РА [13]. Защитная антитромботическая функция при воспалении обусловлена не аденозин-зависимыми механизмами, а влиянием цитозольного белка NLRP3 [14].
Цели исследования:
1. Сравнительный анализ уровня РТХ3, N-концевого фрагмента мозгового натрийуретического пептида (NТ-proBNP) и симптомов ХСН сердечной недостаточности между пациентами с РА и без РА.
2. Сравнительный анализ уровней PTX3 в зависимости от типа принимаемой терапии РА.
3. Оценка возможных ассоциаций уровня РТХ3 с показателями течения ХСН и терапией РА.
Материалы и методы исследования
Проведено одномоментное сравнительное исследование двух групп пациентов: 134 женщины с ХСН и РА, а также 122 женщины с ХСН без РА. Диагнозы были подтверждены в соответствии с современными принципами диагностики и лечения данных заболеваний. Все пациенты были в достаточном объеме проинформированы о целях проводимого исследования.
ХСН у большинства пациентов (82%) была вызвана стабильной коронарной патологией, в остальных случаях – гипертонической болезнью (18%). Из исследования были исключены пациенты с другими тяжелыми патологиями (сахарный диабет, онкологические заболевания), а также с ХСН со сниженной фракцией выброса левого желудочка. Всем пациентам была проведена трансторакальная эхокардиография для оценки соответствующих параметров, а также уровней NT-proBNP. Пациенты с РА в большинстве случаев (74%) имели серопозитивный вариант заболевания. В качестве лечения заболевания (75% случаев) применялось цитостатическое средство группы антиметаболитов – метотрексат. Остальные пациенты с РА, ввиду плохой переносимости метотрексата, применяли антипролиферативный, иммуномодулирующий препарат с иммуносупрессивным эффектом – лефлуномид.
С помощью корреляционного анализа оценены возможные ассоциации уровня пентраксина-3 с вариантами терапии РА.
Статистическая обработка материала выполнена с учетом современных критериев SAMPL. Соответствие данных гауссову распределению оценивалось по критерию Колмогорова – Смирнова. Значения были представлены в виде среднего (М) и стандартного отклонения (SD). Статистическая значимость различий между средними была оценена с использованием критерия Манна–Уитни (U). Статистические различия в количественных показателях и долях были определены с помощью z-критерия (BioStat/AnalystSoft). Оценка ассоциаций изучаемых признаков и их характеристика проводились с применением логистического регрессионного анализа. Проверка статистической гипотезы и определение уровня статистической значимости производились при условии, что значение p <0,05.
Результаты исследования и их обсуждение
Сравнительный анализ частоты проявлений симптомов ХСН не выявил статистически значимых различий в обследуемых группах (табл.).
Сравнительный анализ частоты проявления симптомов ХСН
|
Симптомы ХСН |
ХСН с РА (n=134) |
ХСН без РА (n=122) |
p |
||
|
n |
% |
n |
% |
||
|
Ощущение нехватки воздуха |
54 |
40 |
47 |
38 |
0,38 |
|
Слабость |
56 |
41 |
53 |
43 |
0,57 |
|
Сердцебиение |
24 |
19 |
22 |
19 |
0,23 |
|
Статистически значимыми различия считаются при р <0,05. |
|||||
Анализ морфофункциональных показателей выявил различия в соотношении скорости раннего диастолического наполнения и усреднённой скорости подъёма основания левого желудочка в раннюю диастолу: 16,3 (4) в группе пациентов с ХСН и РА и 15,6 (1,8) в группе пациентов с ХСН без РА, р=0,002. По другим эхокардиографическим параметрам статистически значимых различий обнаружено не было. Средние значения уровня фракции выброса левого желудочка составили: 43 (2,2) и 42,89 (1,2) % по методике Симпсона, р=0,018 [15].
Сравнительный анализ уровней NT-proBNP выявил статистически значимые различия. Одной из причин данного феномена может быть применение в исследуемой группе в качестве базисного препарата лечения РА - метотрексата (рис. 1). По имеющимся данным, метотрексат может уменьшать выраженность симптомов ХСН и положительно влиять на течение заболевания [16; 17].
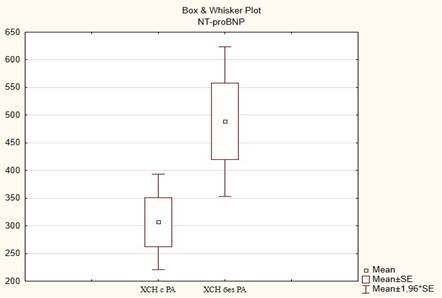
Рис. 1. Сравнительный анализ уровней NT-proBNP, пг/мл
В группе пациентов с РА, которым был назначен лефлуномид, различий NT-proBNP не было: 550 (54,6) и 475 (34,8) пг/мл соответственно.
Анализ уровней РТХ3 выявил статистические различия в содержании цитокина в обследуемых группах, со значимым повышением в группе ХСН и РА, р=0,001 (рис. 2).
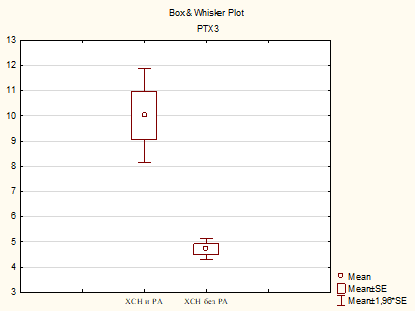
Рис. 2. Сравнительный анализ уровня РТХ3, пг/мл
Для оценки уровня РТХ3 в зависимости от принимаемой терапии РА в группе пациентов с ХСН и РА было выделено две подгруппы пациентов, получавших метотрексат либо лефлуномид. В группе пациентов, принимающих лефлуномид, была обнаружена статистически значимо повышенная высокая концентрация РТХ3 по сравнению с пациентами, принимающими метотрексат (р=0,03), и пациентами без РА (р=0,0001) (рис. 3).
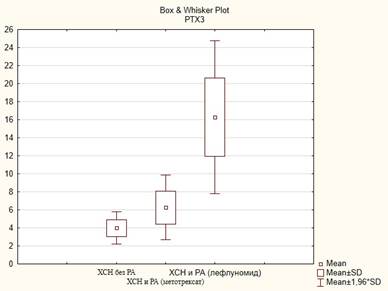
Рис. 3. Сравнительный анализ РТХ3 в подгруппах, пг/мл
При изучении связей между основным противовоспалительным лечением ревматоидного артрита и анализируемыми показателями, в группе пациентов с ХСН и РА была обнаружена обратная корреляция метотрексата с соотношением скорости раннего диастолического наполненияи усреднённой скорости подъёма основания левого желудочка в раннюю диастолу (рис. 4) и обратная корреляция с уровнем пентраксина-3 (рис. 5).
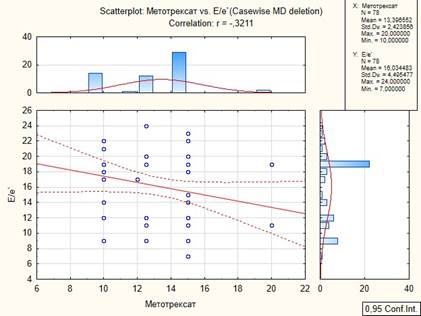
Рис. 4. Корреляционный анализ значения Е/е` и дозировки метотрексата
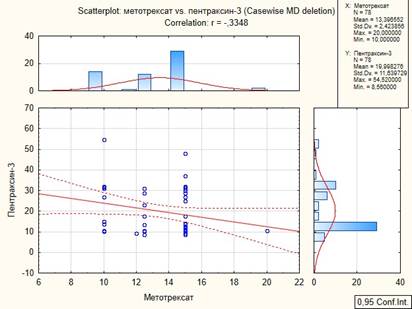
Рис. 5. Корреляционный анализ между РТХ3 и метотрексатом
В исследовании пациентов, принимающих лефлуномид, не выявилось схожих ассоциаций.
Исследования фиксируют отрицательное влияние иммуномодулирующих цитокинов на сердечно-сосудистую систему. Высокие концентрации цитокинов способствуют гипертрофии, уменьшению числа артериол, изменениям во внеклеточном матриксе и формированию неоинтимы. На фоне РА отмечается более тяжелое течение атеросклероза вместе с ростом сердечно-сосудистых рисков для пациентов, дисфункцией эндотелия, увеличение риска надрыва атеросклеротических бляшек, угнетение антикоагулянтных свойств сосудов, фиброз миокарда [18]. Кроме того, отмечается повышение вероятности тромбоэмболий на основе имеющихся данных [19].
В проведенном исследовании были обнаружены значительные различия в уровне РТХ-3 между пациентами с ХСН и РА и без РА. Уровень РТХ3 оказался выше у пациентов с РА, что, вероятно, связано с негативным влиянием хронического воспаления на сердечную мышцу и последующим прогрессированием диастолической дисфункции, что отражено в полученных различиях в соотношениях скорости раннего диастолического наполненияи усреднённой скорости подъёма основания левого желудочка в раннюю диастолу между обследуемыми пациентами. Интересно отметить, что различий в уровнях фракции левого желудочка выявлено не было, а натрийуретический пептид был ниже у пациентов с РА. Кроме того, стоит подчеркнуть, что в группе пациентов с РА, получающих лефлуномид, уровень пентраксина-3 достигал максимальных значений и демонстрировал статистически значимую разницу по сравнению с цитокинами у тех, кто принимал метотрексат. Вероятно, метотрексат оказывает подавляющее действие на выработку РТХ3.
Заключение
Таким образом, можно предположить, что метотрексат способен оказывать «сдерживающий» эффект в течение ХСН у пациентов с РА. В пользу данной гипотезы указывают статистически значимо сниженные уровни NT-proBNP у пациентов с РА, принимающих метотрексат, по сравнению с пациентами без РА, а также обнаруженные корреляции метотрексата с соотношением скорости раннего диастолического наполненияи усреднённой скорости подъёма основания левого желудочка в раннюю диастолу и уровнем РТХ3. Возможно, уровень РТХ3 может быть использован в качестве маркера оценки эффективности лечения РА у пациентов с ХСН, однако для этого требуется проведение дополнительных проспективных исследований.
Библиографическая ссылка
Анкудинов А.С., Варавко Ю.О. ОЦЕНКА МАРКЕРА ПАТОЛОГИЧЕСКОГО НЕОАНГИОГЕНЕЗА – ПЕНТРАКСИНА-3 У ПАЦИЕНТОВ С ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ ПРИ ЛЕЧЕНИИ РЕВМАТОИДНОГО АРТРИТА // Современные проблемы науки и образования. 2025. № 2. ;URL: https://science-education.ru/ru/article/view?id=33964 (дата обращения: 06.03.2026).
DOI: https://doi.org/10.17513/spno.33964



