Введение. Наиболее распространенными процедурами для лечения дефектов трубчатых костей является костная пластика с использованием биологических мембран и метод Илизарова. Чтобы свести к минимуму последствия, вызванные на донорском участке свободными лоскутами, уменьшить дискомфорт пациента и сделать реконструкцию кости более надежной, выбор операции Маскуле (Masquelet), сочетающей индуцированные мембраны и клеточные аутотрансплантаты, является наиболее эффективным. На протяжении последних лет ведутся активные дискуссии, подкрепляемые различными исследованиями, посвященные изучению индуцированной мембраны, образующейся при двухэтапной костной пластике посттравматических дефектов трубчатых костей [1-3].
Методика реконструкции кости, описанная Маскуле (Masquelet), сочетает в себе индукцию мембраны с помощью цементного спейсера с дальнейшей заменой его на губчатый аутотрансплантат. Эта методика позволяет реконструировать обширные дефекты трубчатых костей в два хирургических этапа и обеспечивает формирование биологической структуры, секретирующей факторы роста и предотвращающей резорбцию аутотрансплантата, выполняя роль надкостницы. Использование этой техники надежно в экстренных случаях или при септическом состоянии, когда костный дефект нельзя вылечить укорочением. Этот метод позволяет избежать микрохирургии, и количество доступной губчатой кости может быть единственным пределом на этом уровне.
Первый этап состоит из помещения в дефект цементного спейсера, который отвечает за формирование индуцированной мембраны. Основная роль спейсера - механическая, поскольку он предотвращает инвазию фиброзной ткани в соответствующий участок костного дефекта. Вторая роль - биологическая, связанная с индукцией окружающей мембраны, которая реваскуляризирует костный трансплантат и предотвращает остеолизис. Далее следует реконструкция дефекта с помощью аутологичного губчатого костного трансплантата, в то время как мембрана, индуцируемая спейсером, предотвращает резорбцию трансплантата.
Однако, при всем многообразии литературных данных на эту тему, нет чёткой формулировки сроков проведения второго этапа операции, до конца остается неясной гистологическая структура мембраны на разных сроках её образования. Исследование in vitro продемонстрировало, что индуцированная мембрана, образующаяся после первого этапа костной пластики, представляет собой сильно васкуляризованную оболочку, способствующую секреции остеоиндуктивных факторов [4].
Сохранение данной мембраны является основным ключом к успешному проведению костной пластики [5], так как без нее костные трансплантаты размером более 4–6 см подвергаются лизису [6]. До сих проводятся исследования с целью изучения сроков созревания индуцированной мембраны [7]. Фундаментальные научные исследования показали, что факторы, связанные с регенерацией и анаболизмом костной ткани, достигают пика внутри мембраны на сроке 4-8 недель [4].
Однако, в существующих моделях краевого костного дефекта трубчатой кости при проведении костной пластики отсутствует унифицированный подход, что затрудняет воспроизводимость результатов и накладывает определенные ограничения [8, 9]. Для получения достоверных сравнительных данных и воспроизводимости экспериментальной модели необходимо унифицировать локализацию и размер дефекта. Поэтому возникла потребность разработки экспериментальной модели краевого дефекта трубчатой кости при проведении двухэтапной костной пластики с целью дальнейшего изучения образованной остеоиндуцированной мембраны, а также для перспективы оценки свойств новых остеопластических материалов.
Цель исследования - разработка на экспериментальных животных стандартизованной, технически легко воспроизводимой, хирургической модели дефекта трубчатой кости с образованием остеоиндуцированной мембраны для объективного гистоморфологического и иммуногистохимического определения оптимальных сроков выполнения второго этапа замещения костного дефекта.
Материалы и методы исследования. Предложенную хирургическую модель краевого дефекта апробировали на 24 кроликах породы «Серый великан» возрастом от 6 до 8 месяцев весом от 1800 до 2100 г в отделении экспериментальной хирургии с виварием ФГБОУ ВО «ПИМУ» Минздрава России в соответствии с требованиями «Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях» (Страсбург, 2014). Все манипуляции проводили в соответствии с приказом Минздравсоцразвития России № 708н от 23.08.2010 «Об утверждении правил лабораторной практики». Исследование было одобрено локальным этическим комитетом ФГБОУ ВО «ПИМУ» Минздрава России, протокол № 16 от 21.10.2022.
Экспериментальных животных содержали в стандартных условиях вивария в клетках при свободном доступе к пище и воде. В условиях операционной хирургический доступ под наркозом осуществляли по медиальной поверхности проксимальной метаэпифизарной области большеберцовой кости продольным разрезом с послойным рассечением кожи, подкожной клетчатки, фасции длиной 3 см (рис. 1а). Края раны разводили ранорасширителем. Распатором Фарабефа скелетировали большую берцовую кость на площади 2×1 см с иссечением надкостницы. Фрезой диаметром 4,0 мм вдоль оси кости формировали дефект кортикального слоя и губчатого вещества размерами 8,0 × 2,0 мм, глубиной 2,0 мм (рис. 1б). В область костного дефекта, не заходя за края кортикальной пластинки, помещали костный цемент (рис.1в, 1г). Далее проводили обработку раны и её послойное ушивание.
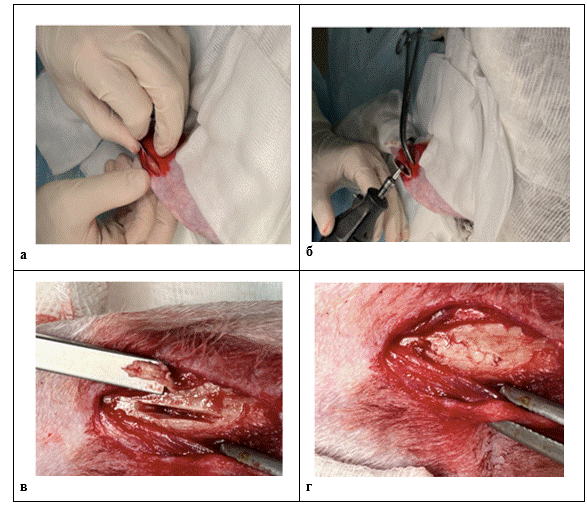
Рис. 1. Этапы эксперимента на кроликах, где:
а) разрез по медиальной поверхности проксимальной части большеберцовой кости, скелетирование участка надкостницы 2×1 см, б) формирование дефекта (8×2×2 мм), в, г) введение костного цемента. ( фото авторов)
Выведение животных из эксперимента осуществляли путем проведения воздушной эмболии под наркозом (золетил+ксилавет) через 14 и 28 суток после начала формирования дефекта. Экспериментальный материал фиксировали в растворе нейтрального 10% формалина. Костную ткань подвергали декальцинации в бескислотном растворе (Milestone, Италия). Гистологическую проводку осуществляли на аппарате Excelsior ES (Thermo Scientific, СШA), общее время проводки - 18 часов (двойная фиксация образцов в 10% забуференном нейтральном формалине, обезвоживание в пяти порциях абсолютного изопропилового спирта, пропитка в трёх порциях парафина при температуре 60оС). После проводки изготавливали парафиновые блоки с использованием заливочной станции HistoStar (Thermo Scientific, СШA). Срезы толщиной от 2 до 4 мкм получали на микротоме Microm HM 325 (Thermo Scientific, СШA) и окрашивали гематоксилином и эозином и трихромом по Массону при помощи станции для окраски Gemini AS (Thermo Scientific, СШA).
Результаты исследования и их обсуждение. У всех 24 животных раны зажили первичным натяжением. Нарушений функции оперированных конечностей в послеоперационном периоде не наблюдалось. Сразу после выведения из наркоза животные свободно передвигались в течение всего периода наблюдения. Животных выводили из эксперимента в сроки 14 и 28 суток после операции. В области вмешательства обнаруживали подвижную, не спаянную с подлежащими тканями кожу. Нагноения раны или остеомиелита не отмечалось ни в одном случае. При проведении вскрытия область дефекта кости была легко доступна препарированию. При проведении макроскопического исследования экспериментального материала на 14-е сутки после начала эксперимента в образцах определяли наличие тонкой мембраны розового цвета, гладкой, блестящей, располагающейся над зоной дефекта, свободно препарируемой. На сроке 28 суток после начала эксперимента в макропрепаратах мембрана была сформированная, серого цвета, гладкая, блестящая, плотно прилегающая к подлежащим тканям. При морфологическом исследовании экспериментального материала установлено, что остеоиндуцированная мембрана состояла из васкуляризированного матрикса на основе коллагена, однако в зависимости от сроков созревания мембраны интенсивность её васкуляризации, либо развития соединительной ткани различались. На 14 день после начала эксперимента новообразованная мембрана была представлена тонкими коллагеновыми волокнами с небольшим количеством сосудов (рис. 2а, б). Через 28 дней после первого этапа оперативного вмешательства происходило формирование остеоиндуцированной мембраны, представленной нежноволокнистой соединительной тканью с большим количеством новообразованных кровеносных сосудов (рис.2 в, г).
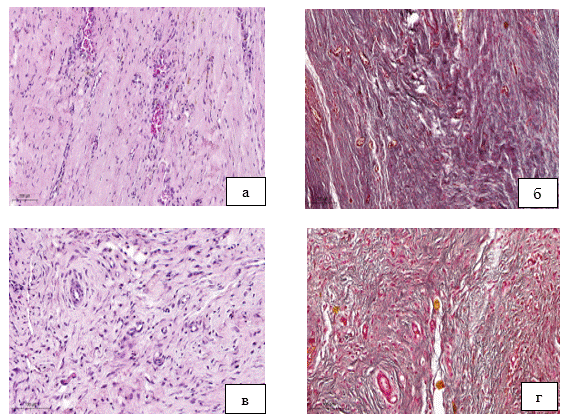
Рис. 2. Результаты эксперимента:
а) фрагмент остеоиндуцированной мембраны, состоящий из коллагеновых волокон с небольшим количеством сосудов, 14 суток от начала эксперимента, окраска гематоксилином и эозином, Х200. б) фрагмент остеоиндуцированной мембраны, коллагеновые волокна, 14 суток от начала эксперимента. Окраска трихром по Массону, Х200. в) фрагмент остеоиндуцированной мембраны, состоящий из коллагеновых волокон большим количеством новообразованных кровеносных сосудов, 28 суток от начала эксперимента, окраска гематоксилином и эозином, Х200. г) фрагмент остеоиндуцированной мембраны, коллагеновые волокна, 28 суток от начала эксперимента, окраска трихром по Массону, Х200 (фото авторов)
Анализируя данные литературы, посвященные изучению индуцированной мембраны, и результаты, полученные в ходе создания экспериментальной модели дефекта трубчатой кости, остеоиндуцированная мембрана имеет вид тонкого, белёсоватого цвета тяжа, плотно прилегающего к поверхности спейсера. Микроскопическое исследование показывает, что мембрана состоит из нежноволокнистой фиброзной ткани, внутренняя часть которой содержит фрагменты синовиальной оболочки, а внешняя часть — фибробласты, миофибробласты и коллаген. Также в структуре мембраны присутствуют факторы роста: костный морфогенетический белок, трансформирующий фактор эндотелия сосудов, ангиогенный фактор Виллебранда и CD31 [10, 11]. В проведенном исследовании авторы ограничились лишь обзорными окрасками, однако показали, что остеоиндуцированная мембрана при использовании предлагаемой модели формируется в определенные сроки и обладает необходимыми гистологическими характеристиками для создания благоприятных условий дальнейших репаративных процессов без риска рассасывания аутотрансплантата на следующем этапе реконструкции дефекта.
Заключение. В результате проведенного исследования было установлено, что предлагаемая модель является воспроизводимой и основана на хирургическом формировании дефекта трубчатой кости при проведении двухэтапной костной пластики. Разработанная модель обеспечивает формирование дефекта трубчатой кости с формированием остеоиндуцированной мембраны, что подтвердило гистологическое исследование на различных сроках эксперимента.
Библиографическая ссылка
Рассихин Н.Е., Королев С.Б., Зыкин А.А., Орлинская Н.Ю., Живцов О.П., Алыев Р.В., Кулакова К.В. РАЗРАБОТКА ЭКСПЕРИМЕНТАЛЬНОЙ МОДЕЛИ КРАЕВОГО ДЕФЕКТА ТРУБЧАТОЙ КОСТИ ПРИ ПРОВЕДЕНИИ ДВУХЭТАПНОЙ КОСТНОЙ ПЛАСТИКИ С ОБРАЗОВАННОЙ ОСТЕОИНДУЦИРОВАННОЙ МЕМБРАНОЙ // Современные проблемы науки и образования. 2025. № 1. ;URL: https://science-education.ru/ru/article/view?id=33958 (дата обращения: 23.01.2026).
DOI: https://doi.org/10.17513/spno.33958



