Введение
Диета с лимитом калорийности является наиболее эффективным нефармакологическим способом поддержания метаболического здоровья [1, 2]. Злокачественные новообразования тесно связаны со старением и возрастной смертностью. Нет полного понимания в области влияния диет и, в частности, диеты с ограничением калорийности на развитие различных видов опухолей [3]. Снижение потребления калорий уменьшает факторы риска и задерживает возникновение новообразований за счет изменения метаболизма и улучшения характеристик, влияющих на здоровье, включая усиление аутофагии и чувствительности к инсулину, снижение уровня глюкозы в крови, уменьшение выраженности воспаления, процессов ангиогенеза и передачи сигналов факторов роста. Будущие исследования и клинические испытания необходимы для полного понимания биохимической основы ограничения калорийности питания [4, 5]. Важнейшим направлением современных исследований является изучение молекулярных механизмов, задействованных в эффектах ограничения калорийности питания, что может вывести на новые направления терапии опухолевых процессов и послужить основой для разработки персонализированного подхода «еда как лекарство» для здорового старения.
Меланома – это злокачественная опухоль, которая лидирует по количеству смертей во всем мире, поскольку является наиболее устойчивой к современным методам лечения [6]. В структуре заболеваемости злокачественные новообразования кожи занимают одно из ведущих мест в ряде стран мира и в Российской Федерации. Ряд авторов выявили положительное влияние лимитирующих диет при злокачественных новообразованиях и, в частности, при меланоме [7].
Цель исследования
Оценка и анализ влияния диеты с лимитом калорийности и диеты «питание без ограничений» на ориентировочно-исследовательский компонент поведенческих характеристик мышей с экспериментальной меланомой В16.
Материал и методы исследования
В экспериментальной модели были использованы половозрелые мыши-самки линии С57Bl/6 в возрасте 7–8 недель со средней массой тела 16,5 г. Животные были предоставлены НИЦ «Курчатовский институт» «ПЛЖ «Рапполово». Исследование одобрено этическим комитетом ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России (протокол № 119 от 07.06.2023 г.).
В результате рандомизации были сформированы следующие группы (по 10 особей в каждой группе):
группа «а» – контрольная – питание ad libitum (питание без ограничений калорийности – базовая диета);
группа «б» – контрольная группа на диете с 30%-ным лимитом калорийности в течение 3 месяцев;
группа «в» – опытная – питание ad libitum (питание без ограничений калорийности – базовая диета) с трансплантацией клеток экспериментальной меланомы В16;
группа «г» – опытная группа на диете с 30%-ным диетическим лимитом по калорийности в течение 3 месяцев с трансплантацией клеток экспериментальной меланомы В16.
Все животные содержались в индивидуальных клетках при естественном освещении с неограниченным доступом к воде. Животные групп «а» и «в» имели нелимитированный доступ к еде (питание вволю – ad libitum). Питание животных групп «б» и «г» осуществлялось в режиме ограничения калорийности из расчета 70% от диеты, удовлетворяющей физиологические потребности животных, с учетом массы тела животных в течение 3 месяцев. Для питания животных всех групп использовался полнорационный сухой гранулированный корм для содержания лабораторных мышей «ЧАРА» (ООО «Фаворит», Россия). Группам животных «в» и «г» через 3 месяца была произведена трансплантация клеток меланомы. Для воспроизведения модели меланомы линии B16 вводили подкожно в боковую поверхность живота 1x106 суспензии клеток до формирования солидной опухоли в размере 20 мм. Культура клеток меланомы была любезно предоставлена ФГБНУ «НИИ фундаментальной и клинической иммунологии». Формирование опухолевого узла происходило в течение 15 суток после имплантации клеток меланомы [8].
Для оценки ориентировочно-исследовательской активности животных использовался тест «Открытое поле». Установка представляет собой открытую арену диаметром 63 см с высотой бортиков по периметру 30 см (производство НПК «Открытая Наука», РФ). Поверхность арены разделена на центральную (диаметр 32 см) и периферическую зоны. Животные проходили тестирование дважды. Каждая сессия длилась 8 минут. Регистрацию количеств пересечений границ центральной зоны, временных интервалов и интервалов преодоленного расстояния в центральной зоне осуществляли с помощью видеозаписи. Обработку информации производили с использованием программного обеспечения ANY-MAZE [7].
Экспериментальные данные обрабатывали с помощью пакета прикладных программ Microsoft Office Excel 2019. Определяли средние значения, доверительный интервал и ошибку среднего. Статистическую значимость различий между выборками оценивали с помощью критерия Манна–Уитни. Статистически значимым считали различие при p<0,05.
Результаты исследования и их обсуждение
Первая сессия экспериментов была проведена с группами контрольных мышей «а» и «б», которые находились на диете питание ad libitum (базовая диета) и на диете с ограничением калорийности питания соответственно. Вторая сессия была проведена для групп мышей «в» и «г» с перевитой экспериментальной меланомой В16, которые соответственно находились на базовой диете и на диете с ограничением калорийности питания.
Сравнение результатов исследований осуществляли между группами мышей «а» и «б», то есть между группами на диете без лимита по калорийности пищи (основная диета) и на лимитирующей по калорийности диете. Группам мышей «в» и «г» была осуществлена трансплантация клеток меланомы, также эти группы имели различия в диете. Группа мышей «в» получала неограниченный доступ к пище (ad libitum), тогда как группа «г» имела питание, лимитируемое по калорийности.
При помещении животного в освещенное пространство установки «Открытое поле» инициируется стресс, и мышь стремится занять положение у бортика круглой арены, проявляя тревожность в виде эпизодов замирания. Исследовательская активность проявляется продвижением животного по арене в первое время теста по внешним секторам, по мере уменьшения стресса животное начинает исследовать центральную зону арены.
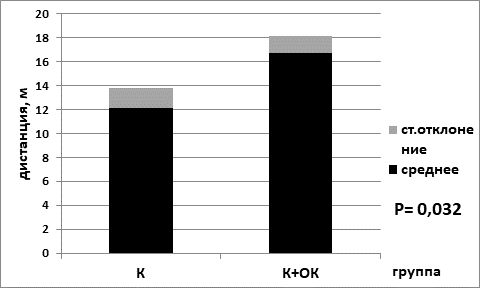
Рис. 1. Интервалы преодоленного расстояния в центральной области установки в группе «а» на базовой диете (К) и в группе «б» на лимитирующей по калорийности диете (К+ОК). Обозначения: К – контрольная группа; К+ОК – контрольная группа (К) на ограничении калорийности питания (ОК)
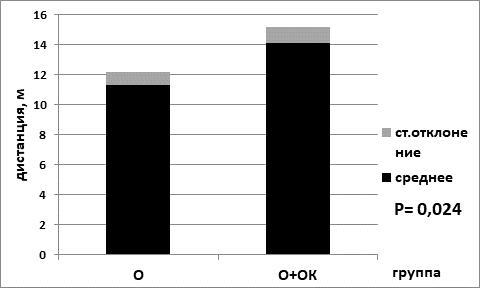
Рис. 2. Интервалы преодоленного расстояния в центральной области установки в группе мышей с опухолью «в» на базовой диете (О) и в группе мышей с опухолью «г» на лимитирующей по калорийности диете (О+ОК).
Обозначения: О – опытная группа с опухолью; О+ОК – опытная группа с опухолью (О) на ограничении калорийности питания (ОК)
При проведении данного теста можно сделать заключение об основных аспектах поведения – исследовательской активности, которая выражается в предпочтении исследовать преимущественно периферическую или центральную зону арены. Другим аспектом поведения является оценка тревожности поведения по тенденции оставаться вблизи ограничительного бортика арены (тигмотаксис) и, соответственно, снижению времени нахождения в центральной зоне арены [9].
Интервалы преодоленного расстояния в центральной области арены, согласно полученным результатам, были статистически значимо выше для контрольных групп животных на диете с лимитом калорийности. Для группы «а» значения составили 16,7±1,4; для группы контроля «б» – 12,1±1,7; р=0,032 по критерию Манна–Уитни (рис. 1). Интервалы преодоленного расстояния для животных с экспериментальной меланомой В16 в центральной области установки были выше опять же для группы с лимитирующей диетой. Для группы «в» значения составили 14,1±1,1, для группы «г» – 11,3±0,9; р=0,024 по критерию Манна–Уитни (рис. 2).
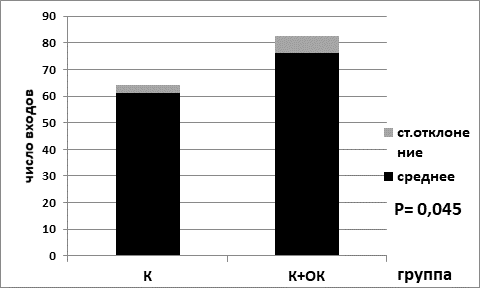
Рис. 3. Количество пересечений границы центральной области арены в контрольной группе на диете ad libitum (К) и в контрольной группе на лимитирующей по калорийности диете (К+ОК). Обозначения: К – контрольная группа; К+ОК – контрольная группа (К) на ограничении калорийности питания (ОК)
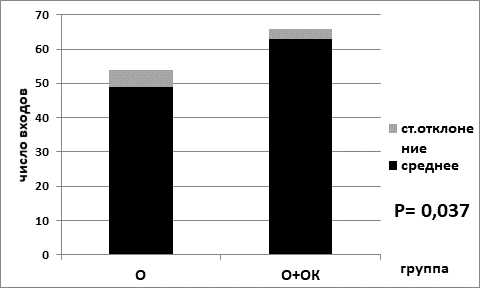
Рис. 4. Количество пересечений границы центральной области арены в опытной группе на диете ad libitum (О) и в опытной группе на лимитирующей по калорийности диете (О+ОК). Обозначения: О – опытная группа с опухолью; О+ОК – опытная группа с опухолью (О) на ограничении калорийности питания (ОК)
Статистически значимая разница показателей «количество пересечений границы центральной области установки» зафиксирована для контрольных групп «а» и «б» с отличиями в диетах. Для группы с диетой ad libitum (рис. 3) показатель составил 62,0±3,21, тогда как для группы с лимитирующей по калорийности диетой показатель был выше и составил 76,0±6,5 (согласно критерию Манна–Уитни р=0,045). Показатели по количеству пересечений границы центральной области арены для групп опытных животных с экспериментальной меланомой демонстрировали аналогичную закономерность. Мыши группы «г» на лимитирующей по питанию диете с опухолевым процессом имели статистически значимо более высокий показатель – 63,0±2,76, чем мыши группы «в» на диете питание ad libitum – 49,0±5,01 (согласно критерию Манна–Уитни р=0,002) (рис. 4).
Однако для показателя «временной интервал пребывания в центральной области арены» статистически значимой разницы для контрольных групп с различиями в диете не зафиксировано. Показатель для группы «а» составил 136,0±25,05, для группы «б» – 145,0±24,07. Для опытных групп животных также не зафиксировано статистически значимой разницы показателей для животных на диете питание ad libitum (129,0±19,1) и для животных на лимитирующей по калорийности диете (135,0±21,07).
Резюмируя полученные закономерности, можно сделать вывод, что применение лимитирующей по калорийности диеты в группах контрольных мышей и в группах животных с опухолевым процессом приводило к положительным изменениям ориентировочно-исследовательской активности животных по показателям «интервалы преодоленного расстояния в центральной области установки» и «количество пересечений границы центральной области установки». Более высокие значения показателей пересечения границ центральной зоны арены для групп животных на лимитирующих по калорийности диетах позволяют сделать заключение о существенно более низких уровнях тревожности и беспокойства этих групп мышей, тогда как у животных, находящихся на базовой диете, отмечалась специфическая траектория с преобладанием перемещения по периферическим зонам арены. Сообщается, что ограничение калорийности питания можно рассматривать как стрессогенный фактор для организма, который переключает метаболические процессы в пользу снижения секреции инсулина, гормонов щитовидной железы и лептина, а кроме того, повышает эффективность использования энергии митохондрий [10]. Группой авторов обнаружен интересный факт, заключающийся в том, что при наложении двух стрессогенных ситуаций (первая из которых – рестрикция питания, вторая – кратковременная иммобилизация крыс) никаких дополнительных эффектов на изучаемые параметры (изменение веса надпочечников и тимуса, повышение уровня кортикостерона в плазме, уровня перекисного окисления липидов в печени и сердце) не выявлено. Следовательно, дополнительная стрессогенная ситуация, помимо рестрикции питания, а именно помещение мышей в освещенную открытую арену в исследовании авторов, приводила к выраженному более низкому уровню тревожности и беспокойства по сравнению с животными на базовой диете. Адаптационные перестройки метаболических процессов в пользу стрессоустойчивости проявились большей приспособленностью животных к дополнительной новой стрессогенной ситуации при применении лимитирующей по калорийности диеты. Обращают на себя внимание данные о том, что ограничение калорийности питания способствует эндотелийзависимой вазодилатации путем активации эндотелиальной синтазы оксида азота (eNOS – endothelial nitric oxide synthase) и повышения уровня оксида азота (NO) посредством множественных каскадов, включающих модуляцию окислительного стресса, аутофагии и воспаления [11, 12]. И это тоже может указывать на компенсаторные сдвиги в регуляторных процессах кровообращения и сердечной деятельности при режиме ограничения калорийности на дополнительный стрессовый стимул. Также имеются исследования влияния ограничения калорий на когнитивные функции [13]; и опять же, авторы свидетельствуют об улучшении рабочей памяти, физической активности и показателей расхода энергии. B.C. Jarvie и соавторы показали в исследовании на мышах, что ГАМК-эргический фенотип проопиомеланокортиновых нейронов (РОМС-нейронов) чувствителен к энергетическому состоянию и изменяется при дефиците калорий [14]. Таким образом, исследования авторов укладываются в модель представлений о включении программ сторессоустойчивости как у контрольных групп мышей, так и у опытных с трансплантацией опухоли В16 при диете с ограничением калорийности питания. Кроме того, можно предполагать включение адаптивных программ при диете с рестрикцией питания для восприятия нового стрессогенного фактора, а именно тестирования испытуемых животных в установке «Открытое поле». На рисунке 5 приведены треки движения мышей при исследовании ориентировочно-исследовательской активности. На первом слайде видно, что мышь предпочитает оставаться на периферии арены, тогда как на втором слайде очевидными являются перемещения животного и по центральным зонам арены.

Рис. 5. Трек перемещений и нахождения животного по зонам арены для мыши из группы «а» и мыши из группы «б» на лимитирующей диете
Следует отметить, что опухолевый процесс оказывал влияние на уровни тревожности и беспокойства животных, о чем можно судить по тенденции к снижению показателей «интервалы преодоленного расстояния в центральной области установки» и «количество пересечений границы центральной области установки» в группах мышей с опухолевым процессом. Однако то, что рестрикция питания так существенно влияла на данные показатели, указывает на благоприятные изменения в организме животных не только без опухолевого процесса, но и с экспериментальной меланомой В16.
Заключение
Существенно более низкие уровни тревожности и беспокойства как компоненты ориентировочно-исследовательского поведения мышей фиксировались при содержании животных на ограниченной по калорийности диете. Подобная закономерность прослеживалась в контрольной группе и в опытной группе с трансплантацией клеток экспериментальной меланомы В16 и развитием опухолевого процесса. Перепрограммирование метаболизма в ответ на лимитирующую по калорийности диету определяет выраженную адаптационную приспособленность как к новой стрессогенной ситуации при тестировании животных в установке «Открытое поле», так и к опухолевому процессу.
Библиографическая ссылка
Фефелова Ю.А., Сергеева Е.Ю., Полякова Т.С., Мутьев Н.С. ОРИЕНТИРОВОЧНО-ИССЛЕДОВАТЕЛЬСКАЯ АКТИВНОСТЬ МЫШЕЙ С ЭКСПЕРИМЕНТАЛЬНОЙ МЕЛАНОМОЙ В16 НА ДИЕТЕ С 30% ОГРАНИЧЕНИЕМ КАЛОРИЙНОСТИ // Современные проблемы науки и образования. 2025. № 1. ;URL: https://science-education.ru/ru/article/view?id=33944 (дата обращения: 23.01.2026).
DOI: https://doi.org/10.17513/spno.33944



