Введение
Эпителий относится к активно делящимся тканям в организме с высокой естественной способностью к обновлению и регенерации при повреждении [1].Эта способность играет ключевую роль для создания защитного барьера нижележащих тканей от внешней среды.Уникальная способность слизистой оболочки органов полости рта к регенерации обусловлена как пластичностью эпителиальных стволовых клеток, так и значимым вкладом фибробластов в синтез адгезивных белков межклеточного матрикса [2]. После повреждения тканей в слизистой оболочке полости рта наблюдается комплекс воспалительных, пролиферативных, микроциркуляторных реакций, ремоделирование тканевых структур и клеточных субпопуляций [2]. В последнее время при наращивании кости альвеолярных отростков челюстей в предимплантационный период, заживлении раны на послеоперационном этапе дентальной имплантации, хирургическом лечении пародонтита с помощью клеточной терапии в сочетании с биоинженерией стимулируются процессы остеогенеза, регенерации мягких и твердых тканей пародонта [3]. При этом вовлекается ряд механизмов, которые одновременно могут стимулировать как заживление тканей, восстановление утраченных структур, так и способствовать канцерогенезу [4]. Регенерация тканей и онкогенез во многом сходны. Безусловно, при онкогенезе имеются отличительные черты: гиперпролиферация, нарушение деления клеток, накапливание мутаций в активно делящихся клетках [4]. В связи с этим в научных исследованиях активно изучаются подходы регенеративной медицины, которые позволяют управлять обновлением и ростом тканей без усиления риска развития неопластических процессов. Такая сложная фундаментальная задача решается в большей мере за счет экспериментальных исследований на животных путем использования различных способов направленной тканевой регенерации после целенаправленного формирования дефекта тканей [5; 6]. При этом, как правило, отбираются молодые, соматически здоровые животные. Оценить, как изменяются онкологические риски при таком стандартном подходе к организации экспериментальных исследований, не представляется возможным. В медицине формируется острая потребность в разработке пациентоориентированных методов оценки онкологических рисков в области головы и шеи, регенерационного потенциала при ранозаживлении, способности к активации остеогенеза при повреждении костных структур челюстей. Помочь в этом вопросе может исследование в различных клинических ситуациях эффективности проведения щеточной биопсии слизистой оболочки органов полости рта пациентов с последующим использованием цитологических и генетических методов исследования биологического материала.
Целью работы явилось разработать метод комплексной оценки онкологических рисков органов головы и шеи и регенерационного потенциала местных тканей при щеточной биопсии слизистой оболочки органов полости рта у пациентов.
Материалы и методы исследования
Дизайн исследования – рандомизированное, поперечное, контролируемое. Критериями включения явились наличие онкологических заболеваний органов полости рта (языка и десны), злокачественная патология эпителия других гомологичных органов, связанных общим эмбриогенезом с органами полости рта (щитовидная железа), воспалительно-деструктивные изменения после дентальной имплантации. В качестве контроля использовали биоптаты пациентов без онкологической и воспалительно-деструктивной патологии, а также образцы слизистой при отсутствии осложнений после дентальной имплантации через 3-6 месяцев после операции. Критерии исключения – онкологические заболевания иной локализации, острые воспалительные изменения в полости рта, отсутствие добровольного информированного согласия пациентов.
Разрешение Локального этического комитета ФГБУ «НМИЦ онкологии» Минздрава России для проведения научного исследования получено с информированного добровольного согласия пациентов.
Тест на онкогенные мутации клеток слизистой оболочки органов полости рта и оценка экспрессионной активности фибронектина как протеина межклеточного матрикса и белкамини-хромосомной защиты 5(МСМ5) в качестве маркера активности пролиферации эпителия были проведены в пилотном исследовании в различных клинических ситуациях у 165 пациентов обоего пола в возрасте 18-75 лет. Биологический образец ткани был получен при щеточной биопсии стандартными одноразовыми браш-щетками на ручке (Wilson Instruments Co. Ltd.,Китай). Щетку поворачивали несколько раз по часовой стрелке и помещали в стабилизирующий буфер. Выделение тотальной ДНК из буфера осуществляли посредством набора для очистки ДНК QIAamp DNA micro (Qiagen, США) и тотальной РНК с помощью набора RNeasy (Qiagen, США) в соответствии с инструкциями производителя с последующим определением количества и качества.
В клетках слизистой оболочки полости рта методом мультиплексной полимеразной цепной реакции (ПЦР) определяли наличие мутаций генов BRAF, NRAS, HRAS, KRAS, хромосомных перестроек RET/PTC и PAX8/PPARG, а также оценивали экспрессию матричной РНК (мРНК) для синтеза белков фибронектина и МСМ5. В работе использовались методы ПЦР с обратной транскрипцией и количественной ПЦР в реальном времени, реагенты для которых были предоставлены Thermo Fisher Scientific (США) и «Альгимед-Техно» (Беларусь).
Клетки лизировали с помощью раствора реагента TRIzol (Thermo Fisher Scientific, США). ПЦР с обратной транскрипцией кодирующей ДНК (кДНК) проводили с помощью наборов высокой емкости, термоциклера CFX96 (BioRad, США) при 25°C в течение 5 мин., 37°C в течение 2 часов и 85°C в течение 5 мин.
Для количественной ПЦР в реальном времени использовали 96-луночные планшеты MicroAmp и набор с последовательностями коммерческих праймеров Thermo Fisher Scientific (США). В качестве референтного гена выступал ген GAPDH. Количественную ПЦР проводили в конечном объеме 20 мкл на образец (4 мкл кДНК, 0,6 мкл прямых и обратных праймеров, 10 мкл Power SYBR Green Master-Mix и 4,8 мкл контрольной среды).Относительную количественную оценку экспрессии рассчитывали с помощью сравнительного метода∆Ct(Ct - порог цикла, ΔCt =Ctцелевого гена минусCtреферентного гена (GAPDH)).
Статистический анализ результатов проводили с помощью программ Statistica 12.0 (StatSoft, США) и MedCalc 19.6 (Software Ltd, США). Количественные показатели характеризовали с помощью медианы и межквартильного диапазона. Количественные показатели между группами сравнивали с помощью критерия Манна-Уитни, а частотные -путем использования критерия Хи-квадрата Пирсона с поправкой Йетса на непрерывность. Критический уровень значимости составлял 0,05. Диагностическую информативность биопсии оценивали путем расчета чувствительности, специфичности и точности теста.
Результаты исследования и их обсуждение
Диагностическая информативность щеточной биопсии слизистой оболочки органов полости рта изучена у пациентов с верифицированными онкологическими заболеваниями и воспалительно-деструктивными изменениями. При этом молекулярно-генетическое исследование проводили у пациентов с эпителиальным раком языка и десен, а также с папиллярным раком щитовидной железы. Эмбриогенез корня языка и щитовидной железы общий [7]. Слепое отверстие на корне языка является следом впячивания дна глотки, где закладывается щитовидная железа, это остаток эмбрионального щитоязычного протока. В связи с этим корень языка и щитовидная железа являются гомологичными органами [8]. Структура патологии, локализация взятия щеточных биоптатов отражены в таблице 1.
Таблица 1
Структура патологии, число больных и локализация взятия щеточных биоптатов слизистой оболочки органов полости рта
|
Структура патологии |
Шифр заболевания по МКБ |
Локализация для взятия биоптатов |
Число больных |
|
Злокачественные новообразования языка |
СО2 |
Корень языка |
31 |
|
Злокачественные новообразования десны |
СО3 |
Альвеолярный отросток челюстей |
18 |
|
Папиллярный рак щитовидной железы
|
С73 |
Корень языка в проекции слепого отверстия |
44 |
|
Периимплантит и дезинтеграция дентального имплантата |
К 10.2 |
Альвеолярный отросток челюстей в проекции имплантации |
19 |
|
Неосложненный послеоперационный период дентальной имплантации (через 3-6 месяцев после операции) |
- |
Альвеолярный отросток челюстей в проекции имплантации |
25 |
|
Контрольная группа здоровых пациентов |
- |
Корень языка и альвеолярный отросток челюстей |
30 |
При наличии мутаций в одном из исследуемых генов, способствующих канцерогенезу, генетический тест считали положительным. Частота положительного генетического теста при щеточной биопсии слизистой оболочки органов полости рта была высокой при онкологических заболеваниях: раке языка (83,9%), злокачественных новообразованиях десны (77,8%), папиллярном раке щитовидной железы (75%). При периимплантите и в двух контрольных группах положительный результат мутационного скрининга был единичным (рис.).
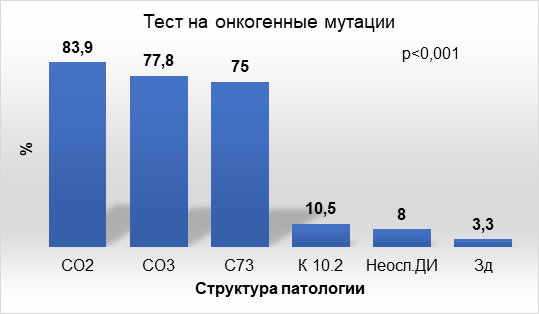
Частота положительного генетического теста при браш-биопсии слизистой оболочки органов полости рта при различных заболеваниях
Примечание: код заболевания по МКБ указан по шкале абсцисс; Неосл.ДИ – пациенты с неосложненным течением дентальной имплантации; Зд – контрольная группа здоровых пациентов; р – доверительный уровень значимости множественного различия.
Эффективность оценки онкогенного риска с помощью генетического теста на мутации в сигнальных путях канцерогенеза при исследовании щеточных биоптатов слизистой полости рта была высокой при всех изучаемых онкологических заболеваниях (табл. 2).
Таблица 2
Информативность генетического теста на онкогенные мутации при щеточной биопсии слизистой оболочки органов полости рта при онкологической и воспалительно-деструктивной патологии
|
Структура патологии |
ДЧ |
ДС |
ДТ |
ППЦ |
AUC |
|
Злокачественные новообразования языка |
83,9 |
96,7 |
90,2 |
96,3 |
0,903 |
|
Злокачественные новообразования десны |
77,8 |
96,7 |
89,6 |
93,3 |
0,872 |
|
Папиллярный рак щитовидной железы |
75,0 |
96,7 |
83,8 |
97,1 |
0,858 |
|
Периимплантит
|
10,5 |
92,0 |
56,8 |
50,0 |
0,513 |
Примечания: ДЧ – диагностическая чувствительность, ДС – диагностическая специфичность, ДТ – диагностическая точность, ППЦ – положительная предсказательная ценность, AUC – площадь под ROC-кривой.
Отличие параметров информативности теста при онкологических и воспалительно-деструктивных заболеваниях свидетельствовало о высокой специфичности проводимого теста (табл. 2).
Экспрессионная активность мРНК для синтеза адгезивного белка межклеточного матрикса фибронектина была высокой при онкологических заболеваниях и низкой в локусе развития воспалительно-деструктивных изменений (табл. 3).
Таблица 3
Экспрессионная активность мРНК фибронектина и МСМ5 в браш-биоптатах слизистой оболочки органов полости рта в различных клинических ситуациях
|
Структура патологии |
Экспрессия мРНК для синтеза фибронектина Me [25-75] |
Экспрессия мРНК для синтеза МСМ5 Me [25-75] |
|
Злокачественные новообразования языка |
2,57 [2,11-3,29] р1=0,0001 |
3,42 [3,05-3,86] р1<0,001 |
|
Злокачественные новообразования десны |
2,18 [1,82-2,44] р1=0,003 |
4,91 [3,98-5,84] р1<0,001 |
|
Папиллярный рак щитовидной железы |
1,74 [1,53-2,05] р1=0,008 |
2,03 [1,67-2,45] р1=0,006 |
|
Периимплантит |
0,62 [0,43-0,78] р2=0,003 |
1,17 [0,89-1,26] р2=0,48 |
|
Неосложненный послеоперационный период дентальной имплантации |
1,04 [0,89-1,18] |
1,09 [0,93-1,18] |
|
Контрольная группа здоровых пациентов |
1,11 [0,93-1,22] |
0,97 [0,85-1,09] |
Примечание: Me – медиана; [25-75] – межквартильный диапазон; р1 – уровень значимости отличия от контрольной группы; р2 – уровень значимости отличия от пациентов с неосложненным послеоперационным периодом дентальной имплантации.
Как известно, адгезивные белки, включая фибронектин, повышают способность опухолевых клеток к инвазии и миграции, а, с другой стороны, при воспалительных изменениях обеспечивают кооперативность и слаженность деятельности клеток при регенерации тканей после повреждения [9]. Разнонаправленность экспрессии белка фибронектина может помочь сформировать заключение о высокой миграционной активности раковых клеток и низком регенерационном потенциале тканей. При отсутствии канцерогенных мутаций и низкой экспрессии фибронектина в ткани у пациентов после дентальной имплантации можно рекомендовать обоснованное применение стимуляторов регенерации и остеогенеза. Экспрессия белка МСМ5 как маркера пролиферации эпителия [10] была выше при онкологических заболеваниях и значимо не повышалась при воспалительно-деструктивной патологии, что свидетельствовало об эффективности щеточных биоптатов как среды для местного контроля пролиферативной активности.
Таким образом, щеточная биопсия слизистой оболочки органов полости рта представляет собой перспективную методику сбора биологических образцов, генетическое исследование которых позволяет одновременно оценить риск развития онкологических заболеваний органов, включая гомологичных, и местный регенерационный потенциал клеток.
Заключение
Генетические исследования биологических образцов, полученных при щеточной биопсии слизистой оболочки органов полости рта, позволяют с высокой эффективностью оценить риски развития онкологических заболеваний и определить локальную экспрессионную активность маркеров пролиферации и адгезивных белков при контроле регенерации эпителия после повреждения.
Библиографическая ссылка
Альникин А.Б., Амхадов И.С., Максимов А.Ю., Щепляков Д.С., Демидова А.А. НОВЫЕ ДИАГНОСТИЧЕСКИЕ ВОЗМОЖНОСТИ ЩЕТОЧНОЙ БИОПСИИ СЛИЗИСТОЙ ОБОЛОЧКИ ОРГАНОВ ПОЛОСТИ РТА // Современные проблемы науки и образования. 2025. № 1. ;URL: https://science-education.ru/ru/article/view?id=33884 (дата обращения: 26.01.2026).
DOI: https://doi.org/10.17513/spno.33884



