Введение
Синоназальные папилломы – группа доброкачественных, относительно редко встречающихся опухолей синоназального тракта с различным клиническим течением. В современной классификации ВОЗ принято выделять три подтипа: наиболее часто встречающийся инвертированный тип (ИСП), онкоцитарный (ОСП) и экзофитный (ЭСП). Первые два являются клинически более агрессивными, с наличием местно-деструирующего роста, частыми рецидивами и определенной способностью к малигнизации; экзофитный же тип, как правило, не рецидивирует, имеет экзофитный характер роста, случаи малигнизации описаны не были. Несмотря на это, все три подтипа синоназальной опухоли относятся к группе синоназальных папиллом [1, с. 140].
В последнее время появилась концепция о том, что различные типы синоназальных папиллом – это не варианты одной опухоли, а скорее отдельные опухоли. Так, ОСП показываетKRAS-мутации, патогенез ИСП связан сEGFR-мутациями; а ЭСП тесно ассоциирована с инфекцией, вызванной вирусом папилломы человека (ВПЧ) низкого риска злокачественности [2, 3].
ГенKRASпринадлежит к семейству малых гуанозинтрифосфатаз (ГТФаз) – Ras.KRASимеет два близкородственных паралога,HRASиNRAS, все три гена относительно часто мутируют при различных раках человека.Так, мутация KRASобнаруживается примерно в 85 % рака поджелудочной железы, в 45 % колоректальных аденокарцином, в 30 % аденокарцином легких и с более низкой частотой в широком спектре других типов опухолей [4]. Подавляющее большинство нарушений в генах семейства Ras представляют собой мутации в трех «горячих точках» G12, G13 и Q61.Мутация Ras часто является биомаркером, связанным с плохим прогнозом и плохим ответом на таргетную терапию.Таким образом, решение проблемы мутаций KRAS гена является приоритетным направлением исследований рака [5].
Сигнальный путь и молекулярная биология Ras генов были относительно недавно подробно изучены [6]. KRAS, HRAS и NRAS представляют собой белки периферической мембраны, имеющие общий высокогомологичный G-домен, который содержит каталитический сайт ГТФазы, и два региона, которые претерпевают конформационные изменения при обмене гуанозиндифосфат (GDP)/ гуанозинтрифосфат (GTP).С-конец этих белков расходится, и KRAS может подвергаться альтернативному сплайсингу с образованием двух изоформ KRAS4A и KRAS4B с различными последовательностями С-конца.Посттрансляционная модификация белков Ras на их С-конце с помощью ряда ферментов приводит к их фарнезилированию (HRAS, NRAS, KRAS4A и KRAS4B) и пальмитоилированию (HRAS, NRAS и KRAS4A).Эти липидные присоединения позволяют Ras связываться с плазматической мембраной и другими эндомембранными компартментами клетки и необходимы для функционирования Ras.
Активность белков семейства Ras контролируется эпидермальным фактором роста, различными цитокиновыми и гормональными рецепторами.Активация рецептора фактора роста стимулирует обмен GDP-GTP на Ras, чему способствует семейство факторов обмена гуаниновых нуклеотидов (GEF), которые рекрутируются в адаптерные белки, связывающие рецептор.GTP-связанный Ras претерпевает конформационные изменения, которые позволяют его областям переключения I и II взаимодействовать и активировать ряд нижестоящих эффекторных белков.Последующий гидролиз GTP под действием Ras, реакция, которая значительно ускоряется за счет его связывания с белками, активирующими ГТФаз (GAP), возвращает Ras в неактивное, связанное с GDP состояние.Вышеупомянутые мутации «горячих точек» Ras либо нарушают связывание GAP (мутации G12 и G13), либо внутреннюю активность ГТФазы (мутации Q61) Ras.Эти мутации резко сдвигают равновесие белка Ras, чтобы он существовал в основном в GTP-связанном состоянии и эффективно отсоединял белки Ras от входных сигналов вышестоящих рецепторов и направлял конститутивную передачу сигналов на нижестоящие эффекторные пути Ras [7].
Основная причина частого выбора мутаций Ras при раке заключается в том, что Ras передает сигналы множественным эффекторным путям, активация которых способствует онкогенной трансформации.К ним относятся путь MAP-киназы (MAPK), путь PI 3-киназы (PI3K)/AKT/mTOR, малые GTPases Rho, Rac и Ral и фосфолипаза C.Вместе эти пути контролируют пролиферацию и рост клеток, регулируют клеточный метаболизм, подвижность клеток и множество программ транскрипции генов.Конститутивно активируя эти пути, онкопротеин Ras обеспечивает рост, выживаемость и метастатический потенциал раковой клетки [8].
При изучении синоназальных папиллом и ассоциированных с ними карцином (c-r), в последнее время также возник интерес и к гену BRAF. Наиболее распространенной генетической мутацией является замена одного нуклеотида, которая приводит к образованию конститутивно активной киназы BRAF (BRAFV600E), та, в свою очередь, поддерживает непрерывную пролиферацию клеток. Кроме того, BRAFV600E провоцирует острое воспалительное состояние с тканеспецифическим привлечением нейтрофилов и макрофагов, а также трансдифференцировку эпителия [9].
Так, было показано наличие мутаций с низкой частотой встречаемости в ОСП, при этом мутации как KRAS, так и BRAF отсутствовали в группе синоназальных карцином [10]. В другом исследовании было показано наличие мутации гена BRAF в 15 экзоне в ИСП [11].
Цель исследования – дать сравнительную характеристику генов KRAS (2 exon, 3 exon) и BRAF (15 exon) по результатам секвенирования по Сэнгеру в ИСП и ОСП, а также ассоциированных с ними синоназальных карциномах.
Материалы и методы исследования
Объектом исследования послужили 87 случаев операционного и биопсийного материала от пациентов с различными типами синоназальных папиллом, из них 13 случаев представляли ОСП, 66 – ИСП и 5 образцов плоскоклеточного рака, ассоциированного с СП. Материал был фиксирован в 10 % забуференном формалине на протяжении 12 ч с дальнейшим изготовлением парафиновых блоков по стандартной схеме. С помощью микротома Thermo Scientific HM 340E изготовлена серия срезов толщиной 5–6 мкр с дальнейшим монтированием их на предметные стекла. Срезы окрашивались гематоксилином Майера и водно-спиртовым эозином Y по стандартному протоколу.
Секвенирование было выполнено во всех 87 случаях синоназальных папиллом, из них 13 образцов представляли ОСП, 66 – ИСП и 5 образцов плоскоклеточного рака, ассоциированного с СП. ДНК выделяли из архивных парафиновых блоков операционного и биопсийного материала. Выделение ДНК проводили с использованием набора «Экстракт ДНК FFPE» (ООО «Hомотек», Москва), согласно инструкции производителя. Концентрацию выделенной ДНК определяли методом количественной ПЦР в реальном времени с использованием тест-системы для выявления гена сурвивина человека для научного применения (ООО «Нанодиагностика», Москва).
|
Имя праймера |
Ген |
Экзон |
Последовательность праймеров (5’– 3’) |
|
BRAFex15F |
BRAF |
15 |
GTTGTAAAACGACGGCCAGTGATAATGCTTGCTCTGATAGGA |
|
BRAFex15R |
BRAF |
15 |
CGACCTTCAATGACTTTCTAGTA |
|
KRASex2F |
KRAS |
2 |
GTTGTAAAACGACGGCCAGTGGTGGAGTATTTGATAGTGTAT |
|
KRASex2R |
KRAS |
2 |
GAATGGTCCTGCACCAGTA |
|
KRASex3F |
KRAS |
3 |
GTTGTAAAACGACGGCCAGTGACTGTGTTTCTCCCTTCTC |
|
KRASex3R |
KRAS |
3 |
CATGGCATTAGCAAAGACTCA |
5’-концы прямых праймеров содержат последовательность, комплементарную праймеру для секвенирования (подчеркнуто).
Амплификацию целевых фрагментов первоначально проводили в присутствии SYBR-Green для оценки эффективности амплификации каждой пробы. По результатам этой амплификации пробы распределяли на группы с близкими пороговыми циклами. Наработку ампликонов для секвенирования проводили при оптимальном количестве циклов для каждой группы проб. Очистку ПЦР-продуктов проводили переосаждением в этаноле. Секвенирование по Сэнгеру проводили в компании Евроген (Москва). Полученные сиквенсы «обрезали» по границам экзонов и выравнивали с использованием программы MEGA v. 11.0.13. В качестве референс-последовательности для гена KRAS и BRAF использовали NC000007.14.
Статистический анализ производили в программном обеспечении Jamovi version 2.5.3. Для оценки статистической значимости различий двух и более показателей применялся метод непараметрического анализа – критерий хи-квадрат Пирсона. Уровень значимости был статистически значимым при p < 0,05.
Результаты исследования и их обсуждение
При гистологическом исследовании ИСП характеризовалась преимущественно эндофитным типом роста эпителиального пласта, как правило, в отечную строму. Эпителиальный пласт мог быть представлен как многослойным плоским неороговевающим эпителием с дистрофическими изменениями, так и эпителием респираторного типа с гиперплазией базальных клеток (рис. 1).
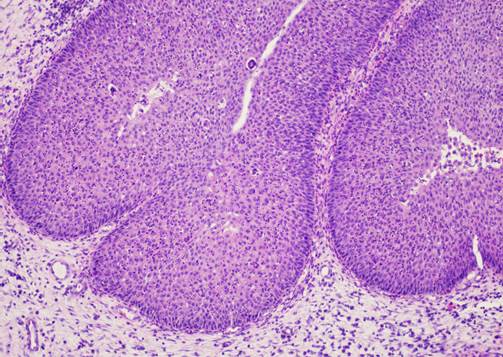
Рис. 1. Морфологическая картина ИСП. Окраска гематоксилином и эозином. Ув.: х100
ОСП характеризовалась экзо- и эндофитным характером роста с формированием папиллярных структур, покрытых цилиндрическим реснитчатым эпителием с выраженной эозинофильной цитоплазмой, а также формированием интраэпителиальных микроабсцессов (рис. 2).
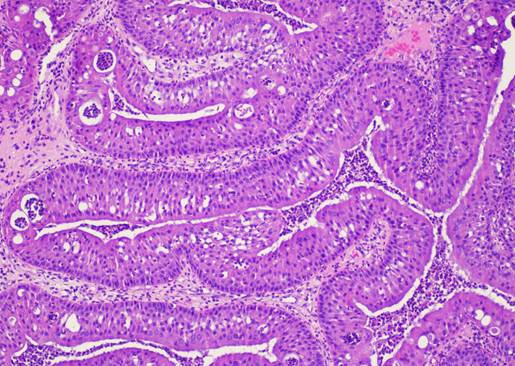
Рис. 2. Морфологическая картина ОСП. Окраска гематоксилином и эозином. Ув.: х100
Группу с-r составили 5 случаев синхронного плоскоклеточного рака G2 и ИСП. Случаи синхронного плоскоклеточного рака и ОСП на момент исполнения исследования отсутствовали. В данной группе отмечались участки вышеописанной ИСП с очагами грубых гистоархитектурных нарушений в виде нарушения полярности клеток эпителиального пласта; наличием ядерного и цитоплазматического полиморфизма; дискератоза; наличием высоких митозов, в том числе и атипических; а также инвазивным ростом в подлежащую строму (рис.3).
При секвенировании по Сэнгеру в гене KRAS (2 exon), в группе ИСП (n = 69), были обнаружены единичная синонимичная мутация G75A (n = 1) без замены кодирующей аминокислоты, и миссенс-мутация G110A (n = 1) с заменой лизина на аргинин. Эти две мутации не имели статистической значимости (p = 0,879). В группе ОСП в гене KRAS (2 exon) из 13 случаев в 3 случаях отмечалась миссенс-мутация G35A, с заменой глицина на аспарагиновую кислоту, при этом данная мутация имела статистически значимое различие от других групп (p < 0,001). В группе плоскоклеточного рака, ассоциированного с СП, в данном гене KRAS (2 exon) мутаций не наблюдалось.
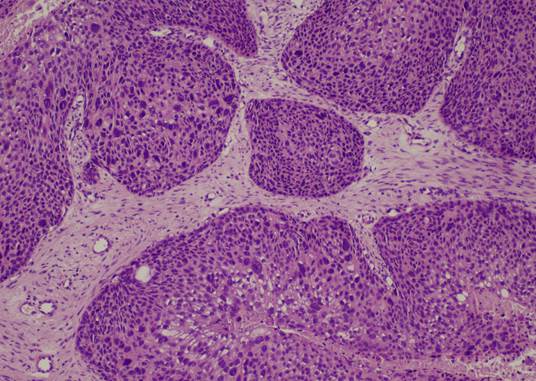
Рис. 3. Синхронный плоскоклеточный рак на фоне ИСП.
Окраска гематоксилином и эозином. Ув.: х100
В гене BRAS (15 exon) во всех трех группах мутации не обнаружены. Обзор мутационных данных приведен в таблице.
Обзор мутационных данных генов KRAS
(2 exon, 3 exon) и BRAF (15 exon) в группах ИСП, ОСП и с-r ||
|
Локализация мутации |
Тип опухоли n = 87 |
Значения критерия хи-квадрат Пирсона |
|||
|
ОСП n = 13 |
ИСП n = 69 |
c-r n = 5 |
|||
|
KRAS 2 exon |
G35A1 |
3 |
0 |
0 |
*p < 0,001; df = 2; x2 = 17,7; n = 87 |
|
G75A |
0 |
1 |
0 |
p = 0,879; df = 2; x2 = 0,264; n = 87 |
|
|
G110A2 |
0 |
1 |
0 |
p = 0,879; df = 2; x2 = 0,264; n = 87 |
|
|
KRAS 3 exon |
117delC3 |
3 |
13 |
1 |
p = 0,939; df = 2; x2 = 0,126; n = 87 |
|
125delC4 |
0 |
1 |
5 |
*p < 0,001; df = 2; x2 = 71,7; n = 87 |
|
|
129delA5 |
1 |
0 |
0 |
p = 0,056; df = 2; x2 = 5,76; n = 87 |
|
|
BRAF 15 exon |
– |
– |
– |
– |
|
1 Замена G (глицин) на D (аспарагиновая кислота); 2 Замена K (лизин) на R (аргинин); 3 Замена S (серин) на ?; 4 Замена K (лизин) на ?; 5 Замена Q (глутамин) на ?.|| 1Replacement of G (glycine) with D (aspartic acid); 2 Replacement of K (lysine) with R (arginine); 3 Replacement of S (serine) with ?; 4 Replacement of K (lysine) with ?; 5 Replacement of Q (glutamine) with ?.
Заключение
Размер когорты в 87 случаев (66 ИСП, 13 ОСП и 5 случаев c-r, ассоциированных с синоназальными папилломами) делает данное исследование одним из наиболее обширных по сравнению с предыдущими работами, посвященными изучению генов KRAS и BRAF в СП различных типов. В исследовании статистически значимые события были обнаружены в гене KRAS. Так, в группе ОСП в гене KRAS (2 exon) из 13 случаев в 3 случаях отмечалась миссенс- мутация G35A, с заменой глицина на аспарагиновую кислоту. В группе плоскоклеточного рака, ассоциированного с синоназальной папилломой, во всех 5 случаях в гене KRAS (3 exon) отмечалась миссенс-мутация 125delC с высокой статистической значимостью в данной группе (p < 0,001). Причем данная мутация не встречалась в группах ОСП и ИСП. Статистически значимых мутаций в группе ИСП в гене KRAS обнаружено не было.
Во всех трех группах различных типов синоназальных папиллом в гене BRAF (15 exon) мутации отсутствовали.
Библиографическая ссылка
Бахтин А.А., Дайхес Н.А., Карнеева О.В., Туманова Е.Л. МУТАЦИИ ГЕНОВ KRAS (2 EXON, 3 EXON) И BRAF (15 EXON) В СИНОНАЗАЛЬНЫХ ПАПИЛЛОМАХ ИНВЕРТИРОВАННОГО И ОНКОЦИТАРНОГО ТИПОВ, А ТАКЖЕ АССОЦИИРОВАННЫХ С НИМИ СИНОНАЗАЛЬНЫХ КАРЦИНОМАХ // Современные проблемы науки и образования. 2025. № 1. ;URL: https://science-education.ru/ru/article/view?id=33881 (дата обращения: 23.01.2026).
DOI: https://doi.org/10.17513/spno.33881



