Введение
Анемия – одно из самых распространенных осложнений у пациентов с онкологическими заболеваниями. Исследования показали, что анемия у пациентов со злокачественными новообразованиями (АЗН), ассоциированная с химио- или лучевой терапией, составляет около 51% [1]. Анемия снижает эффективность химиотерапии (ХТ) и лучевой терапии онкологических заболеваний, а также негативно влияет на качество жизни пациентов [2, 3]. Гипоксия способна изменять биологию опухоли – клетка, которая находится в состоянии кислородного голодания, меняет пути метаболизма и включает механизмы приспособления. В частности, к таким механизмам относятся активация генов семейства HIF-1 (Hypoxia-Inducible Factor-1) [4], запускающих серию молекулярных изменений, одним из которых является продукция сосудистого эндотелиального фактора роста, который отвечает за образование новых сосудов в опухоли, способствуя ее росту и метастазированию [5]. Тяжелая гипоксия также приводит к увеличению частоты спонтанных мутаций. Одним из следствий такого мутагенного состояния клетки являются поломки гена р53, определяющего апоптоз [6]. Торможение апоптоза может значительно уменьшить чувствительность опухоли к цитостатической и лучевой терапии [5].
Пациентам с симптомной анемией или уровнем гемоглобина менее 100 г/л, согласно клиническим рекомендациям МЗ РФ «Анемия при злокачественных новообразованиях» 2024 г. [7], рекомендовано проведение лекарственной терапии эритропоэзстимулирующими препаратами (ЭПС) в монорежиме или в комбинации с препаратами железа. Повсеместное и бесконтрольное применение ЭСП в онкологии выявило целый ряд проблем, таких как: повышение риска тромбозов и теоретическая способность ЭСП негативно влиять на течение онкологического заболевания (стимуляция рецепторов ЭПО на опухолевых клетках, мобилизация эндотелиальных клеток для неоангиогенеза). Применение ЭСП у онкологических больных до сих пор вызывает много опасений.
Цель исследования – провести ретроспективный анализ клинических наблюдений применения ЭСП у пациентов с анемией, индуцированной проведением химиотерапии.
Материалы и методы исследования
В ретроспективный анализ включены 3 пациента онкологического профиля, проходивших лечение с 2023 по 2024 гг. в Институте урологии и репродуктивного здоровья человека ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» и ФГБУ «НМИЦ АГП им. ак. В.И. Кулакова» Министерства здравоохранения Российской Федерации, с наличием анемии, индуцированной проведением химиотерапии.
Результаты исследования и их обсуждение
С целью оценки влияния ЭСП на выживаемость, а также выделения факторов неблагоприятного воздействия ЭСП было проведено несколько метаанализов. Метаанализ C.L. Bennett и соавторов, включающий 51 исследование с участием более 13 тысяч пациентов, показал, что использование ЭСП сопровождается небольшим, но статистически значимым увеличением риска смерти (соотношение рисков (HR, hazard ratio) – 1,10; 95% ДИ 1,01–1,20; р=0,03), однако при анализе по подгруппам наиболее высокий риск смерти имели больные, не получавшие ХТ (HR – 1,29; 95% ДИ 1,0–1,67; р=0,05), а у больных, получавших одновременно с ЭСП противоопухолевую ХТ, риск смерти был статистически не значимым [8]. Другой, более поздний метаанализ M. Aapro и соавторов, не подтвердил воздействие ЭСП на прогрессирование заболевания. Исследователи пришли к выводу, что мнение о существовании прямого или косвенного влияния ЭСП на рост опухоли не имеет под собой убедительных оснований [9]. Таким образом, имеющиеся в настоящее время клинические данные позволяют говорить о том, что ЭСП эффективны в лечении АЗН, не оказывая влияния на прогрессирование заболевания, и рекомендованы для лечения анемии, индуцированной ХТ [10].
Клиническими проявлениями анемического синдрома могут быть жалобы на слабость, повышенную утомляемость, головокружение, головные боли (чаще в вечернее время), одышку при физической нагрузке, ощущение сердцебиения, мелькание «мушек» перед глазами при невысоком уровне артериального давления, сонливость днем и плохое засыпание ночью, раздражительность, нервозность, конфликтность, плаксивость, снижение памяти и внимания, ухудшение аппетита. При физикальном осмотре иногда наблюдаются изменения кожи и ее придатков (сухость, шелушение, бледность), истончение и ломкость ногтей, бледность слизистых оболочек. Дифференциальную диагностику анемии необходимо осуществлять до проведения заместительных трансфузий эритроцитов или назначения специфической терапии (эритропоэтинстимулирующих препаратов (ЭСП), препаратов железа).
Обследование больных анемией включает следующие этапы: 1) клинический анализ крови с определением концентрации Hb, количества эритроцитов и ретикулоцитов, гематокрита, среднего объема эритроцита (MCV), среднего количества гемоглобина на эритроцит (MCH), средней концентрации Hb в эритроците (MCHC), среднего содержания Hb в ретикулоците; 2) выявление дефицита железа с помощью определения белка ферритина (с учетом нормальных значений C-реактивного белка), НТЖ, sRTF, содержания фолиевой кислоты и витамина B12; 3) обследование желудочно-кишечного тракта (эзофагогастродуоденоскопия, проба на скрытую кровь в кале), мочевыделительной системы (клиренс креатинина <60 мл/мин свидетельствует о наличии почечной недостаточности и может приводить к нарушению продукции ЭПО); 4) проба Кумбса с целью выявления аутоиммунной гемолитической анемии, характерной для лимфопролиферативных заболеваний, таких как хронический лимфолейкоз, другие неходжкинские лимфомы; 5) определение ЭПО; 6) оценка костномозгового кроветворения (по показаниям) [11]. В последнее время в диагностике анемии при злокачественном процессе все чаще используют маркер – растворимый рецептор трансферрина (sTfR), который является стабильным фрагментом рецептора трансферрина, циркулирующего в кровеносном русле. Рецепторы трансферрина находятся на поверхности гемопоэтических клеток, а при повышенной потребности в железе количество этих рецепторов возрастает, и sTfR также повышается. Такое состояние чаще всего ассоциировано с абсолютным дефицитом железа. Ферритин, являясь белком острой фазы, «парадоксально» повышается при хроническом воспалении или злокачественном процессе. В такой ситуации наиболее важно оценить эффективную потребность в железе именно при определении концентрации sTfR, потому что данный маркер остается стабильным независимо от экзо- и эндогенного воздействия в организме [12].
Клиническое наблюдение № 1. Женщина П., 59 лет. В 2023 г. после проведенного оперативного вмешательства установлен диагноз «Рак яичников High grade, ст IIIA2 pT3aN1M0». Проведено 5 курсов адьювантной химиотерапии (лечение завершено в сентябре 2023 г.). В 2024 г. по данным контрольного обследования (ПЭТ/КТ) в культе влагалища справа определяется образование с гиперметаболизмом РФП – может соответствовать рецидиву. 17.07.2024 г. выполнены лапароскопия, адгезиолизис, вскрытие, опорожнение и иссечение серозоцеле передней брюшной стенки, удаление рецидивной опухоли с резекцией влагалища, биопсия париетальной брюшины брюшной полости. Выявленный клеточный иммунофенотип соответствует иммунофенотипу серозной карциномы High-grade, с экспрессией р53 "0" типа и с высокой пролиферативной активностью (ИП Ki67 – 95%). С учетом стадии заболевания, гистологического варианта опухоли, объема первичного комбинированного лечения в 2023 г., наличия платиночувствительного рецидива по поводу данного рецидива проведено 6 курсов ХТ по схеме: Гемцитабин-800 мг/м2 в 1,8 дни+ цисплатин-75 мг/м2 в 1 день каждые 21 день с оценкой эффекта каждые 3 курса. Начиная с 3-го курса, послекурсовые периоды осложнялись развитием анемии I–II степени. После проведения 3-го курса проведено введение железа карбоксимальтозата 500 мг внутривенно капельно однократно с последующим приемом пероральных форм препаратов железа в терапевтических дозах 100 мг 2 раза в день и начато подкожное введение эпоэтина альфа 36000 МЕ 1 раз в неделю в межкурсовых периодах. На фоне антианемической терапии проводился динамический контроль общего анализа крови и ретикулоцитов. Основные лабораторные показатели представлены на рисунках 1 и 2. Ремиссия заболевания у пациентки была установлена при контрольном обследовании после 3-го курса ХТ. При обследовании после 6-го курса ХТ ремиссия заболевания сохранялась.
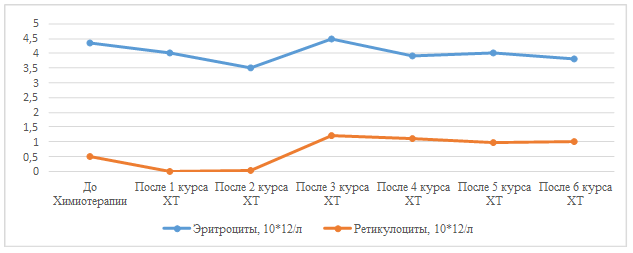
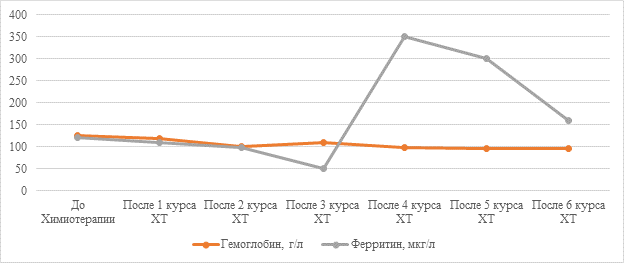
Рис. 1. Динамика концентрации гемоглобина и ферритина у пациента женского пола клинического наблюдения № 1
Рис. 2. Динамика количества эритроцитов и ретикулоцитов у пациента женского пола клинического наблюдения №1
Клиническое наблюдение № 2. Женщина З., 60 лет. В 2018 г. после проведенного оперативного вмешательства установлен диагноз «BRCA1-ассоциированный рак яичников IIIC pТ3аN1M0». По месту жительства в 2018 г. проводилось комбинированное лечение: циторедуктивная операция и 6 курсов химиотерапии, была достигнута ремиссия заболевания. В 2020 г. – рецидив заболевания в брюшной полости, по поводу которого проведено 3 курса ПХТ по схеме: паклитаксел 175 мг/м2, цисплатин 75 мг/м2 1 раз в 21 день. Проведение ПХТ приостановлено в связи с развитием почечной токсичности, однако начата поддерживающая терапия Олапарибом до 03.2024 г. В марте 2024 г. при плановом обследовании выявлены метастазы в надключичных лимфоузлах слева, забрюшинных лимфоузлах, в печени, клетчатке брюшной полости. Представлена на онкологический консилиум. С учетом стадии заболевания, гистологического варианта опухоли, длительного интервала ремиссии, а также прогрессирования процесса в марте 2024 г. и наличия сопутствующей патологии рекомендовано проведение химиотерапии 3-й линии по схеме: Паклиатксел-150 мг/м2+ Карбоплатин-AUC5 раз в 21 день с контролем каждые 3 курса. 27.03.2024 г. проведен курс химиотерапии по указанной схеме. Перенесла его с анемией II степени, нейтропенией II степени. В связи с этим 2-й курс химиотерапии задержан на 21 день. Повторно представлена на онкологический консилиум. С учетом стадии заболевания, гистологического варианта опухоли, длительного интервала ремиссии, наличия сопутствующей патологии, прогрессирования процесса в марте 2024 г., по поводу которого пациентка получила 1 курс 3-й линии химиотерапии: по схеме: Паклитаксел-150 мг/м2+ Карбоплатин-AUC5 раз в 21 день, осложнившийся анемией III степени и нейтропенией II степени, рекомендовано редуцировать дозы химиотерапии и продолжить лечение по схеме: Паклитаксел-140 мг/м2+ Карбоплатин-AUC4 раз в 21 день с контролем каждые 3 курса. Коррекция анемии после 3-го курса проводилась с помощью заместительной гемотрансфузии эритроцитарной взвесью объемом 300,0 однократно. После 4-го курса ПХТ гемоглобин составил 90 г/л, в связи с чем пациентке инициировано применение эритропоэтина альфа по 12000 МЕ 3 раза в неделю в межкурсовых периодах. Последующие курсы химиотерапии пациентка перенесла с развитием анемии I степени, без железодефицитного компонента (ферритин >100 мкг/л). На фоне антианемической терапии проводился динамический контроль общего анализа крови и ретикулоцитов (рис. 3). Ремиссия заболевания у пациентки была установлена при контрольном обследовании после 3-го курса. При обследовании после 6-го курса ремиссия заболевания сохранялась.
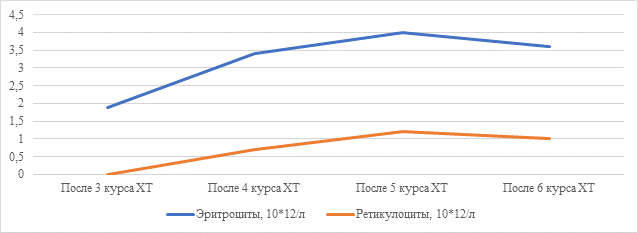
Рис. 3. Динамика количества эритроцитов и ретикулоцитов у пациента женского пола клинического наблюдения № 2
Клиническое наблюдение № 3. Мужчина С., 58 лет. В 2023 г. установлен диагноз «Рак предстательной железы T3aN1M1b». По месту жительства проводилась терапия: гозерелин 3,6 мг подкожно передней брюшной стенки через 4 недели. После проведения 3 введений гозерелина диагностирована анемия II степени с железодефицитным компонентом (ферритин <100 мкг/л). Инициирована антианемическая терапия – карбоксимальтозат 500 мг внутривенно капельно однократно, препараты железа 100 мг 2 раза в день, эпоэтин альфа 36000 МЕ 1 раз в неделю. Изменения лабораторных показателей представлены на рисунке 4.
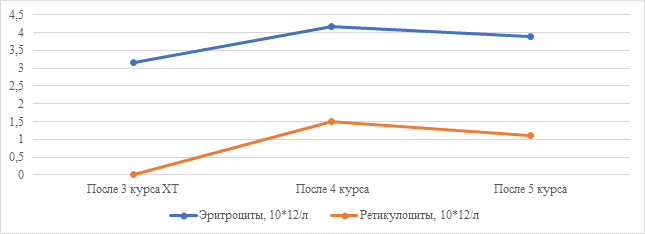
Рис. 4. Динамика количества эритроцитов и ретикулоцитов у пациента мужского пола клинического наблюдения № 3
В описанных клинических случаях № 1 и № 3 у пациентов на фоне лечения основного заболевания развилась анемия легкой степени тяжести. По данным дообследования после 3-го курса видно, что анемия обусловлена функциональным дефицитом железа и угнетением кроветворения после ХТ. После внутривенного введения препаратов железа с последующим назначением ЭСП отмечались положительная динамика эритроцитарных показателей и самое важное – оптимальный уровень ретикулоцитов. Данная тактика позволила не удлинять временной интервал межкурсовых периодов и избежать выполнения заместительной гемотрансфузии эритроцитарной взвеси. В клиническом случае № 2 у пациентки с рецидивом онкологического заболевания ввиду накопленной токсичности химиопрепаратов за множество курсов химиотерапии развилась анемия тяжелой степени, которая потребовала проведения заместительной гемотрансфузии. Однако в последующем были назначены препараты, стимулирующие эритропоэз, что позволило поддерживать целевые показатели крови: концентрацию гемоглобина и количество ретикулоцитов. Стоит отметить, что все пациенты достигли ремиссии основного заболевания.
Помимо преимуществ ЭСП, имеются и потенциальные риски. Они включают возможность прогрессирования основного заболевания и возникновения осложнений. Использование ЭСП может значительно улучшить качество жизни пациентов при сохранении приемлемого уровня безопасности при соблюдении протоколов дозировки и адекватном мониторинге терапии. Для оптимизации лечения следует выбирать препараты с широкой линейкой различных дозировок, что позволит значительно снизить риск нежелательных эффектов и повысить эффективность терапии. Ориентированная на вес пациента дозировка может способствовать лучшему контролю терапии пациентов с АЗН. Прецизионная медицина, открывая индивидуальный подход к пациенту, повышает качество медицинской помощи. Для изучения долгосрочных последствий использования ЭСП в данной когорте пациентов необходимы дальнейшие научные исследования.
Заключение
Многочисленные исследования свидетельствуют о том, что препараты, стимулирующие эритропоэз, обладают высокой эффективностью в лечении анемии, вызванной химиотерапией. При применении этих препаратов отмечаются быстрое достижение целевого уровня гемоглобина, снижение потребности в гемотрансфузиях, что обеспечивает значительное улучшение качества жизни.
Библиографическая ссылка
Силаев Б.В., Парфенова О.А., Горячева Е.В., Безнощенко О.С. БЕЗОПАСНОСТЬ ПРИМЕНЕНИЯ ПРЕПАРАТОВ ЭРИТРОПОЭТИНА У ПАЦИЕНТОВ С АНЕМИЕЙ НА ФОНЕ ХИМИОТЕРАПИИ // Современные проблемы науки и образования. 2024. № 6. ;URL: https://science-education.ru/ru/article/view?id=33847 (дата обращения: 11.01.2026).
DOI: https://doi.org/10.17513/spno.33847



