Введение
Эндометриоз – это доброкачественное гинекологическое заболевание, характеризующееся наличием функциональных желез эндометрия и стромы вне полости матки [1]. Точная этиология эндометриоза неясна.Одна из наиболее широко принятых гипотез заключается в том, что эндометриоз возникает в результате ретроградной менструации клеток эндометрия, которые имплантируются на поверхности брюшины [2].Успех эктопической имплантации зависит от нескольких факторов, включая изменения, способствующие миграции клеток эндометрия, их адгезии и инвазивному росту, а также изменения в антиапоптотическом сигналинге, ангиогенезе и воспалительной реакции [1]. Есть предположение, что в основе развития эндометриоза лежит дисрегуляция процесса эпителиально-мезенхимального перехода (ЭМП).
ЭМП – комплексный динамический процесс, при котором эпителиальные клетки теряют поляризованную организацию цитоскелета и межклеточные контакты и приобретают мезенхимальный фенотип. Считается, что эти изменения являются предпосылками для первоначального возникновения эндометриоидных поражений [3].
Выделяют три типа ЭМП: ЭМП I типа возникает во время эмбрионального развития, ЭМП II типа возникает при регенерации тканей и ЭМП III типа – при онкогенезе [4]. Однако ни одно исследование точно не указывает, какой тип ЭМП возникает при эндометриозе. Цитокины, факторы роста, молекулы внеклеточного матрикса активируют сигнальные пути, запускающие программу ЭМП. Эти пути реализуются посредством ряда транскрипционных факторов (белок «цинковых пальцев» 1 (SNAIL), белок «цинковых пальцев» 2 (SLUG), E-box-связывающийбелокгомеобокс1 и 2 «цинковогопальца»(ZEB1/2), белок 38 «спираль-петля-спираль» класса А (TWIST1/2) и др.), связывающихся с регуляторными областями генов-мишеней.
ZEB1 представляет собой транскрипционный фактор с доменами типа «цинковые пальцы», который принадлежит к семейству ZEB человека. Действие ZEB1 напрямую связано с функциональной потерей Е-кадгерина, что делает его одним из ключевых регуляторов ЭMП [5]. Белки SNAIL, SLUG также являются прямыми репрессорами транскрипции Е-кадгерина и исследованы в качестве регуляторов ЭМП при прогрессии опухолей, где они участвуют в регуляции выживания и пролиферации клеток, инвазии и формировании метастазов, а также контролируют энергетический метаболизм и поддерживают резистентность опухолевых клеток к терапии. Регуляция ЭМП продуктами этих генов приводит к ингибированию эпителиальных (Е-кадгерин, клаудины, окклюдин и др.) и активации мезенхимальных (виментин, фибронектин, N-кадгерин и др.) маркеров (рис. 1). Кроме того, ЭМП может активироваться вследствие гипоксии и гиперэстрогении, в том числе при эндометриозе [3].
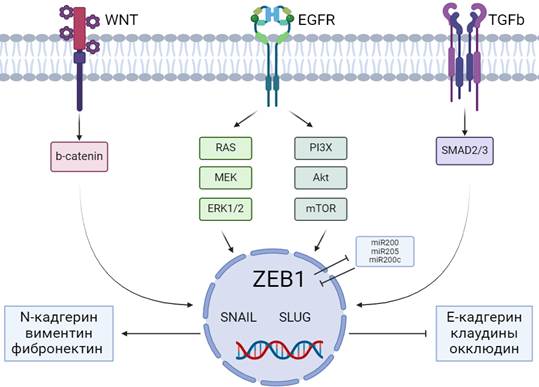
Рис. 1. Сигнальные пути и факторы транскрипции, участвующие в ЭМП.
Источник: составлено авторами на онлайн-платформе для создания профессиональных научных иллюстраций Biorender
ZEB1 является ключевым транскрипционным фактором, контролирующим важные внутриклеточные процессы. Вышестоящие маркеры, включая RAS/ERK, PI3X/AKT, Wnt/β-катенин и Smads, приводят к усилению регуляции ZEB1 путем прямого запуска ZEB1 или посредством SNAIL и SLUG. Влияние микроРНК (miR-200, miR-205 и miR200c) на ZEB1 имеет двунаправленный характер. Нижестоящие сигнальные пути, запускаемые ZEB1/SNAIL/SLUG, регулируют активность белков, участвующих в дифференцировке, пролиферации или подвижности клеток.
За последние несколько лет было показано, что в очагах эндометриоидных гетеротопий наблюдают феномен ЭМП. Например, экспрессия E-кадгерина снижается, а экспрессия виментина увеличивается в эпителиальном компоненте эндометриоидных поражений по сравнению с эндометрием у здоровых женщин [6]. Также обнаружено, что эутопический, гетеротопический и нормальный эндометрий различны [7], что позволяет предположить, что первые изменения в патогенезе эндометриоза могут происходить в эндометрии.
В настоящее время большое количество исследований посвящено изучению роли ЭМП в патогенезе эндометриоза, однако имеющиеся в литературе научные данные о биомаркерах и механизмах ЭМП при формировании эндометриоза представлены в небольшом количестве и нередко демонстрируют противоречивые результаты.
Следовательно, дальнейшие исследования, посвященные изучению ключевых биомаркеров и механизмов ЭМП в формировании эндометриоза, представляются крайне актуальной задачей, направленной на выявление потенциальных мишеней для разработки таргетной терапии заболевания.
Цель исследования – оценить экспрессию тканевых маркеров ZEB1, SNAIL, SLUG в эутопическом и эктопическом эндометрии у пациентов с различными формами эндометриоза с помощью иммуногистохимического метода.
Материалы и методы исследования
Работа выполнена на базах 1-го патологоанатомического и хирургического отделений ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России в период с 2023 по 2024 г. В исследование было включено 10 пациентов женского пола с перитонеальным эндометриозом (группа А) и 10 пациентов с глубоким инфильтративным эндометриозом (группа Б). Средний возраст больных в группе А составил 35±3 лет (95 % ДИ 32–37), в группе Б – 36±5 лет (95 % ДИ 31–39). Группу сравнения составили 10 пациентов (средний возраст 36±7 лет (95 % ДИ 31–42), прооперированных по поводу серозных цистаденом яичников (материал исследования – соскоб эндометрия в среднюю фазу пролиферации). Все пациенты в группе контроля были без признаков эндометриоза, с регулярным менструальным циклом.
Исследовали материал соскобов из полости матки (эутопический эндометрий) и образцы гетеротопического эндометрия. Для всех образцов была проведена химическая фиксация в 10 % нейтральном забуференном формалине в течение 24 ч. Затем образцы были обезвожены в автоматическом режиме при помощи гистологического процессора замкнутого цикла с вакуумом TissueTek VIP5 (Sakura, Япония). Дегидратация образцов тканей происходила с использованием 10 % забуференного формалина и раствора для гистологической проводки на основе изопропанола IsoPrep (Биовитрум, Россия), на заключительном этапе проводки выполняли вакуумную пропитку парафином МистерВакс (Биовитрум, Россия). Затем образцы тканей были залиты в парафин Гистомикс Экстра (Биовитрум, Россия) на станции заливки гистологического материала Tissue Tek TEC 5 (Sakura, Япония). Далее из парафиновых блоков были получены срезы толщиной 5 мкм, которые были нанесены на предметные стекла. С помощью аппарата для автоматической окраски Leica Autosteiner XL ST5010 (Leica, Германия) стекла были депарафинированы ксилолом и этанолом, окрашены гематоксилином и эозином; просветление производили с помощью ксилола. Стекла были заключены под покровное стекло с использованием автоматического прибора для заключения срезов Leica CV5030 (Leica, Германия).
Для проведения иммуногистохимического исследования с парафиновых блоков были изготовлены срезы толщиной 5 мкм, которые были нанесены на предметные стекла с положительным зарядом поверхности SuperFrost Plus (Thermo Scientific, США). Затем микропрепараты были окрашены при помощи иммуностейнера BenchMark XT (Ventana, Roche, Швейцария) и панели детекции DAB Universal ultraView (Ventana, Roche, Швейцария). Методика была использована для каждого из антител, указанных в табл. 1. На начальном этапе выполняли отработку титров антител.
Таблица 1
Характеристика антител
|
Наименование антитела |
Клон |
Разведение |
Производитель (катал. номер) |
Время (мин) и температура инкубации (°C) |
|
|
ZEB1 |
EPR17375 |
1/100 |
Abcam, ab203829 |
20 |
37 |
|
SNAIL+SLUG |
– |
1/50 |
Abcam, ab85936 |
20 |
37 |
С помощью сканирующего микроскопа Aperio AT2 (Leica Biosystems, Германия) были получены цифровые изображения окрашенных микропрепаратов (формат изображений svs). Для иммуногистохимических маркеров был определен индекс H-score (Histo-score) по формуле: HS = 1а + 2b + 3c, где а – процент слабо окрашенных клеток, b – процент умеренно окрашенных клеток, с – процент сильно окрашенных клеток; 1, 2, 3 – интенсивность окрашивания в баллах.
Для обработки полученных результатов использовали программы Microsoft Excel (версия 16), Statistica 10.0, GraphPadPrism 9.3.1. Обработка данных велась в соответствии с рекомендациями для медицинских и биологических исследований. Статистически значимыми считали различия при р < 0,05 (95,0 % уровень значимости).
Результаты исследования и их обсуждение
Иммуногистохимический анализ эутопического эндометрия выявил значимо более высокий уровень экспрессии ZEB1 у пациентов женского пола с глубоким инфильтративным эндометриозом и перитонеальным эндометриозом по сравнению с группой сравнения (p < 0,0001). Так, показатели H-score ZEB1 у пациентов группы А и группы Б были в 2,5 раза выше, чем в группе сравнения (табл. 2, рис. 2).
Таблица 2
Результаты иммуногистохимического исследования ZEB1 в нормальном эндометрии и эутопических очагах
|
Исследуемая группа |
H-score (баллы) |
p |
|
|
M ± SD |
95 % ДИ |
||
|
Группа сравнения |
94,5±19 |
80–108 |
< 0,0001* |
|
Перитонеальный эндометриоз (группа А) |
237±15 |
225–248 |
|
|
Исследуемая группа |
H-score (баллы) |
|
|
|
M ± SD |
95 % ДИ |
||
|
Группа сравнения |
94,5±19 |
80–108 |
< 0,0001 |
|
Глубокий инфильтративный эндометриоз (группа Б) |
252,5±27 |
233–272 |
|
|
Исследуемая группа |
H-score (баллы) |
|
|
|
M ± SD |
95 % ДИ |
||
|
Перитонеальный эндометриоз (группа А) |
237±15 |
225–248 |
0,446 |
|
Глубокий инфильтративный эндометриоз (группа Б) |
252,5±27 |
233–272 |
|
Примечание. * – p < 0,05; используемый метод: one-way ANOVA, анализируемый материал: эутопический эндометрий.
При сопоставлении значений H-score для ZEB1 в эутопическом эндометрии между группой А и группой Б статистически значимых различий авторами выявлено не было (р = 0,446).
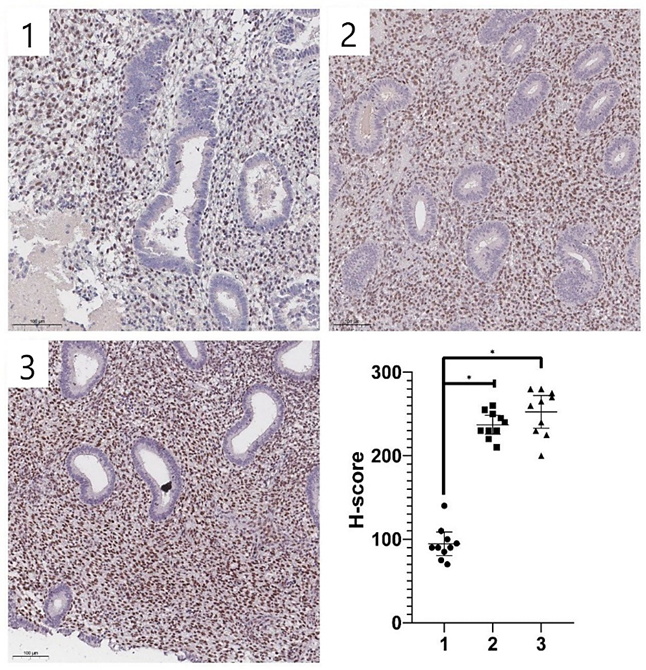
Рис. 2. Различная интенсивность ИГХ экспрессии ZEB1 в стромальных клетках эутопического эндометрия исследуемых групп.
1 – нормальный эндометрий, 2 – эутопический эндометрий при перитонеальном эндометриозе, 3 – эутопический эндометрий при глубоком инфильтративном эндометриозе. Иммуногистохимическая реакция с антителами к ZEB1. Увеличение ×100.
Источник: составлено авторами
При изучении интенсивности окрашивания маркера ZEB1 в очагах эндометриоидных инфильтратов также были выявлены статистически значимые различия (табл. 3).
Таблица 3
Результаты иммуногистохимического исследования ZEB1 в нормальном эндометрии и гетеротопических очагах
|
Исследуемая группа |
Анализируемый материал |
H-score (баллы) |
p |
|
|
M ± SD |
95 % ДИ |
|||
|
Группа сравнения |
Эутопический эндометрий1 |
94,5±19 |
80–108 |
< 0,0001* |
|
Перитонеальный эндометриоз (группа А) |
Гетеротопический эндометрий2 |
171,5±24 |
153–189 |
|
|
Исследуемая группа |
Анализируемый материал |
H-score (баллы) |
< 0,0001* |
|
|
M ± SD |
M ± SD |
|||
|
Группа сравнения |
Эутопический эндометрий1 |
94,5±19 |
80–108 |
|
|
Глубокий инфильтративный эндометриоз (группа Б) |
Гетеротопический эндометрий3 |
144±17 |
131–157 |
|
|
Исследуемая группа |
Анализируемый материал |
H-score (баллы) |
0,02* |
|
|
M ± SD |
M ± SD |
|||
|
Перитонеальный эндометриоз (группа А) |
Гетеротопический эндометрий3 |
171,5±24 |
153–189 |
|
|
Глубокий инфильтративный эндометриоз (группа Б) |
Гетеротопический эндометрий3 |
144±17 |
131–157 |
|
Примечание. * – p < 0,05; используемый метод: one-way ANOVA.
В гетеротопических очагах индекс H-score был значимо выше у пациентов группы А и группы Б, чем в группе сравнения (табл. 3, рис. 3). Уровень ZEB1 в образцах перитонеальных гетеротопий (группа А) был выше на 81 %, а в образцах глубокого инфильтративного эндометриоза (группа Б) на 52 % по сравнению с группой пациентов женского пола без эндометриоза.
При перитонеальном эндометриозе отмечали более высокие значения H-score по сравнению с показателями в группе глубокого инфильтративного эндометриоза (р = 0,02) в очагах гетеротопий.
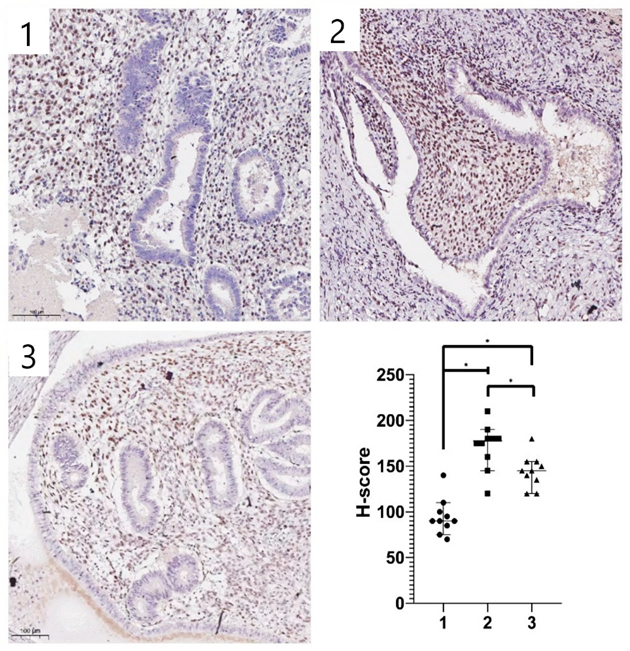
Рис. 3. Различная интенсивность иммуногистохимической экспрессии ZEB1 в стромальных клетках нормального эндометрия и гетеротопических очагах.
1 – нормальный эндометрий, 2 – гетеротопический эндометрий при перитонеальном эндометриозе, 3 – гетеротопический эндометрий при глубоком инфильтративном эндометриозе. Иммуногистохимическая реакция с антителами к ZEB1. Увеличение ×100.
Источник: составлено авторами
Иммуногистохимический анализ показал повышенный уровень второго маркера ЭМП SNAIL+SLUG в эндометрии при эндометриозе (табл. 4).
Таблица 4
Результаты иммуногистохимического исследования SNAIL+SLUG в нормальном эндометрии и эутопических очагах
|
Исследуемая группа |
H-score (баллы) |
p |
|
|
Me |
Q1–Q3 |
|
|
|
Группа сравнения |
215 |
183–251 |
0,0002*
|
|
Перитонеальный эндометриоз (группа А) |
297 |
290–300 |
|
|
Исследуемая группа |
H-score (баллы) |
0,0005* |
|
|
Me |
Q1–Q3 |
||
|
Группа сравнения |
215 |
183–251 |
|
|
Глубокий инфильтративный эндометриоз (группа Б) |
285 |
288–300 |
|
|
Исследуемая группа |
H-score (баллы) |
> 0,999 |
|
|
Me |
Q1–Q3 |
||
|
Перитонеальный эндометриоз (группа А) |
297 |
290–300 |
|
|
Глубокий инфильтративный эндометриоз (группа Б) |
285 |
288–300 |
|
Примечание. * – p < 0,05; используемый метод: критерий Краскела – Уоллиса, анализируемый материал: эутопический эндометрий.
Индекс H-score в эутопическом эндометрии у пациентов группы А и группы Б был выше на 38 % и 32 % соответственно относительно с группой сравнения (рис. 4). Статистически значимой разницы в интенсивности окрашивания SNAIL+SLUG в эутопическом эндометрии между группами А и Б не выявлено.

Рис. 4. Различная интенсивность иммуногистохимической экспрессии SNAIL+SLUG в стромальных клетках нормального эндометрия и гетеротопических очагах.
1 – нормальный эндометрий, 2 – эутопический эндометрий при перитонеальном эндометриозе, 3 –эутопический эндометрий при глубоком инфильтративном эндометриозе. Иммуногистохимическая реакция с антителами к SNAIL+SLUG. Увеличение ×100.
Источник: составлено авторами
При изучении интенсивности окрашивания маркера SNAIL+SLUG в очагах эндометриоидных гетеротопий также были выявлены статистически значимые различия (табл.5).
Таблица 5
Результаты иммуногистохимического исследования SNAIL+SLUG в нормальном эндометрии и гетеротопических очагах
|
Исследуемая группа |
Анализируемый материал |
H-score |
p |
|
|
Me |
Q1–Q3 |
|||
|
Группа сравнения |
Эутопический эндометрий1 |
215 |
183–251 |
0,001* |
|
Перитонеальный эндометриоз (группа А) |
Гетеротопический |
292,5 |
285–300 |
|
|
Исследуемая группа |
Анализируемый материал |
H-score |
< 0,0001* |
|
|
Me |
Q1–Q3 |
|||
|
Группа сравнения |
Эутопический эндометрий1 |
215 |
183–251 |
|
|
Глубокий инфильтративный эндометриоз (группа Б) |
Гетеротопический |
297,5 |
290–300 |
|
|
Исследуемая группа |
Анализируемый материал |
H-score |
> 0,999 |
|
|
Me |
Q1–Q3 |
|||
|
Перитонеальный эндометриоз (группа А) |
Гетеротопический |
292,5 |
285–300 |
|
|
Глубокий инфильтративный эндометриоз (группа Б) |
Гетеротопический |
297,5 |
290–300 |
|
Примечание. * – p < 0,05; используемый метод: критерий Краскела – Уоллиса.
При изучении интенсивности окрашивания SNAIL+SLUG в очагах гетеротопий индекс H-score был значимо выше у пациентов женского пола группы А и группы Б, чем в группе сравнения. Уровень SNAIL+SLUG в образцах перитонеальных гетеротопий был выше на 35 %, а в образцах глубокого инфильтративного эндометриоза – на 38 % по сравнению с группой пациентов без эндометриоза (рис. 5). Однако статистически значимых различий в уровне индекса H-score в очагах гетеротопий в группе А и в группе Б обнаружено не было.
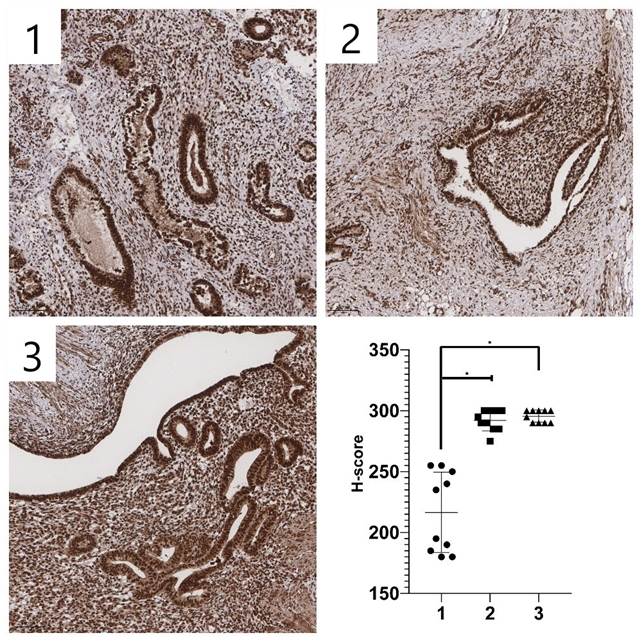
Рис. 5. Различная интенсивность иммуногистохимической экспрессии SNAIL+SLUG в стромальных клетках нормального эндометрия и гетеротопических очагах.
1 – нормальный эндометрий, 2 – гетеротопический эндометрий при перитонеальном эндометриозе, 3 –гетеротопический эндометрий при глубоком инфильтративном эндометриозе. Иммуногистохимическая реакция с антителами к SNAIL+SLUG.
Увеличение ×100. Источник: составлено авторами
Феномен ЭМП, который наиболее изучен при злокачественных заболеваниях, в последнее время активно исследуют в патогенезе эндометриоза. Известно, что в регуляции прогрессирования ЭМП принимают участие такие транскрипционные факторы, как SNAIL, SLUG, ZEB1, которые способствуют не только инвазивному росту при различных гистологических типах рака, но и играют важную роль в морфогенезе эндометриоза [8]. Следовательно, вышеописанные факторы транскрипции ЭМП могут идентично экспрессироваться как в очагах эндометриоза, так и в карциномах (например, гинекологических локализаций, в частности при раке яичников) [9]. Имеются данные о повышенных уровнях SNAIL, SLUG в опухолевых клетках, имеющих морфологические признаки ЭМП (способность к миграции и инвазии) [10]. В большинстве типов опухолей повышенная экспрессия SNAIL, SLUG связана с низкой выживаемостью и, как следствие, неблагоприятным прогнозом заболевания. Так, например, по данным Cao Y.W. и соавт., высокая экспрессия SNAIL прямо коррелирует с количеством метастазов в лимфатических узлах при раке молочной железы [11]. При раке шейки матки повышенный уровень экспрессии SNAIL также является негативным прогностическим фактором [12].
Учитывая общие черты эндометриоза со злокачественными опухолями [13], можно предположить, что при эндометриозе аналогичным образом, как и при карциномах, повышение экспрессии SNAIL, SLUG может напрямую коррелировать с более тяжелой стадией и исходом заболевания.
В данном исследовании авторами были выявлены повышенные уровни экспрессии белков SNAIL и SLUG при перитонеальном и колоректальном эндометриозе, что согласуется с данными других исследований. Авторами в одной из работ иных авторов было найдено значительное повышение экспрессии SNAIL/SLUG в эутопических и эктопических образцах по сравнению с контролем [14]. Идентичные результаты были продемонстрированы и в систематическом обзоре, опубликованном в 2020 г. [3].
Другим фактором транскрипции, участвующим в ЭМП, является ZEB1, ключевая роль которого заключается в ингибировании E-кадгерина. Экспрессия ZEB1, как и экспрессия SNAIL и SLUG, в эндометриоидных поражениях усиливает подвижность клеток, обеспечивает их устойчивость к аноикису, что способствует инвазии и прогрессированию эндометриоза. В данной работе авторов были выявлены очаги эндометриоидных гетеротопий, фенотипически характеризующиеся более выраженными инвазивными проявлениями (перитонеальный и колоректальный эндометриоз), демонстрировали повышенные значения H-score для ZEB1 по сравнению с контролем. Полученные авторами данные согласуются с результатами других исследований [15]. Интересно отметить, что в группе больных эндометриозом уровень экспрессии ZEB1 в гетеротопическом эндометрии был снижен по сравнению с соответствующим ему эутопическим эндометрием. Аналогичные данные были получены Wu R.F. и соавт. в 2018 г. [7]. Такие результаты могут быть в первую очередь связаны с небольшим объемом выборки. Другое возможное объяснение состоит в том, что высокие уровни экспрессии ZEB1 в эутопическом эндометрии индуцируют ЭМП, а затем дополнительно обеспечивают клеткам усиленную миграцию и инвазию для роста за пределами полости матки [7].
Кроме того, в данном исследовании авторами отмечено, что экспрессия ZEB1 была обнаружена только в стромальных клетках, позитивного окрашивания в эпителии желез авторами обнаружено не было, хотя в исследовании Furuya M. и соавт. было выявлено 2 образца с экспрессией в железистом компоненте очагов эндометриоза [15].
Заключение
На основании полученных результатов можно сделать вывод о том, что у пациентов с перитонеальным и колоректальным эндометриозом как в эутопическом эндометрии, так и в очагах эндометриоидных гетеротопий обнаружен повышенный уровень маркеров ZEB1, SNAIL+SLUG, что может указывать на активацию процесса ЭМП, обеспечивающего инвазивный потенциал гетеротопий при таком доброкачественном заболевании, как эндометриоз.
Библиографическая ссылка
Бадлаева А.С., Варданян М.А., Чекенева Н.А., Асатурова А.В., Трегубова А.В., Дворников С.К., Буралкина Н.А., Мельников М.В., Павлович С.В. ИММУНОГИСТОХИМИЧЕСКАЯ ОЦЕНКА МАРКЕРОВ ЭПИТЕЛИАЛЬНО-МЕЗЕНХИМАЛЬНОГО ПЕРЕХОДА ПРИ РАЗЛИЧНЫХ ФОРМАХ ЭНДОМЕТРИОЗА // Современные проблемы науки и образования. 2025. № 1. ;URL: https://science-education.ru/ru/article/view?id=33810 (дата обращения: 23.01.2026).
DOI: https://doi.org/10.17513/spno.33810



