Введение
Long-Covid – одно из клинических течений новой коронавирусной инфекции. Национальный институт здравоохранения и совершенствования медицинской помощи Великобритании (NICE) характеризует Long-Covid как симптоматический COVID-19 в период от 4 до 12 недель после заражения с сохраняющимися симптомами, которые продолжаются или развиваются после острого течения COVID-19 и не могут быть объяснены альтернативным диагнозом [1, с. 6–12]. Одновременно национальный институт здравоохранения (NIH) и центры по контролю и профилактике заболеваний США (CDC) используют определение длительного COVID-19 как период симптоматических проявлений от 4 недель и более, развившегося после острого течения инфекционного процесса [2, 3]. Однако некоторые авторы трактуют Long-Covid как результат хронической персистенции вируса в организме [4].
На сегодняшний день доказано, что острое течение COVID-19 не только вызывает поражение легких, но и характеризуется развитием синдрома системного воспалительного ответа [5]. После первичной острой инфекции, как и при других вирусных заболеваниях, было описано множество длительных симптомов – постоянные симптомы и потенциальные последствия более четырех недель с момента начала заболевания, основными признаками которых являются одышка, когнитивные нарушения, усталость, беспокойство и депрессия, нарушения со стороны сердечно-сосудистой, легочной систем и выделительной функции [5, 6, 7].
Современные методы исследования позволили достаточно полно изучить геном и патогенез новой коронавирусной инфекции в остром периоде заболевания [8, 9, 10]. В то же время в литературе появляются данные об описании амилоидных масс во внутренних органах у пациентов, не только в остром периоде заболевания, но и у ранее перенесших новую коронавирусную инфекцию, вызванную вирусом SARS-CoV-2 [11, 12, 13]. Описанные ранее изменения легких и кровеносных сосудов в рамках течения новой коронавирусной инфекции также встречаются у умерших пациентов, ранее перенесших новую коронавирусную инфекцию [14, 15, 16].
АА-амилоидоз – это заболевание, обусловленное внеклеточным отложением нерастворимых β-складчатых листов, состоящих из амилоидных фибрилл и амино(N)-терминального фрагмента SAA (сывороточный амилоид A) [17]. Отложения амилоидных масс нарушают структуру тканей и в последующем приводят к дисфункции самого органа. Классический и хорошо изученный патогенез АА-амилоидоза обусловлен хроническим воспалением, в то же время в исследовании авторы описали посттрансляционную модификацию (PTM) образования амилоидных фибрилл, включающую в себя карбамилирование, ацетилирование и окисление, выявленные на N-концевых пептидах SAA, помимо этого, высокая концентрация сывороточного амилоида А после достижения критического порога приводит к его агрегации и отложению амилоида в тканях [18, 19].
Амилоидогенные свойства белков вируса SARS-CoV-2, а именно S-белка, N- и E-протеина, были подтверждены биохимическим и биофизическим исследованиями. Отмечено, что два из них, N-протеин и S-белок, наиболее распространены в клетках человека, инфицированных вирусом SARS-CoV-2 [13, 19, 20].
Существует гипотеза, что тяжесть новой коронавирусной инфекции, вызванной вирусом SARS-CoV-2, приводит к увеличению агрегации белков и образованию амилоида. Доказано, что сывороточный амилоид А (SAA) является специфическим острофазным маркером и возникает в сочетании с воспалением и цитокиновым штормом, которые наблюдались в остром периоде заболевания COVID-19, поэтому тяжесть течения инфекционного процесса напрямую связана с достаточно высокой концентрацией SAA, что согласуется с гипотезой развития АА-амилоидоза [21, 22, 23].
Выделяют следующие варианты амилоидных отложений легких: узловой легочный амилоидоз, диффузный альвеолярно-септальный амилоидоз (DASA), трахеобронхиальный амилоидоз, амилоидоз медиастинального лимфатического узла и плевральный амилоидоз [24, 25]. В данном клиническом наблюдении диагностирован альвеолярно-септальный АА-амилоидоз.
В своем ретроспективном исследовании авторы оценили концентрацию SAA у пациентов с новой коронавирусной инфекцией в зависимости от тяжести течения инфекционного процесса и летальных исходов. При анализе 5617 пациентов они выявили увеличение концентрации SAA при корреляции с тяжелым течением COVID-19 (летальные исходы и ОРДС), тем не менее, еще предстоит исследовать долгосрочный риск развития амилоидоза [26].
Сосудистый АА-амилоидоз представляет собой проявление системного АА-амилоидоза с отложениями амилоидных фибрилл в стенках кровеносных сосудов селезенки, печени (в основном вокруг центральной вены), почках (сосудистая нефропатия), легких и сердца [27]. Выявленный авторами вариант «сосудистого» поражения почек отличается от «клубочкового» тем, что отложения амилоида в стенках кровеносных сосудов мозгового веществ не оказывают влияния на фильтрационную функцию клубочков [28]. Обнаруженные авторами отложения АА-амилоида в стенках кровеносных сосудов и описанная очаговая дезорганизация их стенок свидетельствуют об эндотелиальной дисфункции, что в последующем может привести к тромбозу кровеносных сосудов [29, с. 12–13].
Цель исследования: изучить постмортальные патоморфологические особенности легких и кровеносных сосудов паренхиматозных органов у пациента женского пола с хроническим течением COVID-19 (Long-Covid).
Материалы и методы исследования
Проведен ретроспективный анализ медицинской документации и протокола патолого-анатомического исследования пациента женского пола, умершего через 63 дня после диагностированной новой коронавирусной инфекции. Аутопсийный материал фиксировали в 10%-ном нейтральном забуференном растворе формалина в течение 72 часов с дальнейшей гистологической проводкой материала в автоматическом гистопроцессоре Leica ASP 300 (Leica Microsystems, Германия), заливали в парафин на станции Leica EG 1160 (Германия), изготавливали гистологические срезы толщиной 3–4 микрометра с помощью микротома LeicaRM 2125 RTS (Германия). Гистологические срезы окрашивали гематоксилином и эозином, гистохимическими окрасками по Зербино (MSB по Лёндруму) и конго красным, комбинированной гистохимической окраской по Ван Гизону в автоматической станции Leica ST 5010 (Leica Microsystems, Германия). Для ИГХ-исследования использовали гистологические парафиновые срезы толщиной 3–4 мкм, которые наносили на высокоадгезивные стекла и высушивали в термостате при температуре 70ºС в течение 2 часов. Окраску проводили с использованием двухэтапного стрептавидин-биотин-пероксидазного метода с демаскировкой антигена и применением наборов моноклональных и поликлональных антител. Иммуногистохимическое окрашивание производили в иммуностейнерах Ventana BenchMark ULTRA IHC/ISH (США) и LeicaBond-MAX (Германия) на парафиновых срезах по стандартной методике. В исследовании использовали следующие антитела: к цитокератину 5/6, к Р-компоненту амилоида, АА-амилоиду, AL-каппа, AL-лямбда и транстирретиновому амилоиду. Микроскопическое исследование осуществляли на триокулярном микроскопе Leica DMLB (Германия) с использованием цифровой камеры Leica DFC 420 (Германия). Микроскопическое исследование амилоида осуществляли на поляризационном световом микроскопе Leica DM2500 (Германия), оснащенном набором люминесцентных фильтров 340–560 нм. Анализ полученных изображений выполнен с помощью программного обеспечения ImageScope Color M, калибровка измерений производилась с помощью объекта-микрометра для микроскопа с ценой деления 0,01 мм.
Клинический случай. У пациента женского пола, 70 лет, в марте 2021 года была диагностирована новая коронавирусная инфекция. После выписки из инфекционного стационара больная не вставала с постели. Через 2 месяца, в мае 2021 года, поступила в тяжелом состоянии по СМП в стационар с подозрением на острый коронарный синдром. На момент госпитализации ЧДД 18 в минуту, ЧСС 116 в минуту. В общем анализе крови – тромбоцитоз (тромбоциты крови 476х109/л), в биохимическом анализе крови – повышение С-реактивного белка (23,42 мг/л), Д-димера (3246 нгФЭЕ/мл). При анализе гуморального иммунитета отмечены повышенные фракции иммуноглобулинов: IgG 634,05 ЕД/мл, IgM – 5,00 ОСЕ. В анамнезе: гипертоническая болезнь III стадии, 3-й степени, риск ССО 4, нарушения ритма сердца: постоянная форма фибрилляции предсердий. Несмотря на проводимую терапию, состояние пациента женского пола оставалось тяжелым, на 4-е сутки госпитализации констатирована биологическая смерть.
Был формулирован заключительный клинический диагноз.
Основное заболевание. Ишемический инсульт в бассейне левой средней мозговой артерии неизвестной давности, кардиоэмболический патогенетический вариант.
Фоновые заболевания. Гипертоническая болезнь III стадии, 3-й степени, риск ССО 4. Нарушение ритма сердца: постоянная форма фибрилляции предсердий, риск CHA2DS2-VASc – 8 баллов.
Осложнения. ХСН IIБ степени (по Стражеско–Василенко). Пролежни спины, крестца.
Сопутствующие заболевания. Ишемическая болезнь сердца: перенесенный в прошлом острый инфаркт миокарда. Перенесенная новая коронавирусная инфекция (от марта 2021 г.).
Протокол патолого-анатомического исследования:
Легкие массой 1300 г, тестоватой консистенции, с поверхности серовато-красного цвета, на разрезе темно-красные, с поверхности разрезов стекает большое количество розовой пенистой жидкости и небольшое количество жидкой крови. Сегментарные и субсегментарные бронхи с гладкими сероватыми стенками, не выступают над поверхностью разрезов, просветы пусты. Микроскопически: альвеолы местами эмфизематозно расширены, просветы с единичными альвеолярными макрофагами, плазмоцитами и десквамированным эпителием (рис. 1А), местами плоскоклеточная метаплазия альвеолярного эпителия (рис. 1Б).
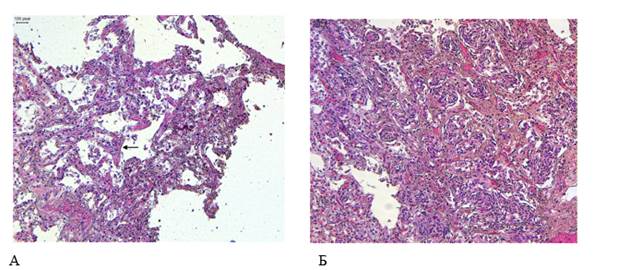
Рисунок 1. Патоморфологические изменения легких пациента женского пола, 70 лет, умершего от хронического течения COVID-19. Увеличение ×100.
А – единичные гиалиновые мембраны по контурам альвеол (стрелка), десквамированный альвеолярные эпителий; Б – Множественные очаги плоскоклеточной метаплазии альвеолярного эпителия. Окраска гематоксилином и эозином
Очаги фиброзной ткани с наличием фибробластоподобной реакции, единичные гиалиновые мембраны были дифференцированы гистохимический окраской по Ван Гизону (рис. 2А). Эндотелиальная выстилка кровеносных сосудов местами была нарушена. При гистохимической окраске по Зербино отмечено мукоидное набухание стенок кровеносных сосудов (рис. 2Б).
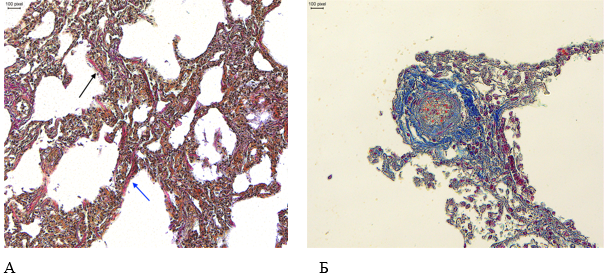
Рисунок 2. Патоморфологические изменения легких пациента женского пола, 70 лет, умершего от хронического течения COVID-19. Увеличение А ×100, Б ×200. А – гиалиновые мембраны по контурам альвеол (черная стрелка), очаговый фиброз межальвеолярных перегородок (синяя стрелка) (гистохимическая окраска по Ван Гизону); Б – Мукоидное набухание стенки кровеносного сосуда (гистохимическая окраска по Зербино)
В среднем слое кровеносных сосудов, по контурам альвеол авторами выявлены бесструктурные гомогенные эозинофильные отложения, которые при гистохимической окраске конго красным и исследовании в поляризованном свете имели характерное для амилоида яблочно-зеленое свечение (рис. 3, 4).
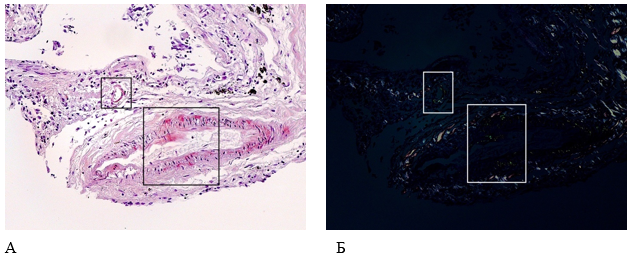
Рисунок 3. Патоморфологические изменения легких пациента женского пола, 70 лет, умершего от хронического течения COVID-19. Увеличение ×200. А – Отложения амилоидоподобных масс в стенках кровеносных сосудов (гистохимическая окраска конго красным); Б – яблочно-зеленое свечение амилоида при поляризованном свете (поляризационная микроскопия)
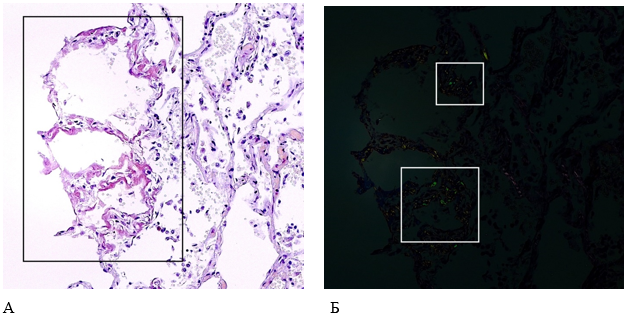
Рисунок 4. Патоморфологические изменения легких пациента женского пола, 70 лет, умершего от хронического течения COVID-19. Увеличение ×200. А – Отложения амилоидоподобных масс по контурам альвеол (гистохимическая окраска конго красным); Б – яблочно-зеленое свечение амилоида при поляризованном свете (поляризационная микроскопия)
Иммуногистохимическое исследование с использованием антитела к цитокератину 5/6 подтвердило плоскоклеточную метаплазию альвеолярного эпителия (рис. 5А), а при применении антитела к S-белку SARS-CoV-2 были идентифицированы фрагменты S-белка вируса в альвеолярных макрофагах (рис. 5Б).
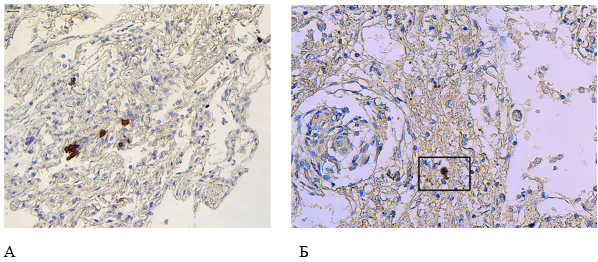
Рисунок 5. Патоморфологические изменения легких пациента женского пола, 70 лет, умершего от хронического течения COVID-19. Увеличение ×200. А – Плоскоклеточная метаплазия альвеолярного эпителия, положительная иммуногистохимическая реакция с использованием антител к цитокератину 5/6, Б – Положительная иммуногистохимическая реакция с использованием антител к S-белку SARS-CoV-2 в альвеолярном макрофаге
Сердце массой 610 г, размеры – 12х16х5 см, толщина стенки правого желудочка 0,2 см, левого 1,8 см. Полости сердца расширены, миокард на разрезе буро-коричневого цвета, дряблый, в верхней трети межжелудочковой перегородки интрамуральный участок плотной белесоватой ткани размером 1х0,7х0,2 см. При микроскопическом исследовании обнаружены дистрофия и гипертрофия кардиомиоцитов с их диссоциацией, перинуклеарные отложения гранул липофусцина, помимо этого – обширные поля разрастания грубоволокнистой соединительной ткани. При окраске конго красным выявлены амилоидные структуры в стенках кровеносных сосудов, которые имели яблочно-зеленое свечение в поляризованном свете (рис. 6).
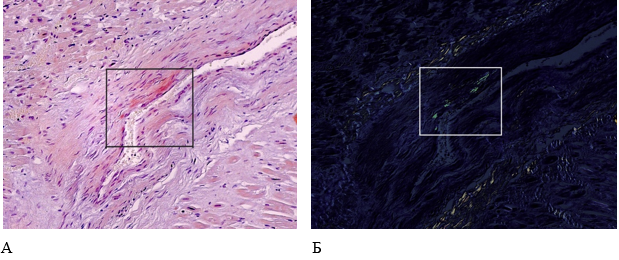
Рисунок 6. Патоморфологические изменения миокарда пациента женского пола, 70 лет, умершего от хронического течения COVID-19. Увеличение ×200. А – Отложения амилоидоподобных масс в стенке кровеносного сосуда (гистохимическая окраска конго красным); Б – яблочно-зеленое свечение амилоида при поляризованном свете (поляризационная микроскопия)
Последующее ИГХ-типирование амилоида выявило иммунопозитивное окрашивание с использованием антител к Р-компоненту амилоида и АА-амилоиду. Иммунонегативная реакция отмечена с использованием антител к AL-каппа, AL-лямбда и транстирретиновому амилоиду (рис. 7).
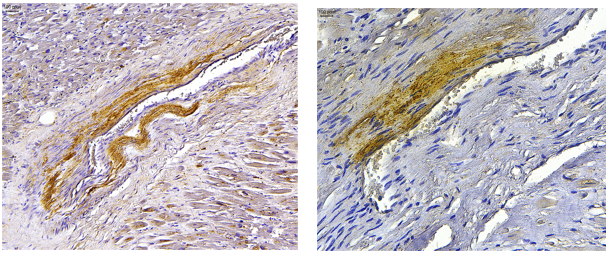
Рисунок 7. Патоморфологические изменения легких пациента женского пола, 70 лет, умершего от хронического течения COVID-19. Увеличение А ×100, Б ×200. А – положительная иммуногистохимическая реакция с использованием антитела к Р-компоненту амилоида, Б – положительная иммуногистохимическая реакция с использованием антитела к сывороточному АА-амилоиду
Печень массой 2440 г, плотная, поверхность гладкая, на разрезе красно-коричневая с нежным мускатным рисунком строения. Микроскопически – гепатоциты в состоянии зернистой дистрофии. Печеночные триады с лимфоцитарной инфильтрацией, не выходящей за ее пределы. Стенки сосудов гиалинизированы с очаговой дезорганизацией и отложениями амилоидных масс, которые имели яблочно-зеленое свечение в поляризованном свете при гистохимической окраске конго красным (рис. 8).
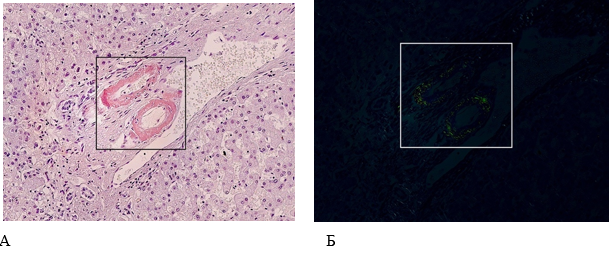
Рисунок 8. Патоморфологические изменения печени пациента женского пола, 70 лет, умершего от хронического течения COVID-19. Увеличение ×200. А – Дезорганизация и отложения амилоидоподобных масс в стенках кровеносных сосудов портального тракта (гистохимическая окраска конго красным); Б – яблочно-зеленое свечение амилоида при поляризованном свете (поляризационная микроскопия)
Почки массой 270 г, капсула с почек снимается легко, обнажая синюшно-коричневую мелкозернистую поверхность, на разрезе граница коры и пирамид нечеткая. Микроскопически – эпителий извитых канальцев с признаками баллонной дистрофии, в состоянии аутолиза, местами слущен в просветы. Клубочки местами склерозированы, часть клубочков гиалинизированы. В стенках единичных кровеносных сосудов отложения амилоидоподобных масс, которые имели яблочно-зеленое свечение в поляризованном свете при окраске конго красным (рис. 9). В клубочковом аппарате амилоидных отложений не обнаружено.
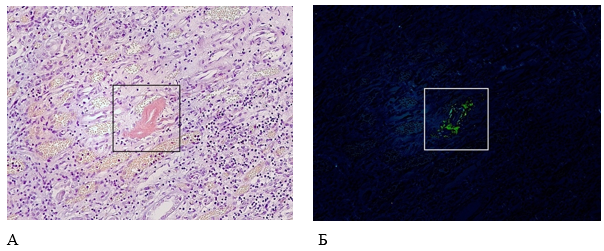
Рисунок 9. Патоморфологические изменения почек пациента женского пола, 70 лет, умершего от хронического течения COVID-19. Увеличение ×200. А – Отложения амилоидоподобных масс в стенках кровеносных сосудов почки (гистохимическая окраска конго красным); Б – яблочно-зеленое свечение амилоида при поляризованном свете (поляризационная микроскопия)
Селезенка массой 120 г, плотная, поверхность гладкая, на разрезе темно-вишневого цвета, без соскоба пульпы. Микроскопически – фрагмент ткани селезенки, покрытый фиброзной капсулой с отходящими от нее трабекулами. Реактивные зоны мальпигиевых телец представлены оскудненными лимфоцитами разной степени дифференцировки и единичными плазматическими клетками, по периферии телец расположены центральные артерии. Красная пульпа отечна, полнокровна. Стенки пульпарных артерий гиалинизированы, в стенках кровеносных сосудов отложения амилоидных масс, которые имели яблочно-зеленое свечение в поляризованном свете при гистохимической окраске конго красным (рис. 10).
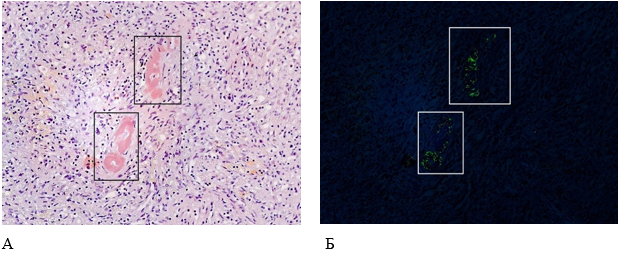
Рисунок 10. Патоморфологические изменения селезенки пациента женского пола, 70 лет, умершего от хронического течения COVID-19. Увеличение ×200. А – Отложения амилоидоподобных масс в стенках кровеносных сосудов селезенки (гистохимическая окраска конго красным); Б – яблочн-зеленое свечение амилоида при поляризованном свете (поляризационная микроскопия)
На основании макро- и микроскопического исследования был сформулирован заключительный патолого-анатомический диагноз:
Основное заболевание. Ишемический инфаркт с геморрагическим пропитыванием в коре и белом веществе теменной доли левого полушария головного мозга, атеросклероз артерий основания (II стадия, 3-я степень, стеноз просветов артерий основания головного мозга до 25%).
Сочетанное заболевание. Постинфарктный кардиосклероз в верхней трети межжелудочковой перегородки, атеросклероз венечных артерий сердца (IV стадия, 3-я степень, стеноз передней межжелудочковой ветви левой венечной артерии до точечного).
Фоновые заболевания. Артериальная гипертензия (масса сердца 320 г, толщина миокарда левого желудочка 1,6 см, артериолонефросклероз). Нарушения ритма сердца: постоянная форма фибрилляции предсердий. Хроническое течение новой коронавирусной инфекции, COVID-ассоциированной с АА-амилоидозом.
Осложнения. Пролежни ягодиц, крестца, спины. Хроническое венозное полнокровие и дистрофия внутренних органов: отеки голеней и стоп, двусторонний гидроторакс (по 300 мл), цианотическая индурация почек и селезенки, «мускатная» печень. Отек легких. Отек головного мозга с вклинением миндалин мозжечка в большое затылочное отверстие.
Сопутствующее заболевание. Атеросклероз аорты (IV стадия, 3-я степень).
Непосредственная причина смерти – отек головного мозга с вклинением миндалин мозжечка в большое затылочное отверстие при явлениях недостаточности кровообращения.
Таким образом, анализируя клинические данные, протокол патолого-анатомического исследования с комплексным патоморфологическим анализом аутопсийного материала, можно сделать вывод, что выявленные патогистологические изменения в легких свидетельствуют об экссудативно-пролиферативной фазе диффузного альвеолярного повреждения, при этом характер поражения легочной стромы носил мозаичный характер во всех долях легких. Применение дополнительных гистохимических и иммуногистохимических методов окраски подтвердило наличие гиалиновых мембран, очаговый фиброз межальвеолярных перегородок, а также дифференцирована плоскоклеточная метаплазия альвеолярного эпителия иммуногистохимической реакцией с использованием антитела к цитокератину 5/6 и впервые подтверждено хроническое течение COVID-19 в легких путем выявления фрагментов S-белка вируса SARS-CoV-2 в альвеолярных макрофагах при применении соответствующего антитела. Помимо этого, в стенках кровеносных сосудов легких, печени, селезенки, почек, сердца и по контурам альвеол выявлены отложения амилоидных масс, которые имели яблочно-зеленое свечение в поляризованном свете при гистохимической окраске конго красным. Последующее ИГХ-исследование с использованием антител к Р-компоненту амилоида и АА-амилоида дифференцировало АА-амилоидоз.
Выявленные авторами конгофильные отложения в стенках кровеносных сосудов паренхиматозных органов (сердца, печени, почек, селезенки, легких) и по контурам альвеол могли либо образоваться в остром периоде инфекционного процесса COVID-19, либо стать причиной хронической персистенции вируса (Long-Covid) с продолжительным хроническим воспалением легких.
Заключение. Клинический случай, представленный в данной работе, ярко демонстрирует хроническое течение новой коронавирусной инфекции, вызванной вирусом SARS-CoV-2, со специфическими патоморфологическими особенностями: внутриклеточные вирусные частицы (положительная реакция на вирусный антиген) в макрофагах, мозаичное диффузное альвеолярное повреждение легких, очаговый фиброз межальвеолярных перегородок, мукоидное набухание стенок артерий и системный АА-амилоидоз с эндотелиальной дисфункцией. В описанном клиническом наблюдении сделано предположение о развитии COVID-19-ассоциированного системного АА-амилоидоза с поражением кровеносных сосудов внутренних органов (легких, сердца, почек, печени, селезенки) и диффузного альвеолярно-септального амилоидоза легких. Вышеописанные изменения в дальнейшем помогут врачам-клиницистам более тщательно проводить обследование данной группы пациентов, скорректировать и предотвратить развитие осложнений в отдаленные сроки течения COVID-19.
Библиографическая ссылка
Гиоева З.В., Конторщиков А.С., Зенцова Е.О., Васюкова О.А., Мхитаров В.А., Кактурский Л.В., Михалёва Л.М. КЛИНИКО-МОРФОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ВНУТРЕННИХ ОРГАНОВ ПРИ ХРОНИЧЕСКОМ ТЕЧЕНИИ COVID-19 (LONG-COVID) // Современные проблемы науки и образования. 2024. № 6. ;URL: https://science-education.ru/ru/article/view?id=33788 (дата обращения: 11.01.2026).
DOI: https://doi.org/10.17513/spno.33788



