Введение
Бульбоуретральные железы наряду с другими железами мужского полового тракта: простатой и семенными пузырьками – образуют жидкую часть эякулята – семенную жидкость, компоненты которой, прежде всего белки, поддерживают подвижность и фертильную способность сперматозоидов в женских половых путях [1]. Кроме того, протеом семенной жидкости делает возможными постэякуляторную коагуляцию спермы и дальнейшее разжижжение сгустка, модулирует взаимодействие гамет, ингибирует антиспермальный иммунитет, участвует в имплантации, проявляет антимикробную и антиоксидантную активность [2, 3, 4].
Подавляющее большинство спермальных белков гликозилированы, то есть являются гликопротеинами различных типов, в которых углеводная составляющая определяет свойства и функциональную специализацию коньюгатов [3, 5]. Нейтральные гликопротеины нейтрализуют остатки мочи в уретре мужчин и кислую среду влагалища, а также облегчают фрикции; кислые сульфатированные гликопротеины обладают выраженной антиоксидантной и антибактериальной активностью; кислые сиалированные гликопротеины поддерживают фертильность сперматозоидов, участвуют в образовании и ликвификации семенного сгустка, регулируют взаимодействие гамет при оплодотворении, ингибируют антиспермальный иммунный ответ в женском репродуктивном тракте [3, 5, 6]. В группе кислых спермальных гликопротеинов обнаружены представитель семейства гранинов – хромогранин А (ХрA), обладающий антибактериальными, антиоксидантными и иммуносупрессорным свойствами [7, 8], и представитель семейства гликоделинов – альфа-2-микроглобулин фертильности (АМГФ, гликоделин S), модулирующий капацитацию и акросомальную реакцию сперматозоидов [4]. Бульбоуретральные железы продуцируют слизистый секрет, богатый кислыми гликопротеинами, преимущественно сиалированными [9], однако сведения о возможности выделения ими ХрА и АМГФ в семенную жидкость в литературе отсутствуют.
Есть мнение, что в образовании секреторного продукта бульбоуретральных желез наряду с концевыми отделами участвуют эпителиоциты протоков. Такое допущение было сделано авторами электронно-микроскопического исследования желез человека, описавшими секреторные гранулы в цитоплазме клеток однослойного эпителия внутридольковых протоков и поверхностных клеток многослойного эпителия главного протока бульбоуретральных желез [10]. Данное наблюдение и основанное на нем предположение не получили дальнейшего развития, и в настоящее время в литературе отсутствуют сведения о секреторной активности эпителиоцитов протоков бульбоуретральных желез и о спектре продуцируемых ими веществ.
Цель исследования – изучение секреторной активности эпителия протоков бульбоуретральных желез человека, его участия в образовании конечного продукта желез и вклада в формирование протеома семенной жидкости.
Материал и методы исследования
Материал для исследования был получен в судебно-медицинских моргах г. Москвы. Вскрытие трупов и взятие материала проводились в соответствии с Приказом Министерства здравоохранения РФ от 6 июня 2013 г. № 354н «О порядке проведения патологоанатомических вскрытий» и Постановлением Правительства РФ от 21.07.2012 № 750 (ред. от 17.12.2016) «Об утверждении Правил передачи невостребованного тела, органов и тканей умершего человека для использования в медицинских, научных и учебных целях, а также использования невостребованного тела, органов и тканей умершего человека в указанных целях». Бульбоуретральные железы исследовали у лиц зрелого возраста (22–45 лет), погибших от случайных причин или умерших вследствие заболеваний, не связанных с патологией органов полости таза (всего 14 аутопсий).
Для светооптического исследования материал фиксировали в 10%-ном формалине (рН 7,2) и заливали в парафин. Срезы толщиной 6–7 мкм окрашивали гематоксилином и эозином, а также использовали для проведения гистохимических и иммуноцитохимических реакций.
Для электронно-микроскопического исследования префиксацию образцов желез осуществляли в 2,5%-ном растворе глютаральдегида на фосфатном буфере (рН 7,3–7,4) в течение 2–3 часов, а затем постфиксировали в 1%-ном растворе четырехокиси осмия на том же буфере в течение 1,5 часов при температуре 4°С. Материал обезвоживали в ацетоне и заключали в смесь эпона и аралдита. Ультратонкие срезы контрастировали уранилацетатом и цитратом свинца.
Для идентификации различных гликопротеинов ставили гистохимические реакции: 1) ШИК-реакция; 2) ШИК-реакция с предварительной обработкой срезов диастазой слюны в течение 1 часа при 37°С; 3) PAPS реакция – ШИК-реакция после предварительной обработки срезов фенилгидразином; 4) окрашивание альциановым синим при рН 2,5; 5) окрашивание альциановым синим при рН 2,5 после предварительного гидролиза срезов в растворе нейраминидазы (фермент Vibrio cholerae, Calbiochem) с концентрацией 1 ед. на 5 мл 1%-ного ацетатного буфера рН 5,5 при 37°С в течение 24 часов; 6) окрашивание альциановым синим при рН 1,0.
Интенсивность гистохимических реакций оценивали с помощью денситометрии на аппаратно-программном комплексе «ДиаМорф Cito» (ЗАО «ДиаМорф», Россия). Измерения проводили в 200 клетках эпителия протоков и концевых отделов от каждого случая (х40). Полученные данные статистически обрабатывали с помощью стандартного пакета программ для персонального компьютера. Для сравнения средних величин использовали критерий Стьюдента.
Иммуноцитохимическое выявление хромогранина А (ХгА) проводили с помощью моноклональных антител против ХгА («Dako Cytomation», Germany). Срезы без предварительной микроволновой обработки инкубировали с антителами (разведение 1:50) в течение 30 минут при комнатной температуре. Продукт реакции выявляли с помощью детекционной системы LSAB («Dako Cytomation», Germany) на основе биотин-стрептавидинового комплекса и пероксидазы.
Выявление альфа-2-микроглобулина фертильности (АМГФ) проводили методом непрямого иммунопероксидазного окрашивания. Срезы подвергали предварительной микроволновой обработке (600 Вт, 20 мин, рН 6,0). В качестве первичных антител использовали моноклональные антитела против АМГФ (ФГБНУ «Научно-исследовательский институт морфологии человека», Россия), очищенные методом ионообменной хроматографии, с исходной концентрацией 2,8 мг/мл в разведении 1:200. Срезы инкубировали с антителами в течение 18 часов при температуре 4°С. Вторичными антителами служили конъюгированные с пероксидазой хрена кроличьи антитела против мышиного иммуноглобулина G («Dako», Denmark). В качестве хромогена использовали 3,3-диаминобензидин тетрагидрохлорид («Sigma», USA). Срезы докрашивали гематоксилином.
Результаты исследования и их обсуждение
Паренхима бульбоуретральных желез представлена слизистыми секреторными отделами и системой выводных протоков. Эпителий внутридольковых протоков однослойный кубический или призматический, междольковые протоки выстланы многослойным эпителием из 4–5 клеточных слоев, поверхностный слой образован клетками кубической или призматической формы.
Электронная микроскопия выявила в цитоплазме клеток однослойного эпителия внутридольковых протоков множество свободных полисом и мелких митохондрий, хорошо развитый гранулярный эндоплазматический ретикулум, умеренно выраженный пластинчатый комплекс. В апикальном полюсе клеток обнаружены многочисленные секреторные гранулы, которые, в отличие от крупных светлых гранул мукоцитов концевых отделов, имели небольшой диаметр и плотную сердцевину. В многослойном эпителии междольковых протоков органеллы были хорошо развиты в клетках средних слоев, а в цитоплазме клеток поверхностного слоя содержались многочисленные секреторные гранулы, схожие по структуре с гранулами клеток внутридольковых протоков. Хорошо развитый аппарат биосинтеза и присутствие секреторных гранул в цитоплазме эпителиоцитов протоков бульбоуретральных желез указывают на их секреторную активность, что подтверждает ранее сделанное предположение о существовании такой возможности [10]. Природа веществ, выделяемых протоковыми эпителиоцитами, была проанализирована гистохимически.
При окрашивании гистологических препаратов реактивом Шиффа позитивную реакцию наряду с концевыми отделами демонстрировали клетки эпителия протоков, что свидетельствовало о присутствии в них гликопротеинов. В однослойном эпителии внутридольковых протоков окрашивалась либо вся цитоплазма клеток, либо только апикальная ее часть. В многослойном эпителии междольковых протоков положительно реагировали все клетки поверхностного слоя (рис. 1).
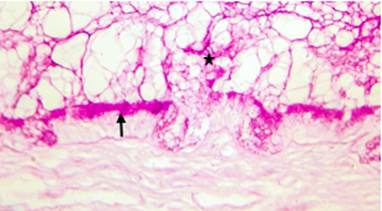
Рис. 1. Бульбоуретральные железы мужчины 35 лет. Фрагмент стенки крупного междолькового протока. В клетках поверхностного слоя многослойного эпителия (стрелка), а также в просвете протока (звездочка) определяется Шифф-позитивный секрет. Окраска: ШИК-реакция, увеличение х400
Обработка срезов диастазой не влияла на интенсивность ШИК-реакции: средние значения оптической плотности цитоплазмы эпителиоцитов протоков, так же как гландулоцитов концевых отделов, до ферментативного гидролиза и после него не отличались, что исключает присутствие гликогена в секрете обоих типов клеток (табл. 1).
Таблица 1
Оптическая плотность цитоплазмы клеток эпителия протоков и секреторных отделов бульбоуретральных желез при различных гистохимических реакциях (M±m)
|
Гистохимические реакции |
Клетки эпителия протоков (усл. ед.) |
Клетки секреторных отделов (усл. ед.) |
|
|
ШИК-реакция |
До гидролиза диастазой |
39,40±1,63 |
29,69±0,49 |
|
После гидролиза диастазой |
39,61±1,43 |
30,56±1,64 |
|
|
PAPS-реакция |
До обработки фенилгидразином |
40,58±1,18 |
25,38±0,39 |
|
После обработки фенилгидразином |
15,48±1,0* |
12,02±0,24* |
|
|
Окрашивание альциановым синим при рН 2,5 |
До гидролиза нейраминидазой |
5,45±0,59 |
3,59±0,05 |
|
После гидролиза нейраминидазой |
3,17±0,30* |
2,09±0,05* |
|
* различия с предыдущей группой статистически значимы (p<0,05)
Предварительная обработка срезов фенилгидразином (PAPS-реакция) снижала Шифф-позитивное окрашивание в клетках протоков на 62% и секреторных отделов на 53% (табл. 1), демонстрируя, что и те и другие клетки синтезируют как нейтральные (уменьшение окрашивания), так и кислые (остаточное окрашивание) гликопротеины. Большее падение показателей оптической плотности цитоплазмы клеток протокового эпителия по сравнению с гландулоцитами концевых отделов указывает на преобладание в секрете протоковых эпителиоцитов нейтральных гликопротеинов, в отличие от паритетного соотношения кислых и нейтральных коньюгатов в клетках концевых отделов.
При окрашивании альциановым синим при рН 2,5 положительную реакцию демонстрировали большинство эпителиоцитов внутридольковых протоков, поверхностные клетки эпителия междольковых протоков (рис. 2), а также мукоциты секреторных отделов, что подтверждает присутствие в них кислых гликопротеинов.

Рис. 2. Бульбоуретральные железы мужчины 40 лет. Фрагмент стенки крупного междолькового протока. В клетках поверхностного слоя многослойного эпителия (стрелка), а также в просвете протока (звездочка) определяется альцианофильный секрет. Окраска: альциановый синий (рН 2,5), увеличение х400
Предварительный гидролиз нейраминидазой уменьшал альцианофилию, при этом снижение показателей оптической плотности цитоплазмы в клетках протоков и секреторных отделов было одинаковым и составило 42% (табл. 1). Полученные результаты указывают на присутствие и в тех и других клетках сиалированных гликопротеинов, причем в одинаковых пропорциях. Остаточная альцианофилия может быть обусловлена сульфатированными гликопротеинами, возможное присутствие которых выявляли реакцией с альциановым синим при рН 1,0. В этом случае в эпителии протоков положительно реагирующих клеток не обнаруживалось, в отличие от концевых отделов, некоторые из которых окрашивались. Негативная реакция протоковых эпителиоцитов исключает их способность к секреции сульфатированных гликопротеинов, а альцианофилия их цитоплазмы после гидролиза нейраминидазой обусловлена наличием резистентных к ферменту сиалированных гликопротеинов.
Проведенный гистохимический анализ подтверждает данные ультрамикроскопического исследования о секреторной способности эпителия выводных протоков бульбоуретральных желез. Участие протоков в формировании секрета желез описано для некоторых из них, например поджелудочной и слюнных желез [11]. Но в этих железах такая активность характерна только для начальных отделов протоковой системы – вставочных, а в слюнных железах и исчерченных протоков, эпителиоциты которых выделяют в секрет или реабсорбируют из него воду и ионы, регулируя концентрацию и электролитный состав конечного продукта [11]. Результаты настоящего исследования показывают, что в бульбоуретральных железах эпителиоциты выводных протоков разного калибра продуцируют основной компонент секрета – гликопротеины, которые, поступая в семенную жидкость, становятся частью ее протеома.
Состав гликопротеинов, выявленный комплексом гистохимических реакций в клетках протоков и концевых отделов, в целом идентичен: он включает нейтральные и кислые сиалированные гликопротеины, среди последних присутствуют сиалидазолабильные и сиалидазорезистентные типы молекул. Однако сульфатированные гликопротеины не входят в спектр веществ, секретируемых эпителием протоков, что отличает эпителиоциты протоков от клеток концевых отделов, способных к продукции этих веществ. Вместе с тем, несхожесть ультраструктуры секреторных гранул, а именно мелких с плотной сердцевиной в эпителиоцитах протоков и крупных светлых в мукоцитах концевых отделов, указывает на возможность существования иных, чем обнаруженные при гистохимическом анализе, различий состава секрета этих клеток, что нашло подтверждение в результатах иммуноцитохимического исследования.
При реакции с антителами к ХгА окрашивались клетки эпителия протоков бульбоуретральных желез, тогда как секреторные отделы оставались полностью ХгА-негативными (рис. 3). В однослойном эпителии внутридольковых протоков положительно реагирующие клетки составляли большинство, продукт реакции равномерно распределялся по всей цитоплазме либо концентрировался в ее апикальной части. В эпителии междольковых протоков ХгА экспрессировали почти все клетки поверхностного слоя, эпителиоциты глубоких слоев окрашивались слабее, часть из них не содержала продукта реакции.
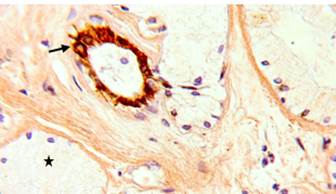
Рис. 3. Бульбоуретральные железы мужчины 27 лет. Экспрессия хромогранина А клетками однослойного эпителия внутридолькового протока (стрелка) на фоне хромогранин-негативных концевых отделов (звездочка). Иммуноцитохимическая реакция с антителами к хромогранину А, докраска ядер гематоксилином, увеличение х630
Присутствие в клетках протоков ХгА может быть обусловлено его участием в гранулопоэзе и образованием «пор слияния» гранул с плазмолеммой при экструзии секрета [12]. Гранулы, содержащие хромогранины, характеризуются электронноплотной сердцевиной [8], что соответствует ультраструктуре гранул, обнаруженных в цитоплазме клеток протокового эпителия бульбоуретральных желез. Кроме того, ХгА может быть частью секрета эпителиоцитов протоков. Хромогранины являются прогормонами, так как, подвергаясь протеолизу, дают начало биоактивным пептидам с широким спектром действия, при этом и хромогранин, и его производные выделяются в различные секреты, в том числе в сперму [8].
Функциональное значение спермальных гранинов и их пептидов остается до конца не ясным. Антибактериальные, антигрибковые и антиоксидантные свойства этих веществ позволяют рассматривать их как компонент защитной системы эякулята, а выраженный иммуносупрессорный эффект делает их необходимыми для предотвращения иммунной агрессии на сперматозоиды в женских половых путях [1, 8].
В семенной жидкости ХгА и его производные определяются в составе экзосом, мембранных везикул, транспортирующих вещества для жизнеобеспечения сперматозоидов в женских половых путях. Считается, что экзосомы образуются в результате секреции эпителиальных клеток придатка семенника, простаты и семенных пузырьков [1, 13], хотя участие иных отделов мужского полового тракта не исключается [14]. Полученные результаты позволяют допустить образование экзосом клетками протоков бульбоуретральных желез.
Иммуноцитохимическая реакция с антителами к АМГФ выявила его экспрессию в цитоплазме эпителиоцитов выводных протоков желез и отсутствие таковой в секреторных отделах (рис. 4). Во внутридольковых протоках распределение продукта реакции характеризовалось мозаичностью: в некоторых из них все клетки были АМГФ-позитивными, в других окрашивалась лишь часть эпителиоцитов, а в отдельных внутридольковых протоках все клетки давали отрицательную реакцию. В междольковых протоках АМГФ экспрессировали все клетки эпителиального пласта.
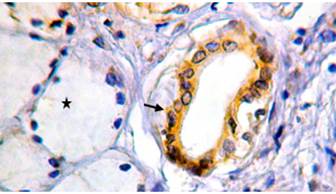
Рис. 4. Бульбоуретральные железы мужчины 24 лет. Экспрессия АМГФ клетками эпителия внутридолькового протока (стрелка), в концевых отделах (звездочка) реакция отрицательная. Иммуноцитохимическая реакция с антителами к АМГФ, докраска ядер гематоксилином, увеличение х630
АМГФ, или гликоделин S, составляет до 3% общего белка семенной жидкости человека и так же, как ХгА, содержится в экзосомах [14]. АМГФ связывается с гликокаликсом головки сперматозоидов, препятствуя преждевременной акросомальной реакции, а ферментативное удаление его с мембраны сперматозоидов после их прохождения через цервикальный канал инициирует процесс капацитации [3, 4]. АМГФ участвует в селекции мужских гамет, подавлении антиспермального иммунитета, транспорте стероидных молекул, преимущественно тестостерона [4, 14, 15]. Cчитается, что этот гликопротеин продуцируется в сперму семенными пузырьками и ампулярной частью семявыносящего протока [3, 4]. Результаты настоящего исследования позволяют допустить возможность выделения АМГФ в семенную жидкость эпителиоцитами протоков бульбоуретральных желез.
Заключение
Эпителиоциты протоков бульбоуретральных желез человека, практически все клетки однослойного эпителия внутридольковых протоков и преимущественно поверхностные клетки многослойного эпителия междольковых протоков обладают секреторной активностью и участвуют в образовании конечного продукта желез, продуцируя гликопротеины. Так же как и клетки концевых отделов, протоковые эпителиоциты образуют нейтральные и кислые гликопротеины. В составе последних присутствуют сиалидазолабильные и сиалидазорезистентные типы, но отсутствуют сульфатированные гликопротеины, что отличает синтетический профиль протоковых эпителиоцитов от такового в клетках секреторных отделов, способных к продукции этого типа веществ. Среди кислых гликопротеинов, содержащихся в эпителиальных клетках протоков, обнаружены ХгА и АМГФ, экспрессия которых в концевых секреторных отделах не выявлялась. Гликопротеины, продуцируемые эпителием протоков бульбоуретральных желез, в составе их секрета поступают в эякулят и участвуют в формировании протеома семенной жидкости.
Библиографическая ссылка
Боронихина Т.В., Яцковский А.Н. СЕКРЕТОРНАЯ АКТИВНОСТЬ ПРОТОКОВ БУЛЬБОУРЕТРАЛЬНЫХ ЖЕЛЕЗ ЧЕЛОВЕКА // Современные проблемы науки и образования. 2024. № 5. ;URL: https://science-education.ru/ru/article/view?id=33742 (дата обращения: 25.02.2026).
DOI: https://doi.org/10.17513/spno.33742



