Введение
Переработка ягодного сырья сегодня занимает одно из важных мест в отечественной пищевой промышленности. Технология производства пищевых продуктов на основе ягод (сок, варенье, мармелад, джем, начинка для хлебобулочных изделий и др.) сопряжена с ростом ресурсопотребления. При этом происходит воздействие на окружающую природную среду, так как отходы от переработки ягод (косточки, кожица, кисть) должным образом не используются, а утилизируются на неконтролируемые свалки либо на мусорные полигоны для последующего сжигания. В результате образуются вредные и даже опасные токсические газы, негативно влияющие на экологию районов расположения перерабатывающих предприятий и сбора дикорастущих ягодных культур. Между тем известно, что в составе отходов от переработки ягодных растений присутствуют витамины, микро- и макроэлементы, соединения растительных полифенолов, проявляющих антиоксидантные свойства и способность к выведению из организма ионов тяжелых металлов [1, 2, 3]. В Уссурийской тайге произрастает значительное количество разнообразных ягодных культур: боярышник, рябина, виноград, лимонник, калина, шиповник и др. Проведенные ранее исследования выявили наличие в отжиме из осей соцветий, кожицы, семян, листьев и черешков ягодных культур широкого спектра полезных для здоровья человека биологически активных веществ [4]. В состав водно-спиртового экстракта из отжима калины входят полифенольные соединения, биофлавоноиды, микро- и макроэлементы. В выделенной из экстракта фракции общих липидов исследовались состав и соотношение отдельных фосфолипидов (ФЛ) и нейтральных липидов (НЛ) [5]. В ряду ФЛ присутствуют фосфатидилхолин (ФХ), фосфатидилэтаноламин (ФЭ) и фосфатидилсерин (ФС). Данные фосфолипиды не только служат главными компонентами биомембран, но и способны к взаимному превращению, так как связаны между собой метаболически. Нейтральные липиды представлены как мембранообразующими фракциями (холестерин (ХС)), свободные жирные кислоты (СЖК)), так и компонентами-метаболитами для ряда биохимических реакций в живом организме: эфиры холестерина (ЭХС), эфиры жирных кислот (ЭЖК), триацилглицерины (ТАГ). Важно отметить наличие комплекса полифенолов (ПФ), которые обладают антиоксидантными свойствами и нейтрализуют активные формы кислорода (АФК) [6]. В соответствующих концентрациях АФК выполняют важные регуляторные функции в различных окислительно-восстановительных реакциях, сопряженных с работой механизмов сигнальной клеточной системы. Однако при их избытке АФК реагируют с молекулами белков, липидов, нуклеиновых кислот, обусловливая повреждение и изменение их структуры. При этом нарушается функционирование системы антиоксидантной защиты и резко снижается устойчивость организма в экстремальных условиях [7].
Негативное влияние стресса, испытываемого человеком в условиях глобальной урбанизации, экологических и политических ситуаций, – одна из актуальных проблем современной жизни. Характер ответа организма в условиях стресса зависит от продолжительности и интенсивности действия патологических факторов. При умеренном воздействии повышается активность механизмов биохимической адаптации к новым условиям, а длительное и интенсивное воздействие стрессовых факторов разной природы приводит к истощению метаболических резервов, повышенной концентрации АФК. Последние формируют состояние окислительного стресса за счет активизации перекисного окисления липидов (ПОЛ). Результаты исследований, проведенных на животных, доказывают, что окислительный стресс обусловливает возникновение и развитие различных патологических процессов [8]. В организме человека оксидативный стресс вызывает атеросклероз, диабет, ожирение и иное, а также приводит к нарушениям в сердечной деятельности и, как результат, преждевременному старению организма [9]. В связи с этим возникает необходимость в профилактике стрессовых воздействий с помощью растительных экстрактов, содержащих широкий спектр биологически активных веществ, участвующих в метаболических реакциях организма.
Цель исследования – изучить влияние экстракта из отжима калины на показатели липидного обмена печени крыс в условиях экспериментального стресса.
Материал и методы исследования
Извлечение экстракта из исходного сырья осуществляли методом реперколяции 40%-ным этиловым спиртом. В качестве препарата сравнения применяли аптечный «Экстракт элеутерококка» – известный гепатопротектор. Эксперимент проводили на крысах-самцах линии Wistar массой 180–200 г. Животных содержали на стандартном рационе питания в условиях вивария. Стресс вызывали путем вертикальной фиксации животных за дорзальную шейную складку на 22 часа [10]. Растворы экстрактов элеутерококка и калины вводили парентерально дважды: до вертикальной фиксации и через 4 часа после в дозе 100 мг общих ПФ на 1 кг массы тела (терапевтическая доза для полифенольных гепатопротекторов). Более 30% от сухого остатка экстракта калины составляли общие ПФ. Экспериментальные животные в количестве 40 особей были разделены на четыре равные группы: 1-я – контроль, 2-я – стресс, 3-я – стресс + экстракт калины, 4-я – стресс + экстракт элеутерококка. Эксперименты с животными проводили в соответствии: с Директивой Европейского парламента и Совета Европейского Союза 2010/63/ЕС от 22 сентября 2010 г. о защите животных, использующихся для научных целей; с Федеральным законом от 27.12.2018 № 498-ФЗ (ред. от 27.12.2019) «Об ответственном обращении с животными и о внесении изменений в отдельные законодательные акты Российской Федерации». Липидные экстракты из ткани печени готовили согласно методу [11]. С помощью микротонкослойной хроматографии на силикагеле осуществляли разделение ФЛ и НЛ на отдельные фракции [12, 13]. Результаты представлены в процентах от общей суммы НЛ и ФЛ соответственно. Статистическую обработку полученных данных осуществляли с использованием пакета программ Instat 3.0 (Graph Pad. Software Inc. USA, 2005).
Результаты исследования и их обсуждение
Исследование липидного обмена в печени животных, подвергнутых стрессу (2-я группа), показало, что фракционный состав НЛ характеризовался увеличением количества свободных жирных кислот (СЖК) на 9,0% (p<0,05), триацилглицеринов (ТАГ) на 9,5% (p<0,05) и холестерина (ХС) на 19,0% (p<0,05) относительно контроля (рис. 1), что указывает на активацию периферического липолиза. В результате образуется избыточное количество ацетил-КоА, который и обусловливает активный синтез ХС.
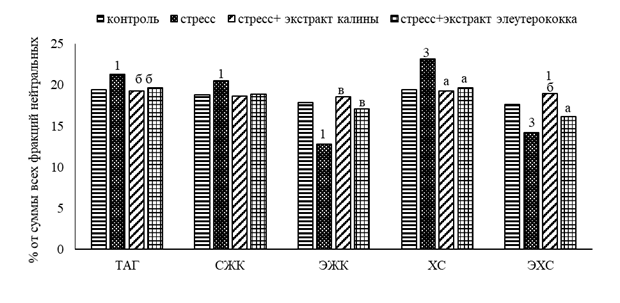
Рис. 1. Влияние экстрактов из калины и элеутерококка на фракционный состав нейтральных липидов в печени крыс при стрессе. ТАГ – триацилглицерины, СЖК – свободные жирные кислоты, ЭЖК – эфиры жирных кислот, ХС – холестерин, ЭХС – эфиры холестерина. Различия статистически достоверны при: 1, а – р<0,05; 2, б – р<0,01; 3, в – р<0,01. 1, 2, 3 – сравнение с контролем; а, б, в – сравнение со стрессом
К тому же скорость катаболизма липидов усиливает синтез жирных кислот и глицерина, что и определяет увеличение содержания ТАГ. На нарушение этерифицирующей функции печени указывает снижение уровня эфиров жирных кислот (ЭЖК) на 28% (p<0,001) и эфиров холестерина (ЭХС) на 20% (p<0,001).
При анализе фосфолипидного спектра при стрессе отмечалось снижение уровня главных структурных фосфолипидов (ФХ и ФЭ) в среднем на 18% (p<0,01–0,001) (рис. 2). При этом значительно увеличилось количество метаболически активных фракций – ФС на 27% (p<0,01) и фосфатидилинозита (ФИ) на 26% (p<0,01), что обусловливает ферментативную активность Na+-K+-АТФ-азы. Обращают на себя внимание существенные изменения в значениях лизофосфолипидов: повысилось содержание лизофосфатидилхолина (ЛФХ) на 34% (p<0,001) и лизофосфатидилэтаноламина (ЛФЭ) на 32% (p<0,001). Данный факт подтверждает повышение активности фермента фосфолипазы А2 и усиление перекисного окисления липидов (ПОЛ). Дифосфатидилглицерин (ДФГ) – фосфолипид, участвующий в ферментативных реакциях дыхательной цепи. Снижение уровня ДФГ на 35% (p<0,05) указывает на замедление процессов синтеза АТФ.
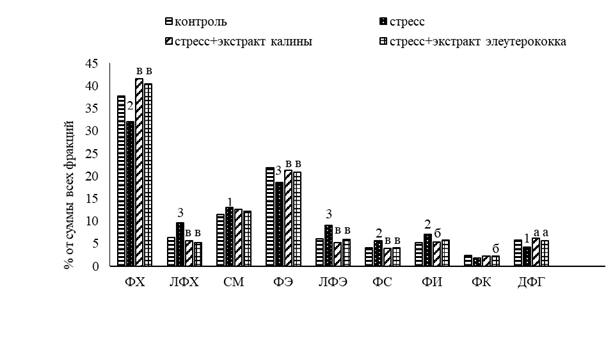
Рис. 2. Влияние экстрактов из калины и элеутерококка на фракционный состав фосфолипидов в печени крыс при стрессе. ФХ – фосфатидилхолин, ЛФЭ – лизофосфатидилхолин, СМ – сфингомиелин, ФЭ – фосфатидилэтаноламин, ЛФЭ – лизофосфатидилхолин, ФС – фосфатидилсерин, ФИ – фосфатидилинозит, ФК – фосфатидная кислота, ДФГ – дифосфатидилглицерин. Различия статистически достоверны при: 1, а – р<0,05; 2, б – р<0,01; 3, в – р<0,01. 1, 2, 3 – сравнение с контролем; а, б, в – сравнение со стрессом
Показательно, что при стрессе отмечался повышенный уровень сфингомиелина (СМ) (12,96%, р<0,05) по сравнению с контрольным значением (11,43%). Это компенсаторная реакция в ответ на снижение уровня ФХ. Представленные изменения в содержании отдельных фракций ФЛ и НЛ свидетельствуют о дисбалансе в соотношении липидных компонентов в ткани печени крыс 2-й группы.
Введение экстрактов калины (3-я группа) и элеутерококка (4-я группа) экспериментальным животным способствовало положительной динамике в нормализации липидного обмена. Так, количество СЖК в печени животных, которым вводили экстракт калины, составляло 18,65% (в контроле 18,76%), ТАГ – 19,26% (р<0,01) (в контроле 19,41%). А аналогичные показатели в группе животных при введении экстракта элеутерококка были 19,63% и 18,83% (р<0,01) соответственно. Следовательно, содержание СЖК и ТАГ в обеих группах животных было равным контрольным значениям. При этом после введения экстракта калины уровень ЭХС (18,91%, р<0,01) и ЭЖК (18,56%, р<0,001) был достоверно выше в сравнении с «чистым» стрессом (17,63% и 17,84% соответственно). В печени животных 4-й группы данные фракции имели более низкие значения: ЭХС составляли 16,12% (р<0,05), а ЭЖК – 17,06% (р<0,001). Таким образом, применение обоих экстрактов препятствовало накоплению ТАГ и СЖК и способствовало сохранению этерифицирующей функции печени, что предполагает их восстановительные свойства.
Во фракциях фосфолипидов следует отметить более высокое содержание ФХ не только в сравнении с соответствующим показателем у животных 2-й группы (стресс), но и с аналогичным показателем контрольной группы. Так, количество ФХ при применении экстрактов калины и элеутерококка составляло 41,59% (р<0,001) и 40,44%(р<0,001) соответственно. При стрессе этот показатель был 32,06%, в контрольной группе животных – 37,75%. А содержание ФЭ в печени животных 3-й и 4-й групп соответствовало контрольному значению, но было выше, чем при стрессе.
При этом количество ЛФХ и ЛФЭ достоверно уменьшилось и максимально приблизилось к контрольному уровню, что объясняется подавлением активности фосфолипаз полифенолами, входящими в состав экстрактов. Обладая способностью улавливать свободные радикалы, полифенольные соединения тем самым замедляют процессы перекисного окисления липидов, что, в свою очередь, позволяет смягчить состояние окислительного стресса [14]. Отмечалось увеличение количества фосфатидной кислоты, являющейся источником фосфолипидов. На усиление активности ферментов дыхательной цепи и синтеза молекул АТФ указывает повышение уровня ДФГ в ткани печени экспериментальных животных. Таким образом, введение экстрактов калины и элеутерококка способствовало восстановлению соотношения фракций ФЛ в печени обеих групп животных. Применение экстракта калины показало более выраженный восстановительный эффект, в отличие от экстракта элеутерококка.
Заключение
Результаты проведенных исследований показывают, что при стрессе в липидном обмене печени животных наблюдались изменения, сопровождающиеся нарушением в составе и соотношении отдельных фракций нейтральных липидов и фосфолипидов. Повышение содержания свободных жирных кислот и триацилглицеринов указывает на развитие жирового гепатоза. Интенсивность липолитических реакций в жировой ткани обусловливает выход жирных кислот в кровяное русло и активный транспорт их в печень. Дальнейшее окисление ЖК сопровождается образованием ацетил-КоА, который в большой концентрации приводит к возникновению и развитию атеросклероза. Рост величин фракций ЛФХ и ЛФЭ при одновременном снижении уровня соответствующих фосфолипидов (ФХ и ФЭ) подтверждает известные в литературе данные об усилении перекисного окисления липидов и активации фосфолипаз.
Применение экстрактов из отжима калины и элеутерококка восстанавливало баланс фракционного состава НЛ и ФЛ в печени опытных животных до контрольного уровня. По степени выраженности восстановительного эффекта экстракт калины превосходил экстракт элеутерококка. По-видимому, такое проявление гепатозащитного действия экстракта калины обусловлено наличием в его составе комплекса полифенольных соединений, а также важных липидных компонентов, способствующих восстановлению и стабилизации процессов метаболизма липидов в условиях стресса.
Таким образом, применение экстракта из отжима калины в качестве профилактического средства при стрессе представляется актуальным и перспективным.
Библиографическая ссылка
Лесникова Л.Н., Кушнерова Н.Ф., Фоменко С.Е., Спрыгин В.Г., Мерзляков В.Ю., Другова Е.С. ВЛИЯНИЕ ЭКСТРАКТА ИЗ КАЛИНЫ НА ЛИПИДНЫЙ ОБМЕН ПЕЧЕНИ ПРИ ЭКСПЕРИМЕНТАЛЬНОМ СТРЕССЕ // Современные проблемы науки и образования. 2024. № 5. ;URL: https://science-education.ru/ru/article/view?id=33739 (дата обращения: 25.02.2026).
DOI: https://doi.org/10.17513/spno.33739



