Введение. В хирургической практике постоянно происходит внедрение так называемых мини-инвазивных технологий, однако риск осложнений любой операции остается [1; 2]. Целенаправленная деятельность по совершенствованию и поиску новых приемов операционной техники в формате предупреждения и своевременного устранения осложнений, обусловленной хирургической активностью – постоянная составляющая лечебно-диагностического процесса. Ненадлежащее осуществление ХргВм представляет собой угрозу неудовлетворительного качества оказания медицинской помощи (МедП) больным патологическими состояниями хирургического профиля [3]. Исключением не оказываются осложнения РПрЭ, наблюдаемые у больных, оперированных по поводу РПрЖ [4; 5]. В этой связи формулирование и обоснование рекомендаций по минимизации показателя частоты случаев формирования негативных последствий данных ХргВм – важная задача современных медицинских научных исследований в урологии. Специалисты связывают особые надежды с масштабным внедрением в качестве хирургических активов онкоурологии современных инновационных технологий выполнения ХргВм (в целом) и РПрЭ в частности [6; 7]. Поэтому заинтересованный анализ сведений о причинах осложнений РПрЭ с оценкой главных поводов их индукции (а также методов профилактики и коррекции) данных компликаций – значимо для хирургии, онкологии, урологии [8; 9].
Цель исследования. Осуществить анализ частоты возникновения, а также причины осложнений после радикальной простатэктомии.
Материалы и методы исследования. Осуществлен анализ данных о 976 наблюдениях за больными РПрЖ, госпитализированными в 2010-2024 гг. в СПб ГБУЗ «Клиническая больница Святителя Луки» (Клиника). Всем больным выполнены мини-инвазивные виды РПрЭ. В 601 случае выполнено эндовидеохирургическое (лапаро- и экстраперитонеоскопическое) ХргВм, а в 375 – робот-ассистированное.
Осуществление РПрЭ не удалось без осложнений, среди которых в т.ч. и связанные с травмами во время операции (48 случаев - 4,9%).
Компликации учитывались по Clavien-Dindo - классификации, используемой для оценки результатов ХргВм [10]. Вместе с тем данная общепринятая классификация отрицательных результатов операций не в полной мере учитывает все негативные последствия проведения ХргВм и причины их индукции, обусловленные осуществлением именно РПрЭ. Поэтому оценка последствий осложнений осуществлялась и в формате специфичности профиля состояний, осложняющих операцию, в т.ч. с учетом сроков выявления компликаций (пери-, интра- и послеоперационные/ранние/поздние); численности попыток устранения осложнений неоперативными методами, вариантов, применяемых операционных доступов и методик.
Клинические случаи исследования сгруппированы в 3 группы. Отдельно учитывались сведения об эффективности масштабирования инновационных технологий проведения операций, по мере обретения специалистами Клиники должного опыта, с учетом ее оснащенности высокотехнологичными приборами и расходными материалами.
В 1-ю группу (этап освоения технологии РПрЭ) включили данные о больных, которым оказание МедП осуществлялось в 2010-2014 гг. (105 наблюдений). Во 2-й группе исследования анализу подвергнуты сведения о результатах хирургической помощи больным РПрЖ в 2014-2018 гг. (этап внедрения специалистами Клиники современных (шовных и др.) материалов в ходе выполнения операций с обретением опыта применения технических средств и инструментария, обеспечивающих минимальную травматичность ХргВм) - 245 случаев. В 3-ю группу включены материалы о 526 больных РПрЖ, перенесших операции в 2018-2023 гг., когда ХргВм сопровождались наращиванием опыта использования робототехники и ряда инновационных технологий, основанных в формате системы искусственного интеллекта (ИИ) при клинико-дифференцированном подходе.
Каждый случай оказания хирургической помощи больным РПрЖ базисно оценен по длительности выполнения ХргВм (в часах); с учетом видов случайных ятрогенных осложнений; с фиксацией сроков дренирования vesica urinaria катетером; оценкой продолжительности пребывания больных в стационаре в целом, а также эффективности оказания МедП пациентам с соблюдением принципов безопасности в онкологии и достижения позитивных результатов в восстановлении функции органов малого таза.
Неспецифическими компликациями ХргВм, выделяемыми во всех группах исследования, считали: эпизоды кровотечения в зонах ХргВм; индукцию инфекционно-воспалительных состояний; случаи несостоятельности уретроцистоанастомоза, лимфореи или лимфоцеле, травмы внутренних органов.
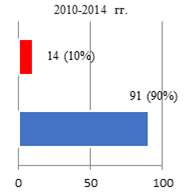
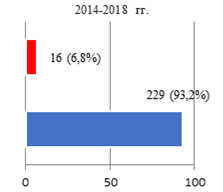
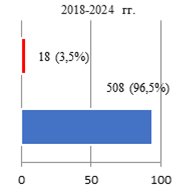
Результаты исследования и их обсуждение. Оценка параметров осложнений РПрЭ у больных всех групп исследования позволила фиксировать факт о том, что чаще всего (10%) компликации констатировали при освоении технологии ХргВм. По мере обретения специалистами Клиники опыта осуществления РПрЭ параметр частоты выявляемых компликаций снижался: во II группе – 6,8%, а в III – 3,5% соответственно (рис. 1).
 осложнения
осложнения
Рис. 1. Соотношение числа осложнений РПрЭ на этапах исследования
При оценке тяжести компликаций, констатируемых при РПрЭ по градации Clavien-Dindo [4], выявлено, что во всех группах исследования чаще всего доминировали осложнения IIIа степени - 15 случаев (табл. 1).
Таблица 1
Осложнения РПрЭ с учетом степени их тяжести (по Clavien-Dindo, 2009)
|
Степень тяжести осложнений |
Количество и виды осложнений, выявленных при РПрЭ |
|||
|
2010-2014 гг., n = 105 |
2014-2018 гг., n = 245 |
2018-2024 гг., n = 526 |
Всего, n=976 |
|
|
I |
3 |
3 |
2 |
8 |
|
II |
Кровотечение – 2 ОКН – 1 |
Кровотечение – 1 |
Кровотечение – 4 |
8 |
|
IIIa |
Мочевой затек – 3 |
Мочевой затек – 3 Лимфоцеле – 4 |
Мочевой затек – 2 Лимфоцеле – 3 |
15 |
|
IIIb |
Кровотечение – 2 Несостоятельность уретроцистоанастомоза (НУЦА) – 1 |
Кровотечение – 2 НУЦА – 2 |
Кровотечение – 3 НУЦА – 1 Пузырно-прямокишечный свищ - 1 |
12 |
|
IVa |
ТЭЛА* – 1 п/о перитонит, сепсис – 1 |
п/о перитонит, сепсис – 1 |
ОНМК** – 1 Перитонит, сепсис – 1 |
5 |
|
IVb |
- |
- |
- |
- |
|
V |
- |
- |
- |
- |
|
Всего |
14 (10%) |
16 (6,8%) |
18 (3,5%) |
48 (4,9%) |
Примечание. * тромбоэмболия легочной артерии, ** острое нарушение мозгового кровообращения.
Неудачи проведения РПрЭ, обычно нивелировались во время реопераций, осуществляемых под местной анестезией.
Осуществление тазовой лимфодиссекции (ТЛД) при выполнении РПрЭ нередко сопряжено с обширным удалением тканей, располагающихся рядом с магистральными сосудами, мочеточниками, запирательными нервами. Кроме того, ТЛД выполняется в непосредственной анатомической близости от слепой, ободочной, сигмовидной кишок. Оценивая сведения о компликациях, учтенных в интра- и раннем послеоперационном периоде у больных, подвергшихся РПрЭ, нельзя не отметить, что чаще всего эти негативные последствия ХргВм сопряжены с синхронным осуществлением ТЛД (рис. 2).


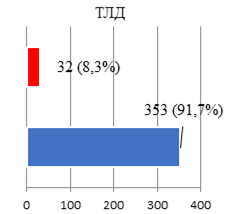
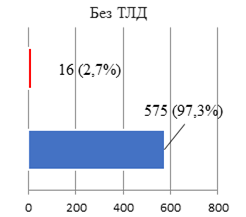
Рис. 2. Сравнительные показатели частоты осложнений РПрЭ при дополнении операции ТЛД
В таблице 2 содержится информация о немотивированных особенностях проведения ХргВм, сопровождавшихся повреждением внутренних органов и анатомических структур, располагающихся вблизи от предстательной железы - ПрЖ (табл. 2).
Таблица 2
Интраоперационные повреждения структур и органов БрП* и ЗБрП** у пациентов, подвергшихся РПрЭ
|
Травмы органов и структур |
Количество случаев (%) при выполнении РПрЭ |
|
не было |
959 (98,3) |
|
выявлены травмы |
17 (1,7) |
|
- кишок |
5 (0,51) |
|
тонкой |
1 (0,1) |
|
толстой |
1 (0,1) |
|
прямой |
3 (0,31) |
|
- мочеточника |
3 (0,31) |
|
- запирательного нерва |
2 (0,2) |
|
- подвздошных сосудов |
2 (0,2) |
|
Всего |
976 (100) |
Примечание. * брюшной полости, ** забрюшинного пространства.
Травмы органов БрП и ЗБрПр при осуществлении РПрЭ (всего 17 (1,7%) случаев) чаще индуцировались местной распространенностью опухолевого процесса; масштабностью спаек, сформированных вследствие предыдущих ХргВм на органах БрП и малого таза; выпадением из поля эндоскопической визуализации хирургических инструментов; электротравмой при контакте с сосудами или полыми органами БрП и ЗБрП.
Компликации, выявленные интраоперационно, устранялись незамедлительно. Это не было сопряжено с каким-либо негативным последствием проведения ХргВм. В нескольких наблюдениях осложнения РПрЭ оказывались причинами более длительного (чем в среднем) пребывания больных в стационаре и осуществления повторных ХргВм.
В 2 наблюдениях (0,2%) при РПрЭ отмечены интраоперационные повреждения подвздошных сосудов. Условиями, способствующими данным повреждениям, были: выпадение из поля эндоскопического мониторинга хирургических инструментов во время проведения роботизированной РПрЭ; еще в одном наблюдении электротравма сосуда произошла во время операции из-за случайного контакта монополярных ножниц со стенкой сосуда. Повреждения подвздошных сосудов, распознанные интраоперационно, устранялись путем ушивания дефектов сосудистой стенки. Значимым условием, необходимым для качественного восстановления целости стенки сосуда с минимальной кровопотерей, оказывается его мобилизация на протяжении с временным пережатием для изоляции из кровотока (рис. 3). В некоторых случаях повреждения подвздошных вен временный гемостаз до ушивания дефекта стенки вены может быть осуществлен путем повышения в брюшной полости давления CO2 до 20–25 ммHg.
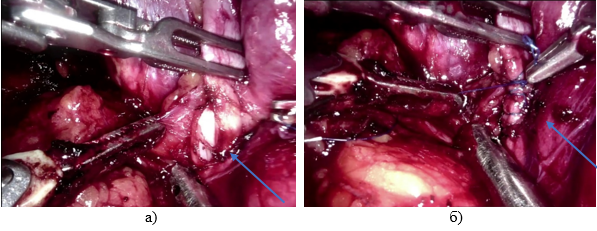
Рис. 3. Вид во время эндоскопии травмы наружной правой подвздошной вены при осуществлении РПрЭ: а) повреждение сосуда; б) вид его ушитого дефекта
Во время лапароскопического проведения РПрЭ травмы тонкой и толстой кишок констатированы в двух случаях (0,2%). Они обусловливались нерациональностью выбранного хирургического доступа и, в связи с этим, - затруднениями в проведении манипуляций в брюшной полости. В одном случае при РПрЭ участок тонкой кишки оказался травмированным при адгезиолизисе у пациента с выраженным спаечным процессом, вызванным предыдущими ХргВм. У одного пациента вследствие манипуляций, осуществленных хирургическими инструментами вне эндоскопического поля зрения, произошла перфорация сигмовидной кишки.
Как уже отмечалось, в большинстве (14) наблюдений повреждения органов при проведении РПрЭ диагностированы и устранены интраоперационно. Подобные технологические детали осуществления ХргВм не повлияли на дальнейшее непосредственное проведение РПрЭ и не сказались негативно на течении послеоперационного периода.
Самыми негативными осложнениями РПрЭ, распознанными интраоперационно, могут считаться повреждения прямой кишки - 3 наблюдения (0,3%). Травмы rectum происходили во время мобилизации задней поверхности ПрЖ вследствие распространенного онкологического процесса в зоне ее апекса (рис. 4).
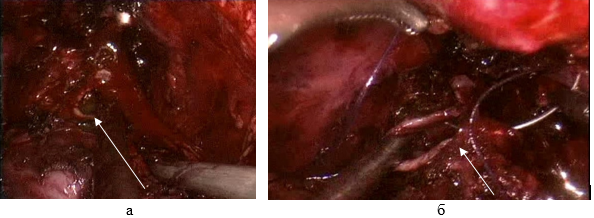
Рис. 4. Эндоскопическая картина повреждения прямой кишки во время РПрЭ: а) перфорация органа; б) ушивание дефекта кишки
Устранение перфорации прямой кишки осуществлялось ее двуслойный швом. В одном наблюдении профилактически сформирована «двуствольная» разгрузочная колостома. Целостность кишки восстановлена через 3 месяца. Больным, перенесшим повреждение прямой кишки во время РПрЭ, после операции осуществлялась антибиотикотерапия широкого спектра действия в течение 2 недель, лечебное голодание (4 дня) и средства, стимулирующие моторную функцию кишечника.
В 2 наблюдениях, при дополнении ТЛД РПрЭ, травмированными оказались запирательные нервы. Произошла данная операционная травма из-за термального воздействия на ткани во время электрокоагуляции при технической ограниченности визуального контроля за нервами. Он оказался полностью пересеченным. В обоих случаях края нервов сопоставлены и сшиты конец в конец. В послеоперационном периоде неврологическая симптоматика в зонах нарушения иннервации констатирована у 1 пациента, что сопровождалось проведением долгосрочной реабилитации.
Повреждение мочеточников во время РПрЭ с ТЛД с локацией травмы произошло в 3 случаях: в 1 наблюдении – оно оказалось тригональным (при диссекции шейки мочевого пузыря сзади), а в 2 случаях травма локализовалась в зонах пересечения мочеточников с подвздошными сосудами. В этих случаях повреждениям существенно способствовала обильность лимфо-жировой клетчатки у больных с ожирением 2 и 3 ст. В каждом случае травмы мочеточника ретроградно осуществлялось его внутреннее дренирование стентами. Дефекты мочеточников ушивались. Во всех случаях повреждения мочеточников во время РПрЭ и в процессе устранения данной компликации в послеоперационном периоде дополнительных осложнений не было. Удаление стентов осуществлялось через 2 недели после выполнения ХргВм и предварительного выполнения МСКТ с внутривенным контрастированием.
Осложнение течения раннего послеоперационного периода произошло в 33 случаях среди 976 пациентов, оперированных по поводу РПрЖ - 3,4% наблюдений (табл. 3).
Таблица 3
Наблюдения осложнений в послеоперационном периоде у больных РПрЖ
по причине РПрЭ
|
Компликации в раннем п/о периоде |
Количество случаев (%) |
|
Осложнений не было |
943 |
|
Верифицированные у больных |
33 |
|
Всего выявленных осложнений |
39* |
|
кровотечение в зоне операции |
14 |
|
пиелонефрит |
2 |
|
мочевой затек (ранение мочеточника) |
2 |
|
острая почечная недостаточность (ОПН) |
1 |
|
нагноение п/о раны |
2 |
|
п/о ОКН или атония кишечника |
2 |
|
уретрит |
3 |
|
обструкции мочеточников |
2 |
|
перитонит, сепсис |
3 |
|
НУЦА |
4 |
|
Острая задержка мочи (ОЗМ) |
2 |
|
ТЭЛА |
1 |
|
ОНМК |
1 |
|
Всего больных |
976 |
Примечание. * В 6 случаях верифицированы 2 и более осложнения, связанные друг с другом причинно-следственно.
Определяющее влияние на результаты хирургического лечения больных РПрЖ оказывает факт констатации осложнений в раннем послеоперационном периоде, так как данные компликации в особой мере влияют на продолжительность лечения больных РПрЖ в стационаре и на стойкость негативных последствий после операции.
В первые/вторые сутки после операции у 14 пациентов отмечены внутриполостные кровотечения. В 7 наблюдениях возникла необходимость проведения экстренных операций из-за продолжающегося кровотечения. С целью достижения устойчивого гемостаза во всех наблюдениях выполнялась эндовидеоскопическая ревизия предбрюшинного пространства или БрП и использовались лапароскопические технологии. Выявить источник кровотечения при ревизии зоны операции не удалось в 4 из 7 случаев (остановка кровотечения произошла спонтанно). У двух больных источником кровотечения в раннем периоде после РПрЭ оказались вены дорзально-венозного комплекса, и у одного пациента - сосудистые «ножки» предстательной железы. Целенаправленная оценка тяжести кровотечения сочеталась с энергичными действиями по его устойчивой остановке. Из 14 наблюдений кровотечения в послеоперационном периоде в 13 случаях (по достижении устойчивого гемостаза) пациенты выписаны из стационара в удовлетворительном состоянии. В одном наблюдении на фоне тяжелой кровопотери возникло еще одно осложнение операции - ТЭЛА, что обусловило длительное пребывание пациента в стационаре с оказанием МедП, в том числе в подразделении реанимации.
В особом ракурсе анализ данных осуществлен в отношении оценки в виде повреждения мочеточников и мочевых затеков (2 пациента). В случаях п/о осложнений данного вида лечение пациентов в стационаре осуществлялось длительно. Отграниченные скопления мочи в ЗБрПр, как правило, верифицировались через 5-7 суток после осуществления РПрЭ. Устранение компликаций операций обосновывалось дифференцированным подходом к лечению больных. В одном случае стентом внутреннего дренирования проведена коррекция оттока из чашечно-лоханочной системы почки с пораженной стороны, в другом – выполнена чрескожная пункционная нефростомия. Зона мочевого затека обычно дренировалась перкутанно пункцией под контролем УЗИ в доступных и безопасных для данной манипуляции зонах.
В 4 наблюдениях (больные, подвергшиеся РПрЭ из лапароскопического и робот-ассистированного доступа), на этапах освоения методик, верифицирована при цистографии несостоятельность пузырно-уретрального анастомоза (рис. 5).
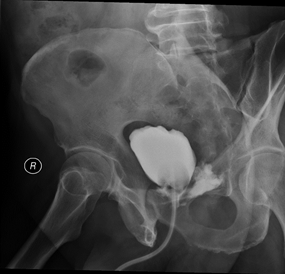
Рис. 5. Rg-картина восходящей цистографии после РПрЭ: признаки мочевого затека, обусловленного несостоятельностью уретроцистоанастомоза
В подобных ситуациях больным осуществлялась уретральная катетеризация до 2 месяцев до доказанности состоятельности УЦА. Больным, подвергшимся РПрЭ, с 2023 г. для профилактики НУЦА укрепление его задней стенки стали осуществлять отдельными узловыми швами на 5, 6, 7 часах условного циферблата (рис. 6).
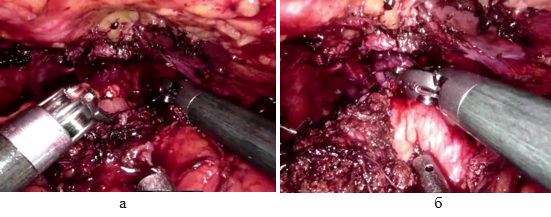
Рис. 6. Изображение узловых швов формирования уретроцистоанастомоза (на условных часах циферблата): а) на 5 и б) на 7 часах
Со времени формирования уретроцистоанастомоза по представленной технологии данной методики его укрепления, признаков несостоятельности и мочевых затеков не было, что подтверждено посредством цистографии.
Все осложнения после РПрЭ в отдаленные (в течение года) сроки наблюдения за больными чаще всего отмечены в течение от 1 до 3 месяцев (табл. 4).
Таблица 4
Данные о наблюдениях осложнений, сформировавшихся после РПрЭ в отдаленном послеоперационном периоде
|
Осложнения |
Количество наблюдений (%) |
|
Лимфоцеле с нагноением |
7 (0,72) |
|
П/о грыжа |
5 (0,52) |
|
Стриктура уретроцистоанастомоза |
2 (0,2) |
|
Формирование пузырно-прямокишечного свища |
1 (0,1) |
|
Всего больных с осложнениями |
15 (1,55) |
|
Осложнений не было |
952 (98,45) |
Значимые осложнения РПрЭ с ТЛД в отдаленные сроки после операции верифицировались у больных как наблюдения лимфоцеле с элементами воспалительной реакции.
У 7 больных (0,72%) синхронное формирование лимфоцеле после РПрЭ, сопровождаемое расширенной ТЛД, вероятно, объясняется масштабностью осуществленного ХргВм с программированной травмой лимфопротоков. Данные внутрибрюшные и забрюшинные изолированные жидкостные скопления – потенциально представляют объект инфицирования. Все сформировавшиеся очаги под ультразвуковым контролем успешно дренированы перкутанно. В 1 случае из-за безуспешности применения дренирующих методик и длительной лимфореи рациональным оказалось лапароскопически выполнить фенестрацию лимфоцеле в БрП.
В 2 (0,2%) случаях в первый год после РПрЭ, выполненной больным РПрЖ, выявлена контрактура шейки мочевого пузыря. Клинически у этих пациентов на фоне хронического нарушения мочеиспускания произошла его острая задержка. Это обусловливало необходимость в экстренной госпитализации пациентов и установке цистостомического дренажа. Обоим больным выполнена уретрография. В случаях обнаружения контрактуры шейки мочевого пузыря после выполнения уретроцистоскопии, выполнялась трансуретральная резекция шейки мочевого пузыря.
В отдаленные сроки наблюдения после РПрЭ в 0,5% случаев (n=5 чел.) выявлялись п/о грыжи (0,5%). Это осложнение в зоне ХргВм констатировано в зонах установки портов после эндовидеохирургической РПрЭ (n=1) и робот-ассистированной РПрЭ (n=4). Вероятно, причина формирования п/о грыж связана с некорректностью осуществления ушивания апоневроза передней брюшной стенки с использованием рассасывающегося шовного материала. В свою очередь это также может быть связано со сверхактивным движением манипуляторов роботической системы и прикрепленных к ним троакаров. Не исключается феномен конусного эффекта в тканях передней брюшной стенки, способствующего повреждению ее апоневротических структур. Пока пациенты воздерживаются от предлагаемых повторных хирургических вмешательств, направленных на устранение п/о грыж. Однако такие осложнения есть, и игнорировать их нельзя.
На первом месяце послеоперационного периода у 1 больного, перенесшего РПрЭ, выявлен мочепузырно-ректальный свищ. Это осложнение клинически проявлялось подтеканием мочи через прямую кишку, болевыми ощущениями в нижних отделах живота, пневматурией, повышением температуры тела. Основной причиной формирования свища оказались нераспознанные интраоперационно микроскопические повреждения стенки прямой кишки и локальное воспаление в локации уретроцистоанастомоза. После формирования разгрузочной сигмостомы и через 3 месяца после проведенной РПрЭ выполнена реконструктивная операция по разобщению стенок прямой кишки и зоны уретроцистоанастомоза с иссечением и ушиванием свищевого хода.
Заключение. У больных, перенесших РПрЭ, устранение осложнений этого хирургического вмешательства, как и при других операциях, представляет собой неотъемлемую часть деятельности как узких специалистов, так и организаторов здравоохранения. Все участники лечебно-диагностического процесса заинтересованно стремятся решить задачи по снижению вероятного формирования каких-либо компликаций ХргВм и минимизации их тяжести. Очевидно, что показатель частоты интра- и послеоперационных осложнений, происходящих у больных, подвергшихся РПрЭ, возрастает при дополнении данной операции тазовой лимфодиссекцией. Возможность многосторонней интраоперационной визуализации патологических процессов при использовании технологий лапароскопии и робот-ассистированной хирургии представляет значимое конкурентное преимущество. Оно состоит в том, что при данных хирургических технологиях лечения больных РПрЖ оказывается возможным не только своевременное распознавание осложнений РПрЭ, но и с минимальными усилиями устранять эти компликации, в большинстве случаев синхронно в процессе единого ХргВм. Целесообразность стереотипного исполнения требований клинических рекомендаций и других организационных регламентов не вызывает сомнений. Однако персонифицированный подход к выбору технологии проведении РПрЭ с учетом индивидуальных особенностей картины заболевания у пациентов оказывается одним из основных направлений принятия тактических решений по профилактике п/о осложнений.
Выводы
1. Накопление опыта специалиста в проведении мини-инвазивных технологий в онкоурологии оказывается существенным активом, способствующим снижению показателей частоты формирования осложнений, случающихся во время и после проведения радикальной простатэктомии.
2. Выполнение гибридных хирургических вмешательств в виде радикальной простатэктомии и тазовой лимфаденэктомии повышает риск частоты послеоперационных осложнений при синхронном осуществлении подобных видов ХргВм, однако не в критической степени.
3. Тщательное соблюдение мер предупреждения осложнений на всех этапах проведения радикальной простатэктомии позволяет своевременно их верифицировать и устранять, способствуя достижению необходимой безопасности медицинской деятельности и надлежащего качества медицинской помощи в онкоурологии.
Библиографическая ссылка
Попов С.В., Чернов К.Е., Орлов И.Н., Мовчан К.Н., Вязовцев П.В., Грушевский Р.О. ПУТИ МИНИМИЗАЦИИ ЧАСТОТЫ ОСЛОЖНЕНИЙ ХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ, ПРОВОДИМЫХ ПО ПОВОДУ РАКА ПРОСТАТЫ // Современные проблемы науки и образования. 2024. № 5. ;URL: https://science-education.ru/ru/article/view?id=33719 (дата обращения: 25.02.2026).
DOI: https://doi.org/10.17513/spno.33719



