Введение
В настоящее время различные полимеры используются во всех сферах жизни общества. В биомедицине и фармацевтике нашли свое применение полимеры на основе молочной кислоты. Из них изготавливают шовный материал, пленки для закрытия раневых дефектов, пролонгированные лекарственные формы. Ряд особенностей данных веществ, таких как: биосовместимость, отсутствие токсичности, биоразлагаемость, пористая структура, пластичность, биодеградируемость, возможность изменения и дополнения состава вспомогательными, в зависимости от цели, веществами (антибиотиками, минеральными наполнителями для повышения прочностных характеристик внедряемого образца) – позволяют использовать их в организме человека [1]. Включение карбоната кальция в количестве до 30% повышает ударную прочность полимера молочной кислоты. Смесь полилактида с поликапролактоном характеризуется высокой ударной прочностью и упругостью, при этом не исключаются такие ключевые особенности полимера молочной кислоты, как биоразлагаемость и экологичность.
На сегодняшний день инвазивное лечение травм и дегенеративных изменений костно-суставной системы требует применения разнообразных экстрамедуллярных и интрамедуллярных конструкций. К сожалению, не все они удовлетворяют требованиям конкретного случая в практике специалиста. Дорогостоящее производство, дефицит материала и его негативное влияние на организм не позволяют использовать металлоконструкции повсеместно и без отрицательных последствий. Любой металлический имплант, внедряемый в организм сегодня, требует его последующего извлечения, что не всегда реализуемо для пациента и часто представляет определенные сложности для врача. Кроме прочего, кумуляция металла в тканях организма приводит к их токсическому повреждению. Все это обусловило необходимость поиска нового подхода в терапии заболеваний, требующих замещения дефекта системы опорно-двигательного аппарата.
Внедрение полимеров в медицинскую практику позволило снизить влияние большинства вышеизложенных отрицательных аспектов оперативных вмешательств, в том числе дополнительных инвазивных процедур по извлечению конструкций. Возможность полной резорбции является положительной опцией применения полимеров. Длительная биодеградация позволяет в полной мере использовать биосинтетические способности организма реципиента с целью получения замещенного дефекта, максимально приближенного по свойствам к процессам репарации в интактном организме [2].
Биологическая инертность полилактида обусловлена тем, что в каскаде реакций распада данного вещества конечными продуктами выступают нетоксичные агенты: углекислый газ и вода [3].
Пластичность полимеров из полилактида, а также возможность их производства с применением 3D-печати позволяют создавать сложные пространственные конфигурации или изделия, точно соответствующие по размерам и конфигурации замещаемому дефекту.
Характеристики структуры образцов полимеров способны отвечать требованиям каждого отдельного случая. Для замещения костного дефекта прочность имплантируемого фрагмента не должна уступать прочности замещаемой костной структуры, а его емкостные свойства определяют возможность для остеокондукции [4]. Последняя означает возможность прорастания фиброзной, мезенхимальной и костной тканями через поры импланта и их роста на его поверхности. Основная цель остеозаместительной терапии с применением полимера молочной кислоты – создание каркаса, способного полностью заместить дефект и стать основой для роста костной ткани из неповрежденных ее участков [5]. Это возможно благодаря остеоинтегративным свойствам пористого импланта из полимолочной кислоты.
Цель исследования
Изучение морфологических и физических характеристик пористых имплантов, изготовленных из полилактида, в эксперименте, и оценка возможности их применения в остеозаместительной терапии патологии опорно-двигательного аппарата.
Материалы и методы исследования
В ходе исследования использовались импланты, изготовленные из полилактида при помощи 3D-печати. Размеры образцов 35 мм x 7 мм x 2 мм, размеры волокон, образующих пористую структуру импланта, находятся в диапазоне 24,2–29,4 µm. Проведена оценка прочности путем давления на образец полилактида и участок нативной костной ткани кролика до достижения полного поперечного повреждения. Скорость сдавления 35 мм/мин, сила, требуемая для поперечного повреждения образцов, измерялась в ньютонах. Для определения прочностных характеристик образцов использован стенд универсальный электромеханический РЭМ 0,2-1. Изучение структуры и фотофиксация пор и трабекул образца, а также их измерение проводились при помощи визуализации микроскопом Ломомед-6 при увеличении х4 и х10 с цифровой камерой Альтами E3CMOS12000KPA. Для определения пористости имплантов проводилась оценка поглощения жидкости и ее количества, полученного после центрифугирования образцов аппаратом Biosan LMC-3000 на скорости 1500 об/мин в течение 5 минут.
Результаты исследования и их обсуждение
В ходе эксперимента изучалась структура пористого импланта на микроскопическом уровне с оценкой площади и размера пор. Произведены фотофиксация, расчет размеров и площади пор импланта. Полученные результаты представлены на рисунках 1, 2, 3.

Рис. 1. Образец импланта, световая микроскопия, увеличение х4

Рис. 2. Образец импланта, световая микроскопия, увеличение х10, боковая поверхность

Рис. 3. Образец импланта, световая микроскопия, увеличение х10
На рисунке 3 обозначены размеры основных структур, составляющих пористую основу образца. По данным приведенных измерений средняя площадь 1 поры 1428 µm². Это в 47,6 раза превышает площадь поперечного сечения капилляра человека (30 µm²), что свидетельствует о возможности интеграции мезенхимальной ткани в поры импланта, а следовательно, ангиогенеза путем дифференцировки плюрипотентных клеток.
Полученные результаты свидетельствуют о способности пористого образца полилактида находиться в организме беспрепятственно для прорастания не только сосудов, но и остеонов через толщу импланта. Средняя пористость трабекулярной кости человека составляет 563±2 µm, что в 2,54 раза меньше среднего размера пор изучаемого образца. Кроме того, на рисунке 2 изображена слоистая структура импланта, и поры интегрированы через толщу всех слоев. Приведенные данные свидетельствуют о беспрепятственной остеоинтеграции образца в дефект костной ткани. Именно наличие пор, а также пластичность материала позволяют физиологическим структурам, таким как мезенхимальная ткань, коллаген и остеобласты, прорастать через отверстия импланта и на его основе выстраивать необходимые хрящевые, а затем молодые костные структуры (остеоиды) и зрелые костные трабекулы в зоне дефекта [6].
Определена способность импланта поглощать жидкость, что позволяет судить о его растворимости и перспективах роста собственных тканей организма через пористую структуру образца.
Исследовано 10 образцов пористого полилактида, взвешенных, помещенных в воду на 10 минут, взвешенных после погружения с целью определения количества поглощенной жидкости, центрифугированных и взвешенных повторно для оценки массы образца, который мог раствориться, и массы жидкости, выделенной из пор. В эксперименте была использована центрифуга Biosan LMC-3000. Отбор материалов проводили исходя из образца полилактида, воссозданного при помощи 3D-печати на основе кортикальных образцов костной ткани одинаковых размеров, выделенных из диафиза бедренной кости кролика. Для статистического анализа использовали пакет MS Excel, рассчитывали параметрические характеристики (среднее квадратичное отклонение, критерий Стьюдента (t)) для независимых выборок с учетом статистически значимых различий при p<0,01. Расчет критерия Стьюдента производили по формуле: 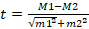 , где t – критерий Стьюдента, M1 и M2 – значения сравниваемых средних арифметических, m1 и m2 – величины статистических ошибок средних арифметических. Рассчитана масса имплантов на всех этапах эксперимента, определены среднее значение и статистически значимые отличия. Данные о массе и результаты расчетов отражены в таблицах 1 и 2.
, где t – критерий Стьюдента, M1 и M2 – значения сравниваемых средних арифметических, m1 и m2 – величины статистических ошибок средних арифметических. Рассчитана масса имплантов на всех этапах эксперимента, определены среднее значение и статистически значимые отличия. Данные о массе и результаты расчетов отражены в таблицах 1 и 2.
Таблица 1
Оценка поглощающей способности образцов пористого полилактида
|
m0 |
m1 |
m2 |
m3 |
Плотность воды |
|
|
1 |
0,0834 |
0,1599 |
0,0848 |
0,0751 |
0,99923 |
|
2 |
0,0837 |
0,1427 |
0,0849 |
0,0578 |
0,99923 |
|
3 |
0,0847 |
0,1704 |
0,086 |
0,0844 |
0,99923 |
|
4 |
0,0856 |
0,1682 |
0,0871 |
0,0811 |
0,99923 |
|
5 |
0,0843 |
0,1614 |
0,0857 |
0,0757 |
0,99923 |
|
6 |
0,0827 |
0,1641 |
0,0837 |
0,0804 |
0,99923 |
|
7 |
0,0859 |
0,176 |
0,0875 |
0,0885 |
0,99923 |
|
8 |
0,0834 |
0,1661 |
0,0843 |
0,0818 |
0,99923 |
|
9 |
0,086 |
0,145 |
0,0875 |
0,0575 |
0,99923 |
|
10 |
0,0838 |
0,1643 |
0,086 |
0,0783 |
0,99923 |
|
m̅+St.dv |
0,08435 |
0,16181 |
0,08575 |
0,07606 |
0,99923 |
Примечание: m0 – масса образца до погружения, m1 – масса образца после погружения, m2 – масса образца после центрифугирования, m3 – масса жидкости, выделенной из пор после центрифугирования, m̅ – среднее значение.
Таблица 2
Оценка статистически значимых различий (P) для массы образцов
|
|
m0 |
m1 |
m2 |
m3 |
|
m0 |
– |
<0,0001 |
0,6112 |
0,0102 |
|
m1 |
<0,0001 |
– |
<0,0001 |
<0,0001 |
|
m2 |
0,6112 |
<0,0001 |
– |
0,0042 |
|
m3 |
0,0102 |
<0,0001 |
0,042 |
– |
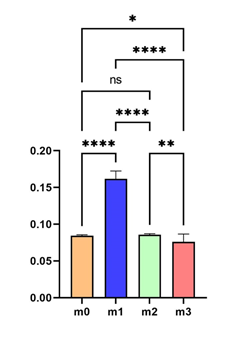
Рис. 4. Диаграмма распределения статистически значимых различий по массе образцов
Примечание: ns – не значимы статистически.
Из приведенных данных следует, что масса импланта после погружения в жидкость увеличилась вдвое от исходной. Пористая структура образца позволяет поглощать массу жидкости, равную массе самого образца, что дает возможность в полной мере прорастать мягким тканям и физиологическим структурам через поры внедряемого импланта по меньшей мере на половину самого костного дефекта [7]. Учитывая биодеградируемость полилактида, дальнейшая регенерация костной ткани может протекать в полном объеме. После разрушения импланта созревание остеоидов в зрелую ткань продолжится на основании созданного ранее каркаса коллагеновой и хрящевой ткани в порах импланта, а также по ходу сосудов, интегрировавших в полости образца [8]. После центрифугирования масса импланта вернулась к исходной, следовательно, на период погружения образца в жидкость не произошло его растворения. Эти данные позволяют вводить образцы в организм на срок, достаточный для остеогенеза в зоне повреждения, без утраты их структурной целостности. Сроки распада полилактида в организме составляют в среднем не менее 6 недель. По результатам исследования Alice Cheng, спустя 10 недель от имплантации процесс физиологического замещения дефекта не завершен [9]. Это означает, что длительное присутствие импланта в зоне дефекта позволяет запустить процесс неоангиогенеза, остеогенеза и создать остеоиды для дальнейшего созревания зрелой костной ткани независимо от дальнейшего присутствия полимера в зоне повреждения.
Таким образом, основное преимущество пористой структуры образца полилактида заключается в том, что наличие полостей в импланте дает возможность для прорастания большого объема тканей через структуру [10]. Так как исходная масса и масса после погружения отличаются в 2 раза, объем структур организма, вмещаемых имплантом, позволяет заместить дефект на 50% физиологическими тканями. Оставшиеся 50% служат биоразлагаемым каркасом в дефекте, требующем замещения на уровне уже физиологических процессов.
Прочностные характеристики оценивались по силе давления на образец полимера молочной кислоты и образец нативной костной ткани кролика, которая требовалась для возникновения полного поперечного повреждения импланта. Данные по результатам тестов приведены ниже (табл. 3, рис. 4).
Таблица 3
Сравнительные данные прочностных характеристик импланта из полимера молочной кислоты и образца нативной части костной ткани кролика
|
№ образца |
Образец полилактида |
Образец костной ткани |
|
1 |
29,2 Н |
81,93 Н |
|
2 |
38,17 Н |
79,62 Н |
|
3 |
33,4 Н |
83,9 Н |
|
4 |
36,81 Н |
77,37 Н |
|
5 |
32,21 Н |
79,72 Н |
|
6 |
38,4 Н |
72,86 Н |
|
7 |
27,98 Н |
76,46 Н |
|
8 |
34,46 Н |
80,24 Н |
|
9 |
31,28 Н |
74,37 Н |
|
10 |
35,53 Н |
78,12 Н |
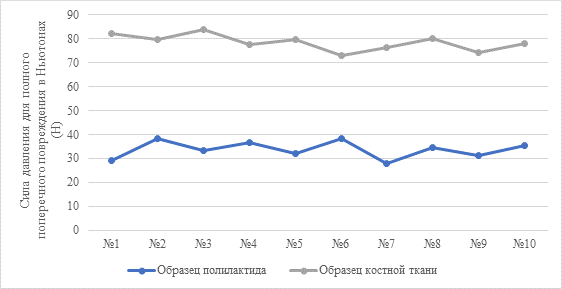
Рис. 5. Сравнение приложенной силы давления для полного поперечного повреждения образцов из костной ткани и полилактида
Примечание: Вертикальная ось – сила, приложенная к образцам до достижения полного поперечного повреждения, измеренная в ньютонах (Н). Горизонтальная ось – номера образцов в эксперименте по порядку.
По результатам приведенных измерений определен критерий Стьюдента, позволяющий оценить статистическую значимость различий прочностных характеристик используемых материалов. Отбор материалов проводили исходя из образца полилактида, воссозданного при помощи 3D-печати на основе кортикальных образцов костной ткани одинаковых размеров, выделенных из диафиза бедренной кости кролика. Для статистического анализа использовали пакет MS Excel, рассчитывали параметрические характеристики (среднее квадратичное отклонение, критерий Стьюдента (t)) для независимых выборок с учетом статистически значимых различий при p<0,01. Расчет критерия Стьюдента производили по формуле: 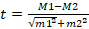 , где t – критерий Стьюдента, M1 и M2 – значения сравниваемых средних арифметических, m1 и m2 – величины статистических ошибок средних арифметических. Значение критерия Стьюдента для использованных образцов – 27,24, p=0,000000, – различия являются статистически значимыми. Из этого следует, что прочностные характеристики имплантов из полилактида уступают нативной костной ткани, что является клинически значимым результатом. Важность полученных данных свидетельствует о том, что при желании сохранить прочность, равную костной, требуются использование компаундов полилактида с укрепляющими полимерами или минеральными добавками и адаптация состава к каждому случаю в отдельности.
, где t – критерий Стьюдента, M1 и M2 – значения сравниваемых средних арифметических, m1 и m2 – величины статистических ошибок средних арифметических. Значение критерия Стьюдента для использованных образцов – 27,24, p=0,000000, – различия являются статистически значимыми. Из этого следует, что прочностные характеристики имплантов из полилактида уступают нативной костной ткани, что является клинически значимым результатом. Важность полученных данных свидетельствует о том, что при желании сохранить прочность, равную костной, требуются использование компаундов полилактида с укрепляющими полимерами или минеральными добавками и адаптация состава к каждому случаю в отдельности.
Кроме того, причиной, по которой используемые образцы полилактида с правильной ориентацией волокон уступают по прочности костным компонентам, заключается в невозможности воспроизвести трабекулярную структуру в образце полилактида. Именно переплетение трабекул костной ткани в виде хаотично связанных между собой перекладин объясняет ту прочность, которая позволяет костной ткани претерпевать высокие нагрузки. Структура импланта, приведенная на рисунках 1 и 2, свидетельствует о более согласованном расположении перегородок друг относительно друга. Кроме того, как показано на рисунке 3, в боковой проекции имплант имеет слоистую структуру. Иными словами, перекладины лежат в одной плоскости, как и образованные ими поры. Отсутствие хаотичных связей перегородок во множестве плоскостей, как это имеет место в костной ткани, снижает прочностные характеристики образца в сравнении с нативным.
В ходе исследования получены морфологические, физические и статистические данные о свойствах пористого импланта из полилактида. Изученные материалы позволяют судить о том, что применение полимерных имплантов в терапии заболеваний опорно-двигательного аппарата является перспективным направлением на современном этапе развития травматологии и ортопедии.
Заключение
Полимерные импланты стремительно внедряются в медицинскую сферу. Активно изучаются возможности и перспективы внедрения новых составов в контексте остеозаместительной терапии. Новым шагом для травматологии и ортопедии стало появление имплантов из полилактида. Благодаря пористой структуре образцов процессы остеоиндукции и остеокондукции беспрепятственно протекают в зоне дефекта, а прочность, незначительно уступающая прочности нативной костной ткани, пластичность, бионейтральность для организма и возможность создания с помощью технологий 3D-печати образца под индивидуальный клинический случай делают пористые импланты из полилактида оптимальными для остеозаместительной терапии заболеваний опорно-двигательного аппарата.
Библиографическая ссылка
Власов А.В., Лебедев А.Ю., Тихоненков С.Н., Дубровин Г.М., Денисов А.А. МОРФОЛОГО-ФИЗИЧЕСКИЕ ХАРАКТЕРИСТИКИ ПОРИСТЫХ ИМПЛАНТОВ, ИЗГОТОВЛЕННЫХ ИЗ ПОЛИЛАКТИДА В ЭКСПЕРИМЕНТЕ. ПЕРСПЕКТИВЫ ИХ ПРИМЕНЕНИЯ В ОСТЕОЗАМЕСТИТЕЛЬНОЙ ТЕРАПИИ ПАТОЛОГИИ ОПОРНО-ДВИГАТЕЛЬНОГО АППАРАТА // Современные проблемы науки и образования. 2024. № 5. ;URL: https://science-education.ru/ru/article/view?id=33711 (дата обращения: 25.02.2026).
DOI: https://doi.org/10.17513/spno.33711



