Введение
Деструктивный процесс в легочной ткани при туберкулезе (ТБ) остается весьма актуальной проблемой на сегодняшний день. Несвоевременно выявленное заболевание при наличии деструкции чаще всего имеет печальные последствия в плане эпидемической опасности для окружающих больного людей. Распад в легком в последние годы был рассмотрен с различных позиций: воздействие возбудителя и массивность бактериальной нагрузки, генетические особенности пациента, влияние ряда сопутствующих болезней как следствие социальной дезадаптации пациента и его нежелание проходить дообследование и этиотропное лечение.
В связи с этим актуальным представляется поиск генетических факторов, ассоциированных с ранней предрасположенностью к распадам или деструктивным клиническим формам при ТБ. При изучении свойств макроорганизма – носителя Mycobacterium tuberculosis (МБТ) представляет интерес рассмотрение особенностей структуры и обмена интерстициальной ткани, посредством которой осуществляется гомеостаз в легком, а также медиаторов воспаления, отвечающих за специфический иммунный ответ при активном ТБ. Результаты исследований позволят разработать персонифицированные подходы к ранней диагностике и прогнозу течения туберкулеза.
Интерлейкин-1α является провоспалительным цитокином из семейства ИЛ-1. Достаточно изучена его роль при множестве аутоиммунных и инфекционных болезней, в том числе и ТБ [1, 2]. Полиморфизм rs1800587 расположен в регуляторной области, представлен аллельными вариантами G\G, G\A и A\A, последний из которых обусловливает сниженную экспрессию уровня ИЛ-1. Данная мутация и ее роль исследовались при ревматоидном артрите, болезни Альцгеймера, рассеянном склерозе, системной красной волчанке, болезни Грейвса, грыжах межпозвонковых дисков, сахарном диабете и других патологиях, но не при туберкулезе легких [3, 4]. Есть основания полагать, что уровень экспрессии ИЛ-1 может быть ассоциирован с деструктивным процессом в легочной ткани при ТБ.
Фактор некроза опухоли α (TNF-α) вносит наибольший вклад в формирование и поддержание стабильности туберкулезной гранулемы, тем самым локализует специфическое воспаление. Однонуклеотидная замена rs1800629 расположена в промоторной области гена TNFA и отвечает за уровень продукции данного цитокина [5]. Полиморфизм изучали при B-клеточном лимфобластном лейкозе, сахарном диабете, кардиомиопатиях, ряде аутоиммунных и неврологических заболеваний [6, 7, 8]. При туберкулезе полиморфизм rs1800629 не исследовался.
Однонуклеотидная замена (rs1800795) также расположена в промоторной области гена IL6, что обусловливает ее влияние на экспрессию гена. ИЛ-6 является провоспалительным и среди прочего стимулирует дифференцировку Т-лимфоцитов при туберкулезном воспалении, тем самым участвует в формировании клеточного иммунного ответа [9]. Данный полиморфизм был изучен при сахарном диабете, глаукоме, гинекологической патологии, ишемической болезни сердца, почечной недостаточности, васкулитах, COVID-19 и других нозологиях [10, 11, 12]. Представляет интерес оценить связь полиморфизма IL6 (rs1800795) с распадом легкого при впервые выявленном ТБ легких.
Полиморфизм генов, отвечающих за синтез цитокинов, может оказать влияние на процесс созревания гранулоцитов в костном мозге, а значит, и на особенности формирования нейтрофильных внеклеточных ловушек (НВЛ). При осложненных формах туберкулеза изменения в способности нейтрофилов к формированию внеклеточных ловушек способны оказать потенциально отрицательные эффекты на течение заболевания, предрасполагая к развитию ряда осложнений, в том числе и деструкции легочной ткани.
Цель исследования: определить полиморфизм генов IL-1α (rs1800587), TNF-α (rs1800629), IL6 (rs1800795) и способность нейтрофилов к формированию внеклеточных ловушек у пациентов с осложненными и неосложненными деструкцией легочной ткани формами туберкулеза.
Материал и методы исследования
В работе проанализированы клинико-анамнестические и лабораторно-инструментальные данные 184 пациентов с впервые выявленным ТБ легких, жителей Омска и Омской области, находившихся на стационарном лечении в БУЗОО «КПТД».
Диагноз ТБ устанавливался врачебной комиссией областного противотуберкулезного диспансера на основании клинической картины заболевания, лучевых методов исследования, иммунологических проб с туберкулином и аллергеном туберкулезным рекомбинантным в стандартных разведениях данных микроскопического и бактериологического исследования мокроты в соответствии с клинической классификацией ТБ.
Набор пациентов осуществлялся при поступлении в стационар согласно критериям включения. Критерии включения: впервые выявленный ТБ легких, возраст 18 лет и старше, госпитализация и лечение в круглосуточном стационаре БУЗОО «КПТД». Критериями исключения являлись: наличие иммунодефицита (в том числе ВИЧ-инфекции), внелегочного ТБ, микобактериоз, отказ от участия в исследовании. Все пациенты получали курс химиотерапии (ХТ) в соответствии с установленной чувствительностью МБТ по данным ускоренных методов определения лекарственной чувствительности (ПЦР), посева на жидкие и плотные питательные среды, а также на основании анамнестических данных.
На основании данных лучевых методов исследования все пациенты были разделены на 2 группы. В первую группу вошел 121 пациент (99 мужчин и 22 женщины, средний возраст составил 44,4±12,9 года) с наличием деструкции легочной ткани по данным рентгенографии и МСКТ органов грудной полости на момент поступления в стационар. Структура клинических форм в данной группе распределилась следующим образом: инфильтративный ТБ составил 87,6%, на диссеминированный пришлось 9,1%, казеозная пневмония составила 3,3%. Во вторую группу вошли 63 пациента без распада легочной ткани по данным рентгенографии и МСКТ органов грудной полости на момент поступления в стационар, в группе было 40 мужчин и 23 женщины, средний возраст составил 46,1±12,8 года. В структуре клинических форм в этой группе, как и в первой, доминировал ИТЛ (88,9%), очаговый ТБ составил 6,3%, диссеминированный – 4,8%.
Для выделения ДНК использовали метод фенол-хлороформной экстракции, материалом служила лейкоцитарная масса. Дезоксинуклеотидтрифосфаты (dNTP) и олигонуклеотидные праймеры были синтезированы в ИХБФМ СО РАН, где также проводились все этапы генотипирования.
Генотипирование однонуклеотидных замен в генах IL1a (rs1800587) TNFa (rs1800629) проводили методом полимеразной цепной реакции в режиме реального времени с использованием конкурирующих TaqMan-зондов, комплементарных полиморфным участкам ДНК. Типирование полиморфного локуса rs1800796 гена IL-6 проводили методом Fluorescent melt curve analysis (FMCA) с использованием флюоресцентно-меченого олигонуклеотидного зонда с последующим плавлением амплификационных продуктов и анализа кривых плавления.
Амплификацию проводили с помощью амплификатора iCycler iQ5 (Bio-Rad, США). ПЦР проводили в следующих условиях: начальная денатурация 3’ при 96°С; затем 40 циклов, включающих денатурацию при 96°С- 8”, отжиг праймеров и последующую элонгацию при 60°С- 35” (каждый шаг сопровождался регистрацией флюоресцентного сигнала в диапазонах, соответствующих интервалам флюоресценции флюорофоров FAM и R6G).
Способность нейтрофилов к формированию внеклеточных ловушек изучали по методике, предложенной членами авторского коллектива [13]. Нейтрофилы, выделенные из гепаринизированной крови на фиколл-верографине, стимулировали пробиотиком – смесь Lactobacillus reutri, L. acidophilius, L. rhamnosis и Bifidumbacterium longum (далее – стимулятор). Через 30 мин стимуляции при температуре 37оС окрашивали клетки пропидия йодидом и моноклональными антителами CD45/FITC (DAKO, США). Используя люминесцентную микроскопию в приготовленном ex tempore препарате «раздавленная капля», подсчитывали процентное отношение:
1) интактных нейтрофилов;
2) активированных нейтрофилов;
3) клеток раннего нетоза;
4) облаковидных НВЛ;
5) нитевидных НВЛ (рисунок).
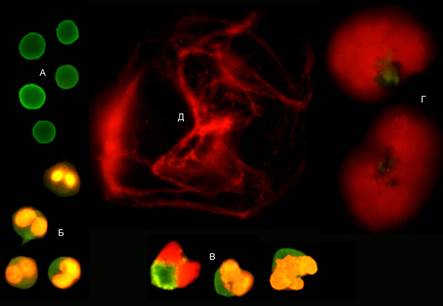
Объекты, определяемые в препарате нейтрофилов, после 30 мин воздействия стимулятора: А) интактные нейтрофилы; Б) активированные нейтрофилы; В) клетки раннего нетоза; Г) облаковидные НВЛ; Д) нитевидные НВЛ.
Люминесцентная микроскопия, х1000
Статистическую обработку производили стандартным пакетом программ для персональных компьютеров Statistica 10. Использовали методы описательной и сравнительной статистики (с помощью непараметрических методов статистики: χ2 Пирсона и точного теста Фишера).
Результаты исследования и их обсуждение
В таблице 1 представлено распределение пациентов в группах с различной эффективностью химиотерапии в зависимости от вида лекарственной устойчивости (ЛУ) МБТ. Среди всех видов резистентности в 1-й группе наиболее часто встречались пациенты с пред-ШЛУ МБТ (36,4%, во 2-й группе 10,7%, р=0,029), а во 2-й группе преобладали пациенты без ЛУ МБТ (47,6%, в 1-й группе 27,3%, р=0,006).
Таблица 1
Распределение пациентов в группах с различной эффективностью химиотерапии в зависимости от вида ЛУ МБТ, абс. (%)
|
Вид лекарственной устойчивости |
1-я группа, n=121 (100%) |
2-я группа, n=63 (100%) |
χ2 |
р |
|
Без ЛУ |
33 (27,3) |
30 (47,6) |
7,62 |
0,006 |
|
Монорезистентность |
2 (1,7) |
2 (3,8) |
0,61* |
0,89 |
|
Полирезистентность |
10 (8,3) |
3 (4,8) |
0,55* |
0,565 |
|
МЛУ |
32 (26,4) |
15 (23,8) |
0,15 |
0,698 |
|
Пред-ШЛУ |
44 (36,4) |
13 (10,7) |
4,79 |
0,029 |
|
Примечание: χ2 – стандартный критерий Пирсона; * – точный тест Фишера; р – уровень статистической значимости. |
||||
В таблице 2 представлена распространенность ТБ процесса. У пациентов 1-й группы в большинстве случаев наблюдается поражение более одной доли (71,9%), в то время как во 2-й группе у 57,1% пациентов поражение не выходит за пределы одной доли легкого (р<0,001).
Таблица 2
Распространенность ТБ процесса, наличие полости распада на момент поступления в группах с различной эффективностью химиотерапии, абс. (%)
|
Распространенность процесса |
1-я группа, n=121 (100%) |
2-я группа, n=63 (100%) |
χ2 |
р |
|
Одна доля |
34 (28,1) |
36 (57,1) |
14,83 |
<0,001 |
|
Более одной доли |
87 (71,9) |
27 (42,9) |
||
|
Примечание: χ2 – стандартный критерий Пирсона |
||||
Бактериовыделение методом люминесцентной микроскопии чаще выявлялось у пациентов 1-й группы (72,7% и 17,5% в группах соответственно, р<0,001, таблица 3). По понятным причинам массивное бактериовыделение, определенное этим же методом, доминировало среди пациентов с распадом в легочной ткани: 38% против 3,2% у лиц без установленной деструкции, р<0,001.
Таблица 3
Распределение пациентов в сравниваемых группах в зависимости от бактериовыделения методом люминесцентной микроскопии на момент поступления в стационар, абс. (%)
|
Бактериовыделение на момент поступления |
1-я группа, n=121 (100%) |
2-я группа, n=63 (100%) |
χ2 |
р |
|
Есть |
88 (72,7) |
11 (17,5) |
50,91 |
<0,001 |
|
Нет |
33 (27, 3) |
52 (82,5) |
||
|
Массивность бактериовыделения |
||||
|
10–99 КУМ в 100 п/з (+) |
21 (17,4) |
5 (7,9) |
0,12* |
0,13 |
|
1–10 КУМ в 1 п/з (++) |
21 (17,4) |
4 (6,3) |
0,04* |
0,066 |
|
более 10 КУМ в 1 п/з (+++) |
46 (38,0) |
2 (3,2) |
0,0001* |
<0,001 |
|
Примечание: χ2 – стандартный критерий Пирсона; * – точный тест Фишера. |
||||
Скорость деления МБТ можно интерпретировать двояко: с одной стороны, быстро делящиеся микобактерии будут провоцировать более выраженную специфическую иммунную реакцию со всеми вытекающими последствиями, с другой стороны, давно установленным фактом является более быстрое подавление быстро делящихся популяций химиопрепаратами. Анализ скорости и интенсивности роста МБТ на плотных питательных средах (ППС) представлен в таблице 4. МБТ, выделенные у пациентов в сравниваемых группах, на ППС чаще растут в интервале от 31 до 60 дней (45,5% в 1-й и 34,2% во 2-й группах, р=0,17). Штаммы, растущие менее 30 дней, чаще высеивались у больных с распадом (37,2% против 22,2% пациентов 2-й группы, р=0,039). Также из таблицы 4 видно, что рост свыше 100 КОЕ выявлен у 36,4% больных 1-й группы и 7,9% больных 2-й группы (р<0,001). Отдельно авторы просчитали больных, в биологическом материале которых МБТ росли быстрее 30 дней, а количество КОЕ составило более 100. Таких больных в 1-й группе оказалось 28,9%, а во 2-й группе – 7,9% (р=0,003).
Таблица 4
Распределение пациентов в группах в зависимости от скорости и интенсивности роста МБТ на ППС (плотных питательных средах), абс. (%)
|
Скорость роста на ППС |
1-я группа, n=121 (100%) |
2-я группа, n=63 (100%) |
χ2 |
р |
|
До 30 дней |
45 (37,2) |
14 (22,2) |
4,26 |
0,039 |
|
От 31 до 60 дней |
55 (45,5) |
22 (34,2) |
1,89 |
0,17 |
|
Более 60 дней |
15 (12,4) |
10 (15,9) |
0,18* |
0,67 |
|
Интенсивность роста на ППС |
||||
|
1–20 КОЕ (+) |
18 (14,9) |
23 (36,5) |
11,19 |
<0,001 |
|
21–100 КОЕ (++) |
17 (14,1) |
13 (20,6) |
1,32 |
0,25 |
|
более 100 КОЕ (+++) |
44 (36,4) |
5 (7,9) |
0,000017** |
<0,001 |
|
Скорость роста менее 30 дней, массивность роста более 100 КОЕ (+++) |
35 (28,9) |
5 (7,9) |
0,0011** |
0,003 |
|
Посевы роста не дали |
6 (5,1) |
17 (27,0) |
16,41* |
<0,001 |
|
Примечание: χ2 – стандартный критерий Пирсона; * – χ2 Пирсона с поправкой Йейтса; ** – точный тест Фишера |
||||
При исследовании полиморфного аллеля rs1800587 гена IL1A было обнаружено следующее: в 1-й группе чаще выявлялись гомозиготы по гуанину (59,5% против 49,2% во 2-й группе, р=0,182) и аденину (11,6% против 4,8% во 2-й группе, р=0,214); гетерозиготы чаще встречались в группе без полостей в легком (46% против 28,9% в группе с деструкцией, р=0,021). Различия по аллелям не были статистически значимыми.
Таблица 5
Полиморфизм rs1800587 гена IL1A. Распределение генотипов и аллелей в группах с различной эффективностью химиотерапии, абс. (%)
|
Генотип\ аллель |
1-я группа, n=121 (100%) |
2-я группа, n=63 (100%) |
χ2 |
p |
|
Генотип G\G |
72 (59,5) |
31 (49,2) |
1,78 |
0,182 |
|
Генотип G\A |
35 (28,9) |
29 (46) |
5,34 |
0,021 |
|
Генотип A\A |
14 (11,6) |
3 (4,8) |
0,18* |
0,214 |
|
Аллель G |
179 (74) |
91 (72,2) |
0,13 |
0,720 |
|
Аллель A |
63 (26) |
35 (27,8) |
||
|
Примечание: χ2 – стандартный критерий Пирсона; * – точный тест Фишера |
||||
В отличие от полиморфизма rs1800587 IL1A, анализ полиморфизма rs1800629 в гене фактора некроза опухоли α показал статистически значимые различия в распространенности носительства аллелей (табл. 6). Носителей аллеля G было 82,6% пациентов в 1-й группе и 92,1% во 2-й, в то время как аллель А был выявлен у 17,4% лиц 1-й группы и 7,9% лиц 2-й группы, р=0,022. Несмотря на это, значимых различий при сравнении распространенности генотипов с этим аллелем в сравниваемых группах не получено.
Таблица 6
Полиморфизм rs1800629 гена TNFA. Распределение генотипов и аллелей в группах с различной эффективностью химиотерапии, абс.(%)
|
Генотип/ аллель |
1-я группа, n=121 (100%) |
2-я группа, n=63 (100%) |
χ2 |
p |
|
Генотип G\G |
88 (72,8) |
53 (84,1) |
3,01 |
0,083 |
|
Генотип G\A |
24 (19,8) |
10 (15,9) |
0,21** |
0,648 |
|
Генотип A\A |
9 (7,4) |
0 (0) |
0,00* |
0,063 |
|
Аллель G |
200 (82,6) |
116 (92,1) |
5,31** |
0,022 |
|
Аллель A |
42 (17,4) |
10 (7,9) |
||
|
Примечание: χ2 – стандартный критерий Пирсона; * – точный тест Фишера;** – χ2 Пирсона с поправкой Йейтса |
||||
Анализ полиморфизма rs1800795 гена IL6 не показал статистически значимых различий среди больных в сравниваемых группах, таблица 7.
Таблица 7
Полиморфизм rs1800795 гена IL6. Распределение генотипов и аллелей в группах с различной эффективностью химиотерапии, абс.(%)
|
Генотип\ аллель |
1-я группа, n=121 (100%) |
2-я группа, n=63 (100%) |
χ2 |
p |
|
Генотип G\G |
42 (34,7) |
16 (25,4) |
1,66 |
0,197 |
|
Генотип G\C |
55 (45,5) |
32 (50,8) |
0,47 |
0,492 |
|
Генотип C\C |
24 (19,8) |
15 (23,8) |
0,392 |
0,532 |
|
Аллель G |
139 (57,4) |
64 (50,8) |
1,48 |
0,224 |
|
Аллель C |
103 (42,6) |
62 (49,2) |
||
|
Примечание: χ2 – стандартный критерий Пирсона |
||||
Способность нейтрофилов к формированию внеклеточных ловушек у пациентов с наличием деструкции легочной ткани и без распада легочной ткани различалась (табл. 8). Нейтрофилы пациентов группы 1 статистически значимо чаще формировали облаковидные НВЛ, кроме того, в препарате пациентов 1-й группы после действия стимулятора доля клеток раннего нетоза была статистически значимо больше, а доля активированных нейтрофилов – статистически значимо меньше. Наблюдалась тенденция к снижению процента нитевидных НВЛ во 2-й группе по отношению к 1-й – медиана доли нитевидных НВЛ во 2-й группе была на 44,9 % меньше, чем в 1-й группе.
Таблица 8
Способность нейтрофилов к формированию внеклеточных ловушек у пациентов с наличием деструкции легочной ткани (1-я группа) и без распада легочной ткани (2-я группа), Me (Q1; Q3)
|
Объекты, определяемые в препарате нейтрофилов |
Исследуемые группы |
|
|
1-я группа |
2-я группа |
|
|
Интактные нейтрофилы, % |
33,1 (29,8; 44,3) |
37,8 (34,4; 44,4) |
|
Активированные нейтрофилы, % |
8,9 (5,7; 10,6) |
18,2 (12,2; 28,2) p=0,0098 |
|
Клетки раннего нетоза, % |
14,4 (13,6; 16,7) |
7,7 (5,9; 12,3) p=0,0098 |
|
Облаковидные НВЛ, % |
32,5 (26,1; 43,1) |
24,6 (18,3; 27,5) p=0,0209 |
|
Нитевидные НВЛ, % |
10,7 (7,1; 11,9) |
5,9 (2,9; 12,2) |
Примечание: p – достоверность различий по отношению к показателям в группе 1 (U-критерий Манна–Уитни).
Таким образом, более выраженные повреждения в легких в группе 1 были сопряжены с большей выраженностью нетоза. Полученные авторами данные согласуются с результатами непосредственного определения НВЛ в очагах деструкции легкого [14] и указывают на возможность использования оценки способности нейтрофилов к образованию НВЛ как малоинвазивного теста для оценки состояния больных туберкулезом.
Заключение
В ходе исследования выяснили, что распад легочной ткани наблюдается у пациентов с пред-ШЛУ возбудителя при процессе, поражающем более одной доли легкого, у пациентов с обильным выделением МБТ, установленным методом люминесцентной микроскопии, а также быстрым (менее 30 дней) и массивным (+++) ростом возбудителя на ППС. Анализ полиморфизма IL1A (rs1800587) показал преобладание гетерозигот в группе без деструкции в легком (р=0,021). Генотипирование TNFA (rs1800629) выявило различия только в носительстве аллелей, аллель А доминировал у больных с распадами в легком, аллель G – без таковых (р=0,022). Распределение генотипов и аллелей полиморфизма IL6 (rs1800795) в сравниваемых группах не показало статистически значимых различий. Способность лейкоцитов периферической крови к формированию НВЛ также была выше в группе больных с распадами в легком. Таким образом, выявленные особенности группы больных туберкулезом с распадами в легком могут в дальнейшем использоваться для построения модели прогноза течения заболевания.
Библиографическая ссылка
Самсонов К.Ю., Мордык А.В., Ароян А.Р., Новиков Д.Г., Золотов А.Н., Кухлов В.В., Иванова О.Г. ПОЛИМОРФИЗМ ГЕНОВ IL1A, TNFA, IL6 И СПОСОБНОСТЬ НЕЙТРОФИЛОВ К ФОРМИРОВАНИЮ ВНЕКЛЕТОЧНЫХ ЛОВУШЕК У ПАЦИЕНТОВ С ОСЛОЖНЕННЫМИ И НЕОСЛОЖНЕННЫМИ ФОРМАМИ ВПЕРВЫЕ ВЫЯВЛЕННОГО ТУБЕРКУЛЕЗА // Современные проблемы науки и образования. 2024. № 5. ;URL: https://science-education.ru/ru/article/view?id=33706 (дата обращения: 25.02.2026).
DOI: https://doi.org/10.17513/spno.33706



