Введение
Хроническая обструктивная болезнь легких (ХОБЛ) определяется как заболевание, для которого характерно персистирующее ограничение воздушного потока, имеющее тенденцию к прогрессированию и возникающее вследствие хронического воспалительного процесса в дыхательных путях и легочной ткани, отражающее влияние ингалируемых повреждающих частиц или газов. Обострения и коморбидные состояния являются характерной особенностью болезни и вносят значительный вклад в характер течения ХОБЛ [1].
ХОБЛ является глобальной проблемой. В 2019 году распространенность ХОБЛ в мире составила 2638,2 на 100 000 человек, смертность – 42,5 на 100 000 человек [2]. В России в 2020 году зарегистрировано хронических болезней органов дыхания 61312000 [3]. Около 1,5 млн (2,4%) больных с ХОБЛ состоят на диспансерном учете. ХОБЛ занимает третье место среди причин смерти после инфаркта мозга и ишемической болезни сердца и первое место среди болезней органов дыхания. Почти у половины больных возникают обострения 1 раз в год, требующие госпитализации [4]. По данным одномоментного популяционного эпидемиологического исследования, проведенного в 12 регионах России в рамках программы GARD (The Global Alliance against Chronic Respiratory Diseases) и включившего 7164 человека (средний возраст – 43,4 года), распространенность ХОБЛ среди лиц с респираторными симптомами составила 21,8%, а в общей популяции — 15,3% [5]. По данным исследования амбулаторных больных, включавшего 1000 человек прикрепленного населения в возрасте от 40 до 75 лет, у 41 человека (4,2%) была диагностирована ХОБЛ в соответствии с критериями GOLD-2019, а 2 (0,2%) имели ранее установленный диагноз ХОБЛ [6]. По данным ретроспективного исследования аутопсий, в 25,6% случаев имелись клинические и морфологические проявления ХОБЛ как сопутствующего заболевания, которое в большинстве случаев при отсутствии адекватной терапии способствовало прогрессированию основного патологического процесса. Среди них в 58,8% случаев аутопсии при исследовании органов дыхания обнаруживались макроскопические проявления ХОБЛ [7]. Предложена прогностическая модель, которая составлена на основании анализа данных о распространенности основных факторов риска (курение, загрязнение воздуха, пол и др.), предполагающая, что к 2050 году глобальная распространенность ХОБЛ среди людей в возрасте 25 лет и старше увеличится на 23% и достигнет 600 млн случаев. Наибольший прирост ХОБЛ будет наблюдаться у женщин, а также в регионах с низким/средним уровнем дохода населения [8].
Цель исследования: на основании обзора литературных данных оценить распространенность ХОБЛ, гетерогенность ее течения и современное представление о фенотипах заболевания.
Материалы и методы исследования: в обзоре литературы проанализировано 52 статьи за период с 1966 по 2023 годы, 37 из них включены в список литературы, по ключевым словам: ХОБЛ, «фенотипы», «распространенность», «коморбидность». Использованы базы научных данных pubmed.ncbi.nlm.nih.gov, elibrary.ru cyberleninka.ru.
На основании изучения литературных данных проведена оценка распространенности ХОБЛ. Это заболевание является широко распространенным, но данные эпидемиологических исследований существенно превышают данные заболеваемости по обращаемости, что обусловлено повсеместной несвоевременной диагностикой ХОБЛ. ХОБЛ характеризуется гетерогенностью течения и наличием большого количества коморбидных заболеваний, которые оказывают существенное влияние на течение заболевания, качество жизни и прогноз. Гетерогенность ХОБЛ привела к пониманию необходимости персонификации терапии заболевания, поэтому в течение нескольких десятилетий развивается представление о фенотипах ХОБЛ. Вначале в фенотипировании использовался только клинический подход, затем он был дополнен данными морфологического и рентгенологического исследования. Однако этого оказалось недостаточно ввиду наличия воспаления как важнейшего компонента патогенеза заболевания. Это привело к необходимости учета признаков клеточного воспаления в фенотипировании ХОБЛ. Дальнейшие исследования выявили влияние иммунометаболических и генетических механизмов на клинические проявления, течение и прогноз ХОБЛ. Присущие ХОБЛ коморбидность и их совместное негативное влияние на прогноз заставляют учитывать это в диагностике и разработке плана лечения ХОБЛ. Таким образом, фенотипирование ХОБЛ с целью персонификации терапии – это насущная проблема, решение которой открывает перспективу в лечении ХОБЛ.
Результаты исследования и их обсуждение
Фенотипы ХОБЛ
ХОБЛ – это гетерогенное заболевание с респираторными и экстрапульмональными проявлениями, где последние обусловлены поступлением цитокинов в системный кровоток в результате длительного воспалительного процесса в дыхательных путях, что приводит к отягощению течения заболевания. К ним можно отнести дисфункцию скелетной мускулатуры, раннее развитие атеросклероза, снижение массы тела, остеопороз, анемию и депрессию. Гетерогенность ХОБЛ вызвала необходимость персонификации терапии с учетом пульмональных и экстрапульмональных проявлений заболевания, что, в свою очередь, привело к необходимости фенотипирования заболевания. В настоящее время фенотип ХОБЛ понимают как «один или несколько признаков болезни, по которым данный индивид отличается от других пациентов с ХОБЛ в плане клинически значимых особенностей заболевания, таких как респираторные симптомы, количество обострений, ответ на терапию, скорость прогрессирования болезни и вероятность летального исхода» [9]. Изначально дифференциация вариантов ХОБЛ была основана на клинических признаках.
Более 50 лет назад A. Dornhorst выделил 2 фенотипа пациентов с ХОБЛ. Это легло в основу классических фенотипов – эмфизематозный и бронхитический. Первый фенотип сочетает в себе признаки эмфиземы со сниженной массой тела и отсутствие цианоза кожных покровов, главным проявлением является одышка, второй – повышенную массу тела, цианоз кожных покровов и признаки правожелудочковой недостаточности, доминирующим симптомом является кашель с мокротой [10]. В 1966 году B. Burrows и соавт. сопоставили морфологические, клинические и рентгенологические признаки ХОБЛ у разных больных и пришли к выводу о разделении их на подгруппы: эмфизематозную (худые с эмфиземой) и бронхитическую (коренастые с бронхитом) [11]. В дальнейшем были описаны фенотипы ХОБЛ: перекрестный с астмой, быстро прогрессирующий фенотип со стремительным снижением функции легких (по показателям спирометрии) [12, 13]. Испанские рекомендации по ХОБЛ предлагают 4 фенотипа: 1) больные с эмфиземой или хроническим бронхитом с редкими обострениями; 2) смешанный фенотип «ХОБЛ + бронхиальная астма (БА)»; 3) больные с эмфиземой и частыми обострениями; 4) больные с хроническим бронхитом и частыми обострениями [14]. В исследовании Phenotypes of COPD in Central and Eastern Europe (POPE) выделены следующие фенотипы ХОБЛ: с редкими обострениями; синдром перекреста БА и ХОБЛ; с частыми обострениями хронического бронхита и без такового. В клинических рекомендациях по ХОБЛ в Чехии фенотипы определяются как: бронхитический, эмфизематозный, перекрест ХОБЛ + БА, перекрест ХОБЛ + бронхоэктазы, с частыми обострениями, ХОБЛ с пульмонологической кахексией [15].
Со временем в представлении о фенотипах ХОБЛ появилось отражение периодов обострения и ремиссии заболевания. Это обусловило изучение типа клеточного воспаления, определяющего патогенез заболевания, и выделение следующих вариантов: эозинофильного и нейтрофильного [16]; с преобладанием Tp-, Tp/Tp7- и Tp7-зависимого пути воспаления [17]; иммунометаболического: иммуносупрессивного со сбалансированными реакциями ПОЛ-АОЗ (перекисное окисление липидов – антиоксидантная защита); иммуносупрессивного с разбалансированной работой системы ПОЛ-АОЗ; иммунодефицитного с несбалансированной работой системы ПОЛ-АОЗ [18].
Фенотип с частыми обострениями занимает особое положение в изучении, так как в этой группе больше обращаемость за медицинской помощью, выше риск повторных обострений, значимое влияние на качество и продолжительность жизни и хуже прогноз. Следует отметить, что с каждым обострением функция легких становится хуже, что приводит к повторным обострениям, хронической дыхательной недостаточности, требующим длительной кислородотерапии. В исследовании ECLIPSE продемонстрировано развитие 2 и более обострений в год у 12% среди 2138 пациентов в течение 3 лет наблюдения [19]. Возможно, этот фенотип является генетически детерминированным. Установлено, что он чаще развивается у носителей генотипа СС по полиморфизму С+262Т гена каталазы, которые имели 3 и более обострения в год [20], а также у лиц с относительно высокой экспрессией TRPV1 в легких [21]. Носительство гетерозиготного генотипа CT однонуклеотидного полиморфизма rs460716 гена TRPV1 чаще встречалось у больных с быстропрогрессирующим падением ОФВ1 и частыми обострениями по сравнению с гомозиготным CC или TT носительством [22].
Установлено, что определенная группа больных ХОБЛ имеют преимущественно эозинофильный тип воспаления дыхательных путей, которое считается более характерным для астмы, чем для ХОБЛ [23]. Предложены разные критерии определения эозинофильного воспаления при ХОБЛ: наличие более 3% эозинофилов среди лейкоцитов индуцированной мокроты [24]; наличие 300 и более эозинофилов в 1 мкл периферической крови [25,с. 277]; повышение эозинофильного катионного белка в крови выше пороговых значений [16]. Возможно, эозинофильный нейротоксин изменяет снижает порог чувствительности гладкой мускулатуры бронхиол к нейромедиаторам [26]. Это может обусловливать гиперреактивность и развитие частых обострений у лиц с эозинофильным типом воспаления. Так, у больных ХОБЛ с эозинофилией крови менее 200 кл/мкл частота обострений составила 0,89 в год, 200–300 кл/мкл эозинофилов – 1,21 обострения/год, 400–500 кл/мкл эозинофилов – 1,24 и с эозинофилией крови 600 кл/мкл и более – 1,62 обострения ХОБЛ в год [27]. Распространенность гиперэозинофилии (300 и более кл/мкл) при ХОБЛ, по данным разных источников, при обострении 13–24% [28, 29], а в стабильном состоянии отмечается у меньшей части пациентов с ХОБЛ и колеблется в диапазоне от 17 до 21% [30]. Следует помнить о других возможных причинах эозинофилии периферической крови, таких как: бронхиальная астма, аллергический бронхолегочный аспергилез, эозинофильная пневмония, эозинофильный бронхит при синдроме Чeрджа–Стросс, пневмомикоз, гельминтоз, пневмоцистная пневмония, лекарственно-индуцированные поражения легких, лимфома Ходжкина и др.
Выделение фенотипа «астма + ХОБЛ перекрест» обусловлено тем, что как у длительно болеющих БА могут появиться клинико-лабораторные признаки ХОБЛ, так и у больных ХОБЛ возможен поздний дебют БА. В первом случае факторами риска развития ХОБЛ на фоне существующей БА могут быть: пассивное и активное курение, низкая приверженность к лечению, позднее начало базисной терапии БА, повышенный индекс массы тела, повышение уровней IgG к S. рneumoniae, H. influenzae, N. perflava [31]. В случае развития признаков БА на фоне существующей ХОБЛ особую роль играют предрасполагающие факторы, такие как отягощенный анамнез по атопии, хронические заболевания верхних дыхательных путей, эозинофилия [32]. Сочетание ХОБЛ и БА закономерно отличается более тяжелым течением, трудно поддается лечению и значительно ухудшает качество жизни [33]. При существующей БА в случае индекса Генслера ОФВ1/ФЖЕЛ менее 0,7 после бронхолитической пробы и при отсутствии признаков эмфиземы устанавливают диагноз бронхиальной астмы с фиксированной обструкцией (БА + ФО). Предполагается, что фиксированная обструкция при БА обусловлена ремоделированием дыхательных путей, без поражения легочной паренхимы, которая у части пациентов формируется несмотря на лечение ингаляционными и/или системными глюкокортикостероидными препаратами и длительно действующими β-агонистами [34]. Напротив, при наличии эмфиземы и ОФВ1/ФЖЕЛ менее 0,7 после бронхолитической пробы устанавливают диагноз БА + ХОБЛ [35]. Выделение БА + ФО позволяет разграничить промежуточное положение между БА с поражением легочной паренхимы и необратимость ограничения воздушного потока, присущее ХОБЛ. Согласно испанским диагностическим критериям, диагноз БА + ХОБЛ устанавливается при наличии 2 больших критериев или 1 большого и 2 малых критериев. К большим критериям относятся: прирост ОФВ1 после пробы с бронхолитиком более 400 мл и более 15%, ранее существующая БА или эозинофилия мокроты. К малым критериям относятся: увеличение уровня сывороточного иммуноглобулина Е, атопия в анамнезе, прирост ОФВ1 более 200 мл и более 12% по крайней мере при двух измерениях. Длительное течение «астма – ХОБЛ перекрест» осложняется хронической дыхательной недостаточностью, развитием легочного сердца и формированием эмфиземы [35].
Перечисленные фенотипы могут сочетаться у одного больного, так проявляется гетерогенность ХОБЛ. Так, в исследовании CLOUD, с выборкой 1029 больных ХОБЛ, наличие одного фенотипа отмечено только у 48,8% больных, сочетание двух разных фенотипов – у 39,3%, трех – у 11,5% , четырех – у 0,5%. Наиболее частыми сочетаниями были: хронический бронхит + частые обострения (17,9%); эмфизема + частые обострения (8,5%); эмфизема + частые обострения + пульмонологическая кахексия (3,2%) [15]. На рисунке представлены фенотипы тяжелой и очень тяжелой ХОБЛ в Российской Федерации. 21,7% составляют «другие» фенотипы ХОБЛ, что свидетельствует о сочетании различных фенотипов у одного пациента [36]. Таким образом, представление о фенотипах ХОБЛ претерпевает развитие от клинического подхода к исследованию маркеров воспаления и к оценке иммунометаболических и генетических звеньев патогенеза заболевания.
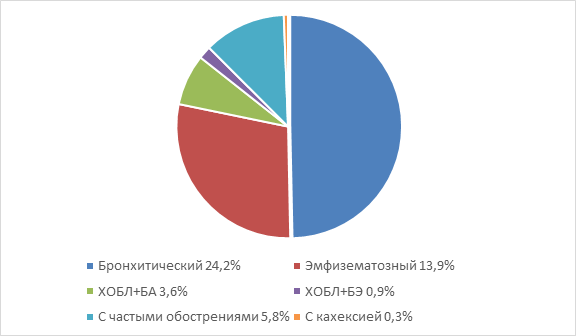
Распространенность фенотипов ХОБЛ в Российской Федерации [36]
Методы оценки коморбидных состояний
ХОБЛ характеризуется наличием коморбидных состояний, которые существенно влияют на клиническую картину и прогноз заболевания [1], поэтому представляются необходимыми их оценка и учет при определении фенотипа ХОБЛ. Стремление к фенотип-специфической терапии будет способствовать стабилизации течения имеющихся хронических коморбидных заболеваний, улучшая прогноз и качество жизни больного. Обсуждается роль хронического системного воспаления как отягощающего фактора, ухудшающего прогноз. Следует отметить, что в течение ряда лет предпринимались многочисленные попытки проведения количественной оценки клинической и прогностической значимости коморбидной патологии у конкретного пациента. Предложены следующие индексы и системы оценки: Kaplan-Feinstein, GIC (Geriatric Index of Comorbidity), индекс TIBI (Total Illness Burden Index), шкала хронических заболеваний CDS (Chronic Disease Score), система ACG (Adjusted Clinical Groups), система CIRS или CIR (Cumulative lllness Rating Scale), система CIRS-G (Cumulative lllness Rating Scale for Geriatrics [36]. Однако для использования опросников и шкал в реальной клинической практике требуются их стандартизация и валидизация. Вероятно, необходимо сочетание различных шкал для объективной оценки коморбидности. Следует отметить, что в настоящее время методика оценки коморбидности в условиях первичного звена здравоохранения РФ не разработана [37].
Заключение
ХОБЛ из-за широкой распространенности, медицинских и социальных последствий является значимой проблемой современного здравоохранения. Своевременная диагностика заболевания, определение его фенотипа необходимы для проведения эффективного лечения и профилактики обострений с учетом особенностей, присущих конкретному фенотипу ХОБЛ. Представление о фенотипах ХОБЛ непрерывно совершенствуется. Вначале фенотипы ХОБЛ определялись на основании клинических признаков, затем стали использоваться морфологические и рентгенологические проявления заболевания, позже – маркеры воспаления. Таким образом, в настоящее время придается значение клиническим признакам, типу воспаления, оценке иммунометаболических и генетических звеньев патогенеза заболевания. Экстрапульмональные проявления и коморбидные состояния являются неотъемлемой частью болезни, которые необходимо учитывать при постановке диагноза и разработке плана лечения и профилактики. Однако в настоящее время методика оценки коморбидности в условиях первичного звена здравоохранения РФ не разработана.
Библиографическая ссылка
Овсянников Н.В., Хасанов К.С. ПРОЯВЛЕНИЕ ГЕТЕРОГЕННОСТИ ХРОНИЧЕСКОЙ ОБСТУРКТИВНОЙ БОЛЕЗНИ ЛЕГКИХ В ФЕНОТИПАХ // Современные проблемы науки и образования. 2024. № 5. ;URL: https://science-education.ru/ru/article/view?id=33682 (дата обращения: 25.02.2026).
DOI: https://doi.org/10.17513/spno.33682



