Введение
Глиобластома – наиболее распространенная (50,1%) форма злокачественной опухоли головного мозга у взрослых, характеризующаяся быстрым ростом и высокоинвазивным характером. Несмотря на значительные успехи в хирургических, лучевых и химиотерапевтических методах лечения, прогноз для пациентов остается мрачным: медиана выживаемости составляет 15 месяцев, снижаясь до 4 месяцев у пожилых пациентов, а 5-летняя выживаемость составляет лишь 5,4% [1].
Стандартное послеоперационное лечение глиобластомы включает лучевую терапию, сопровождаемую алкилирующим химиотерапевтическим препаратом темозоломидом. Одной из основных причин неудачи химиотерапии глиобластомы является резистентность к темозоломиду. O6-метилгуанин-ДНК-метилтрансфераза играет ключевую роль в формировании устойчивости к темозоломиду, деметилируя основания, алкилированные в результате химиотерапии [2; 3].
Химиотерапия глиобластомы часто сопровождается системной токсичностью, включая гематологические осложнения (миелосупрессия), желудочно-кишечные расстройства (тошнота и мукозит), а также неврологические побочные эффекты (когнитивные нарушения, периферическая невропатия). Кроме того, могут возникнуть кардио-, нефро- и гепатотоксичность, что создает серьезные проблемы для пациентов. Химиотерапия остается неотъемлемой частью лечения глиобластомы, в связи с этим разработка стратегий для снижения токсичности и создание препаратов с улучшенной переносимостью имеют решающее значение для повышения эффективности лечения [4]. Таким образом, существует острая необходимость в разработке новых терапевтических средств, которые могли бы улучшить результаты лечения и качество жизни пациентов с глиобластомой.
Среди перспективных ингибиторов опухолевого роста выделяются алкалоиды трополонового ряда, такие как колхицин, хинокитиол (бета-туяплицин) и колхамин [5]. Эти алкалоиды обладают разнообразной биологической активностью, включая антипролиферативные свойства в отношении различных линий раковых клеток, включая злокачественные клетки рака желудка, эндометрия и остеосаркомы [5; 6].
Химическая структура трополона, характеризующегося семичленным ароматическим кольцом, содержащим гидроксильную группу, допускает различные модификации, способные повысить его биологическую активность и специфичность. Недавние исследования были сосредоточены на синтезе производных трополонового ряда с целью использования его потенциала в качестве терапевтического средства против различных видов рака [7; 8].
Среди этих синтетических производных трополонов некоторые соединения показали в доклинических исследованиях многообещающую способность индуцировать апоптоз, ингибировать пролиферацию клеток и влиять на опухолевый ангиогенез [9]. Однако противоопухолевые эффекты этих производных на глиобластому, особенно на моделях in vivo, остаются недостаточно изученными. С учетом этого факта исследования эффективности новых соединений трополонового ряда на биологических моделях in vivo имеют решающее значение для разработки эффективных методов лечения.
Цель настоящего исследования – оценить противоопухолевый эффект 2-(1,1-диметил-1H-бензо[e]индолин-2-ил)-5,6,7-трихлор-1,3-трополона в отношении подкожных ксенографтов культуры клеток глиобластомы U87 на иммунодефицитных мышах Balb/c Nude.
Материалы и методы исследования
Исследуемое соединение, 2-(1,1-диметил-1H-бензо[e]индолин-2-ил)-5,6,7-трихлор-1,3-трополон (далее JO-122(2)), было синтезировано в НИИ физической и органической химии Южного федерального университета методом реакции расширения о-хинонового цикла [10]. Вещество относится к новым соединениям в ряду 2-гетарил-1,3-трополонов и представляет собой порошок оранжевого цвета.
Исследуемый трополон оказался слаборастворимым в воде, поэтому его предварительно растворяли в 50 мкл диметилсульфоксида (ДМСО). В качестве носителя для JO-122(2), растворенного в ДМСО, использовали 1%-ный крахмальный гель. Полученную суспензию готовили ex tempore и вводили каждому животному перорально с помощью зонда в объеме 0,2 мл скратностью 3раза внеделю в течение 3 недель. Введение веществ проводилось независимо от приема корма иводы.
Все экспериментальные процедуры были выполнены в соответствии с правилами Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (ETSN 123, Страсбург, 18 марта 1986 г.), и одобрены биотической комиссией ФГБУ «НМИЦ онкологии» Минздрава России. Для оценки противоопухолевой активности использовали 28 самок иммунодефицитных мышей линии Balb/c Nude сосредней массой тела 25–26г и возрастом 10–12недель. Лабораторные животные были получены из внутреннего ядра разводки вивария ФГБУ «Национальный медицинский исследовательский центр онкологии» Министерства здравоохранения Российской Федерации. Мыши содержались виндивидуально вентилируемых клетках (IVC) системы Tecniplast (Италия) со свободным доступом к воде и корму, при температуре 21–23°С, относительной влажности воздуха 50–60% и ссоблюдением светового режима день/ночь (12/12часов). Мышей во всех исследуемых группах взвешивали в начале и в конце эксперимента.
Клеточную линию глиобластомы U87 культивировали в питательной среде DMEM с добавлением 10% телячьей сыворотки (Gibco, Thermo Fisher Scientific), а также 1% пенициллина и стрептомицина. Культивирование осуществляли в СО2–инкубаторе (Thermo Fisher Scientific, 8000W) при влажной атмосфере – 37 °C, 5% CO2.
Для создания подкожных опухолей животным формировали кожную складку на боку и вводили в нее 5×106 опухолевых клеток в0,2мл бессывороточной питательной средыDMEM иMatrigel (экстракт базальной мембраны, Corning) всоотношении 1:1.
После достижения опухолевыми узлами объема 100мм3 животные были распределены на 4группы таким образом, чтобы средний объем подкожных ксенографтов не отличался между группами более чем на 10%. Схема распределения животных по группам исоответствующие дозы трополона представлены втаблице 1.
Таблица 1
Распределение мышей по группам в эксперименте
|
Наименование группы |
Количество животных |
Вводимое вещество |
Доза вещества, мг/кг |
|
Опытная 1 |
7 |
Трополон |
10 |
|
Опытная 2 |
7 |
Трополон |
20 |
|
Опытная 3 |
7 |
Трополон |
30 |
|
Контрольная |
7 |
Крахмальный гель |
1% |
Динамику роста подкожных ксенографтов оценивали путем измерения объема опухолевых узлов 3 раза в неделю, начиная со дня введения вещества. Объем опухолевых узлов рассчитывали по формуле:
V= LW2,
где V – объем опухоли, L и W– линейные размеры опухоли (мм).
Для оценки противоопухолевого эффекта трополона использовали показатели торможения роста опухоли (ТРО%) [11]:
ТРО (%) = (Vk - Vo) / Vk × 100,
где Vk и Vo – средний объем опухоли (мм3) в контрольной и опытных группах соответственно.
Эксперимент длился 25 дней, начиная с первого введения вещества. Процедуру эвтаназии проводили путем декапитации, после чего производили забор крови и извлечение опухолевого материала, легких, печени, почек, селезенки и сердца. Органы и опухоли взвешивали для расчета относительной массы каждого органа по формуле:
mотн (%) = (mo (г) / mт (г)) × 100,
где mо – масса органа (г), mт – масса тела животного (г).
Полученный опухолевый материал фиксировали в10%-ном формалине 24 ч, затем заключали впарафин, при помощи роторного микротома делали срезы, которые вдальнейшем подвергали депарафинизации по стандартному протоколу. Для гистологического исследования выполняли окрашивание гематоксилином иэозином. ИГХ-окрашивание проводили вавтоматическом режиме виммуногистостейнере BenchMark ULTRA Ventana согласно протоколам фирм-производителей, прилагаемым киспользуемым антителам. Использовали антитела Ki‑67 (клон SP6), CellMarque вразведении 1:200. Для анализа экспрессии Ki‑67 опухолевыми клетками вычисляли долю клеток сокрашенными ядрами (процент от общего количества опухолевых клеток) не менее чем в10 рандомных полях зрения.
Данные выражены в виде среднего значения ± стандартная ошибка среднего, которые были рассчитаны с использованием Statistica 10. Нормальность распределения данных проверяли с помощью критерия Шапиро-Уилка. Для оценки различий между экспериментальными группами применяли однофакторный дисперсионный анализ (ANOVA). Различия считали значимыми при р<0,05.
Результаты исследования и их обсуждение
Показатель среднего объема опухоли на 25-е сутки эксперимента в опытных группах 1, 2 и 3 и в группе контроля составил 1761,65±326,94; 1096,43±282,38; 1241,77±248,04; 1356,04±206,54 мм3 соответственно. Динамика роста подкожных опухолей самок мышей Balb/c Nude во всех исследуемых группах представлена на рисунке 1.
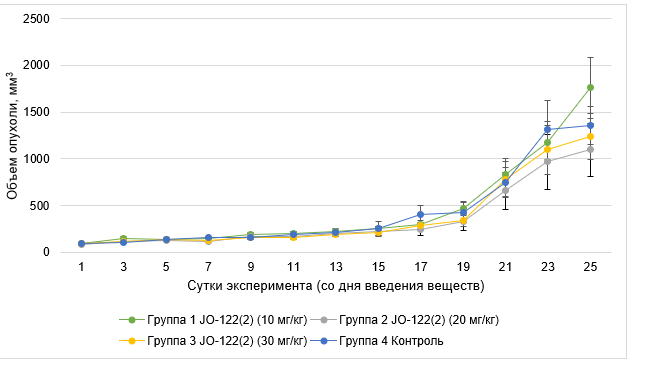
Рис. 1. Средние объемы опухолевых узлов у мышей Balb/c Nude в динамике
Установлено, что, несмотря на введение трополона в дозах 10, 20 и 30 мг/кг, существенных изменений объема опухоли в исследуемых группах по сравнению с контрольной группой не наблюдалось. Максимальные различия наблюдались между группами 2 и 4 на 23-и сутки после начала введения препаратов (объем опухоли группы 2 был меньше, чем объем опухоли группы 4, в 1,36 раза), однако различия не были статистически значимы.
В таблице 2 представлены показатели ТРО и относительной массы опухоли в зависимости от дозы исследуемого соединения.
Таблица 2
Влияние различных доз исследуемого трополона на относительную массу опухоли и показатель торможения роста опухоли (ТРО) в исследуемых группах на 25-е сутки эксперимента
|
Группа |
Относительная масса опухоли, % |
ТРО, % |
|
Группа 1 JO-122(2) (10 мг/кг) |
10,75±2,15 |
-29,91 |
|
Группа 2 JO-122(2) (20 мг/кг) |
8,42±1,82 |
19,14 |
|
Группа 3 JO-122(2) (30 мг/кг) |
12,83±2,37 |
8,43 |
|
Группа 4 Контроль |
11,34±1,21 |
- |
Наибольшее торможение роста опухоли наблюдалось в группе, получавшей 20 мг/кг трополона, при этом значение ТРО составило 19,14%. Также было установлено, что применение исследуемого трополона в дозах 10, 20 и 30 мг/кг не вызывало достоверного снижения массы опухоли.
После выполнения измерений массы опухолевых узлов их подвергли дальнейшему гистологическому исследованию (рис. 2).
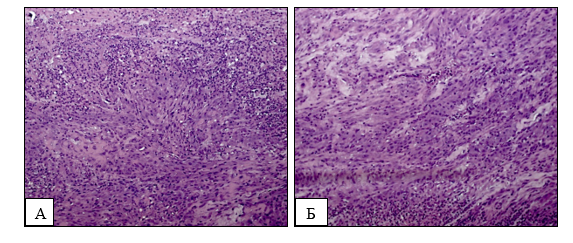
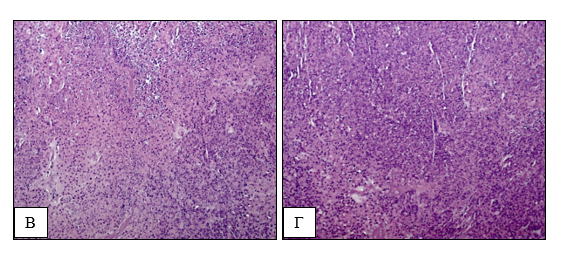
Рис. 2. Гистологический препарат подкожных ксенографтов клеточной линии глиобластомы U87. А – 1-я группа; Б – 2-я группа; В – 3-я группа; Г – 4-я группа. Окрашивание гематоксилином и эозином. Увеличение ×200
В гистологических препаратах определялась злокачественная опухоль, имеющая строение глиобластомы. В полях зрения наблюдались немногочисленные мелкие очаги некроза.
Также было выполнено иммуногистохимическое исследование ксеногенных опухолей (рис. 3).
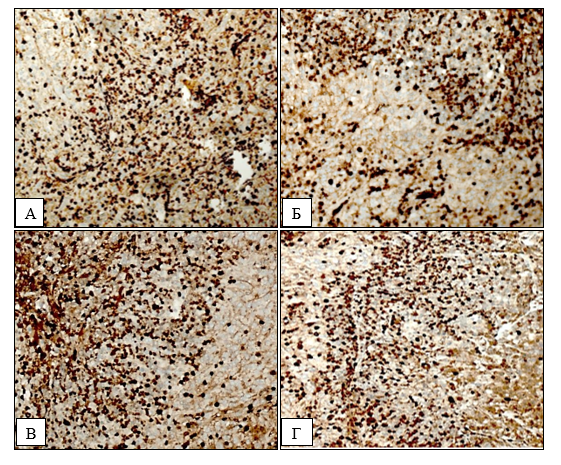
Рис. 3. ИГХ-реакция ткани ксенографтов на антитела к Ki-67. А – 1-я группа; Б – 2-я группа; В – 3-я группа; Г – 4-я группа. Увеличение ×200
ИГХ-исследование экспрессии маркера пролиферации Ki‑67 в тканях подкожных ксенографтов глиобластомы U87 показало, что количество иммунопозитивных клеток во всех образцах составляло 70±10%. Значимых различий между исследуемыми группами по интенсивности и количеству окрашенных клеток в образцах не наблюдалось.
Массу тела мышей регистрировали в начале и в конце эксперимента, данные представлены в таблице 3.
Таблица 3
Среднее значение начальной и конечной массы тела мышей контрольной группы и мышей, получавших различные дозы исследуемого трополона
|
Группы |
Начальная масса тела (г) |
Конечная масса тела (г) |
Изменение (г) |
|
Группа 1 JO-122(2) (10 мг/кг) |
26,2±0,9 |
26,0±0,9 |
-0,17±0,56 |
|
Группа 2 JO-122(2) (20 мг/кг) |
26,0±0,8 |
25,3±0,7 |
-0,67±0,31 |
|
Группа 3 JO-122(2) (30 мг/кг) |
25,8±1,1 |
25,3±1,5 |
-0,50±0,90 |
|
Группа 4 Контроль |
24,8±1,4 |
23,9±0,9 |
-0,88±0,55 |
Никаких существенных изменений (p>0,05) массы тела между группами лечения и контрольной группой на протяжении всего периода исследования не наблюдалось, что указывает на то, что производное трополона не влияло на общий рост и не вызывало значительной потери веса.
Также оценивали относительный вес органов (печень, почки, селезенка и сердце), данные представлены в таблице 4.
Таблица 4
Относительная масса органов мышей контрольной группы и мышей, получавших различные дозы исследуемого трополона
|
Относительная масса органа (%) |
Группа 1 JO-122(2) (10 мг/кг) |
Группа 2 JO-122(2) (20 мг/кг) |
Группа 3 JO-122(2) (30 мг/кг) |
Группа 4 Контроль |
|
Сердце |
0,71±0,01 |
0,78±0,01 |
0,74 |
0,84±0,01 |
|
Почки |
1,83±0,02 |
1,85±0,02 |
1,90±0,03 |
1,97±0,03 |
|
Печень |
7,10±0,12 |
7,32±0,09 |
7,07±0,11 |
7,81±0,05 |
|
Легкие |
1,31±0,04 |
1,30±0,03 |
1,41±0,03 |
1,50±0,02 |
|
Селезенка |
2,03±0,10 |
2,25±0,09 |
2,27±0,06 |
2,68±0,05 |
Было отмечено, что относительная масса селезенки в группах животных, принимающих 10, 20 и 30 мг/кг была меньше на 0,65, 0,43, и 0,41, чем масса селезенки животных в контрольной группе, однако различия не были статистически значимы. Относительный вес других органов также не показал существенных изменений по сравнению с контрольной группой, что указывает на отсутствие существенной органоспецифической токсичности.
Целью нашего исследования была оценка противоопухолевой активности 2-(1,1-диметил-1H-бензо[e]индолин-2-ил)-5,6,7-трихлор-1,3-трополона на подкожных ксенографтных клетках глиобластомы U87 у иммунодефицитных мышей линии Balb/c Nude. Несмотря на введение трополона в различных дозах, результаты не показали значимого противоопухолевого эффекта, о чем свидетельствует отсутствие существенных изменений объема опухоли, индекса роста опухоли и торможения роста опухоли в экспериментальных группах по сравнению с контролем.
В ходе исследования также контролировали массу тела и относительную массу органов мышей, чтобы обнаружить любые признаки системной токсичности или побочных эффектов. Никаких существенных изменений массы тела между экспериментальной и контрольной группами не наблюдалось, что указывает на то, что производное трополона не оказывает негативного влияния на общий рост и не вызывает значительной потери веса. Относительный вес сердца, печени, почек, легких и селезенки не выявил значительных изменений, что также указывает на отсутствие органоспецифической токсичности.
Результаты этого исследования подчеркивают проблемы разработки эффективных методов лечения глиобластомы. Глиобластома, как известно, устойчива к традиционным методам лечения, и разработка новых терапевтических средств остается важной областью исследований. Так, в работе Senrung с соавторами сообщают, что на куриных эмбриональных моделях с ксенотрансплантированными опухолями U87 на хориоаллантоисной мембране (CAM) не наблюдалось существенной разницы в весе опухоли между контролем и лечением акситинибом, транс-халконом и пиперином [12]. А Adilijiang с соавторами сообщает, что ни темозоломид, ни монотерапия бевацизумабом, ни их комбинация не подавляли рост опухоли IDH1-wildtype на модели ксенографта культуры клеток U87 [13].
Хотя производные трополона показали многообещающую эффективность в доклинических исследованиях с участием других типов раковых клеток, их эффективность против глиобластомы in vivo остается неопределенной [14]. Отсутствие значительных противоопухолевых эффектов, наблюдаемых в этом исследовании, позволяет предположить, что необходима дальнейшая оптимизация соединения, включая модификации для повышения его биодоступности и эффективности, а также исследование его активности в комбинации с другими препаратами. Так, в исследовании Wu с соавторами подчеркивается, что лечение ингибитором PI3K бупарлисибом (BKM) или селективным ингибитором киназы WEE1 (MK1775) не оказывает существенного эффекта на ингибирование роста опухоли на подкожных ксенографтах культуры клеток GSC23, однако комбинированное лечение значительно подавляет рост опухоли [15].
При интерпретации результатов этого исследования следует учитывать несколько ограничений. Во-первых, дозы производного трополона могли быть неоптимальными для достижения значительного противоопухолевого эффекта. Во-вторых, вероятно, эффективность может быть более выраженной при использовании других способов введения тестируемого вещества, для чего необходимы работы по улучшению его растворимости в нетоксичных растворителях. Будущие исследования должны изучить более широкий диапазон доз и рассмотреть альтернативные пути введения для улучшения доставки лекарств к месту опухоли. Кроме того, сочетание трополона с другими терапевтическими агентами может повысить его эффективность за счет синергетического эффекта.
Заключение
Таким образом, введение 2-(1,1-диметил-1H-бензо[e]индолин-2-ил)-5,6,7-трихлор-1,3-трополона в изученных дозах не приводило к статистически значимому противоопухолевому эффекту на модели подкожного ксенографта глиобластомы U87. Соединение не вызывало значительных изменений массы тела или органоспецифической токсичности. Полученные данные свидетельствуют о том, что необходимы дальнейшие исследования для оптимизации его противоопухолевой эффективности. Будущие исследования должны быть сосредоточены на оптимизации доз, разработке альтернативных методов доставки и комбинированной терапии для улучшения терапевтического потенциала производных трополона для лечения глиобластомы.
Библиографическая ссылка
Кузнецова Н.С., Головинов И.В., Гончарова А.С., Шульга А.А., Росторгуев Э.Е., Гусаков Е.А., Пржедецкий Ю.В., Димитриади С.Н., Солдаткина Н.В. ОЦЕНКА ПРОТИВООПУХОЛЕВОГО ЭФФЕКТА 2-(1,1-ДИМЕТИЛ-1H-БЕНЗО[E]ИНДОЛИН-2-ИЛ)-5,6,7-ТРИХЛОР-1,3-ТРОПОЛОНА НА ПОДКОЖНЫХ КСЕНОГРАФТАХ КУЛЬТУРЫ КЛЕТОК ГЛИОБЛАСТОМЫ U87 // Современные проблемы науки и образования. 2024. № 5. ;URL: https://science-education.ru/ru/article/view?id=33668 (дата обращения: 25.02.2026).
DOI: https://doi.org/10.17513/spno.33668



