Введение
Основными нозологическими формами хронических, рецидивирующих, иммуноопосредованных воспалительных заболеваний кишечника (ВЗК) являются болезнь Крона (БК) и язвенный колит (ЯК) [1]. Для обоих заболеваний характерны общие клинические признаки, но различные распространенность, локализация и глубина воспалительного процесса [2]. Для дифференциальной диагностики форм ВЗК используют комбинацию клинических, эндоскопических, гистологических исследований, так как патогномоничного признака или диагностического параметра со 100%-ной специфичностью/чувствительностью не существует.
В последние годы метаболомные подходы показали многообещающие результаты в диагностике ВЗК [3–5]. Метаболомный анализ состоит из исчерпывающего и количественного изучения полного набора молекул, синтезируемых биологической системой, – метаболитов. Выбор материала в метаболомических исследованиях имеет ключевое значение, поскольку каждый тип образцов предоставляет различную биохимическую информацию: кровь – о системном метаболизме, профили кала – о пищеварительном. Анализ фекальных метаболитов остается трудной задачей из-за сложного состава кишечного содержимого, который формируется из соединений человеческого или микроорганизменного происхождения, а также соединений, с которыми у человека происходит ежедневный контакт [3].
Цель работы: проанализировать данные о спектре и эффектах действия микробных метаболитов кишечника.
Материалы и методы исследования. В литературном обзоре осуществлен анализ 229 современных российских и зарубежных тематических научных работ, представленных в научной электронной библиотеке eLibrary и в базах данных PubMed, Scopus. Поисковые запросы включали источники 2018–2024 гг. публикации. В результате обора в работу включены 30 источников.
Спектр микробных метаболитов фекалий. Микробиом кишечника человека и продукты его метаболизма играют важную роль в состоянии здоровья и развитии заболеваний [6]. Классическими симбионтами человека считаются бактерии родов Bifidobacterium, Bacteroides, Ruminococcus, Lactobacillus, патобионтами – Bacillus species (spp.), Clostridiums spp., Staphylococcus aureus, Streptococcus pyogenes, Prevotella spp. и др. [7]. Патогенный потенциал микроорганизмов может регулироваться секрецией амфиболитов. Взаимодействие представителей микробиома кишечника включает как синергические, так и антагонистические формы межмикробных отношений: коагрегацию, кооперацию в метаболизме субстратов, конкуренцию за питательные вещества, рецепторы адгезии слизистой оболочки (СО), изменение рН, окислительно-восстановительного потенциала, осмотического давления, продукцию факторов роста, метаболитов-супрессоров, бактериоцинов [8].
В обновленную базу метаболитов человека «HMDB 5.0» 2022 г. вошли данные 217 920 соединений, из которых 6 791 приходятся на долю метаболитов фекалий [9]. Анализ метаболитов фекалий является сложным процессом в связи с тем, что кишечный метаболом отражает сложное взаимодействие биологической активности микроорганизмов кишечника и типа питания, генотипа, состояния здоровья макроорганизма [10, 11].
Микробными метаболитами кишечника являются жирные кислоты, аминокислоты и их производные, спирты, альдегиды, фенолы и производные полифенолов, индолы и сульфиды [10]. По объему продукции метаболиты подразделяются на мажорные и минорные. Спектр основных (мажорных) метаболитов приведен в таблице 1.
Таблица 1
Спектр основных микробных метаболитов кишечника [7, 12]
|
Источник |
Метаболит |
|
|
Actinomyces spp., Bacteroides spp., Bifidobacterium spp., Clostridium spp., Lactobacillus spp., Prevotella spp., Ruminococcus spp., Streptococcus spp. |
короткоцепочечные жирные кислоты |
ацетат |
|
Acidaminococcus spp., Bacteroides spp., Butyrivibrio spp., Clostridium spp., Eubacterium spp., Faecalibacterium prausnitzii, Fusobacterium spp., Ruminococcus spp., Roseburia spp. |
бутират |
|
|
Clostridium spp., Megasphaera spp. |
валерат |
|
|
Bacteroides spp., Escherichia coli, Lactobacillus spp., Veillonella spp., Prevotella spp., Streptococcus spp. |
лактат |
|
|
Bacteroides spp., Dialister spp., Veillonella spp., Propionnibacterium spp., Prevotella spp., Ruminococcus spp. |
пропионат |
|
|
Bacteroides spp., Dialister spp., Veillonella spp., Prevotella spp. |
сукцинат |
|
|
Bacteroides spp., Clostridium spp., Eubacterium spp., Lactobacillus spp. |
желчные кислоты |
холевая, дезоксихолевая, урсодезоксихолевая, литохолевая кислоты |
|
Bacteroides spp., Clostridium spp., Escherichia coli, Lactobacillus spp. |
метаболиты триптофана |
кинуреновая кислота, гидрокситриптамин, производные индола |
|
Bacteroides spp., Bifidobacterium spp., Fusobacterium spp., Lactobacillus spp. |
витамины |
тиамин (витамин В1) |
|
Bacillus subtilis |
рибофлавин (витамин В2) |
|
|
Bacteroides fragilis, Escherichia coli, Prevotella copri, Ruminococcus spp. |
пантотеновая кислота (витамин В5) |
|
|
Bacteroides fragilis, Prevotella copri, Fusobacterium spp. |
биотин (витамин В7) |
|
|
Lactobacillus spp., Bifidobacterium spp., Bacteroides fragilis |
фолиевая кислота (витамин В9) |
|
|
Propionibacterium shermanii, Pseudomonas denitrificans |
цианокобаламин (витамин B12) |
|
|
Rhodotorula spp. |
β-каротин |
|
|
Bacteroides spp., Fusobacterium spp., Escherichia coli |
полиамины |
путресцин, спермидин, спермин |
|
Bacillus spp., Pseudomonas spp. |
ферменты |
липаза |
|
Bacillus spp., Lactobacillus spp., Pseudomonas spp., Streptomyces spp. |
протеаза |
|
|
Bacillus spp., Bifidobacterium spp. |
амилаза |
|
Микробные метаболиты активно всасываются или диффундируют через СО кишечника и при соединении со специфическими рецепторами подобно цитокинам могут оказывать местное (паракринное) или системное действие [12]. Обобщение имеющихся научных данных свидетельствует о полифункциональности и плейотропности микробных метаболитов кишечника (табл. 2).
Таблица 2
Эффекты действия основных микробных метаболитов кишечника [7, 12, 13]
|
Метаболит |
Эффект действия |
|
Ацетат, бутират, пропионат |
Увеличивают энергетический обмен, улучшают кровообращение СО и перистальтику кишечника, стимулируют пролиферацию и дифференцировку эпителиоцитов, оказывают иммуномодулирующее, противовоспалительное, противоопухолевое действие |
|
Валерат |
Оказывает анксиолитическое, иммуномодулирующее действие, снижает потребность в алкоголе [14] |
|
Лактат |
Стимулирует кровообращение, трофику и регенерацию СО кишечника, рост вейллонелл, лейкопоэз, эритропоэз; оказывает антацидное, антигипоксическое, противовирусное, антифунгицидное действие |
|
Сукцинат |
Увеличивает энергетический обмен, модулирует обмен липидов; оказывает антиоксидантное, антигипоксическое действие |
|
Желчные кислоты |
Антиатерогенное, иммуномодулирующее, противовоспалительное, противодиабетическое действие, модуляция обмена липидов [15] |
|
Метаболиты триптофана |
Оказывают антиоксидантное, иммуномодулирующее, нейротрофическое, противовоспалительное действие; стимулируют пролиферацию и дифференцировку эпителиоцитов, модуляцию обмена липидов [16] |
|
Тиамин |
Нормализует сократимость миоцитов, кислотность желудочного сока, иммунореактивность, проведение нервного импульса |
|
Рибофлавин |
Участвует в синтезе гемоглобина, в метаболизме белков, жиров, углеводов, способствует нормоксии эпителиоцитов кожи, глаз, СО |
|
Пантотеновая кислота |
Участвует в синтезе гемоглобина, ацетилхолина, кортикостероидов, в метаболизме белков, жиров, углеводов |
|
Биотин |
Участвует в метаболизме глюкозы, липидов, аминокислот, энергетическом обмене, противовоспалительное действие, регулирует кератинизацию и дифференцировку клеток эпидермиса |
|
Фолиевая кислота |
Участвует в эритропоэзе, в метаболизме белков, жиров, углеводов |
|
Цианокобаламин |
Участвует в гемопоэзе, в синтезе холина, метионина, нуклеиновых кислот, активирует свертываемость крови, обмен жиров, углеводов |
|
β-каротин |
Оказывает антигипоксическое, иммуномодулирующее действие |
|
Путресцин, спермидин, спермин |
Оказывает антиоксидантное, нейропротекторное действие, стимулирует пролиферацию и дифференцировку, регенерацию клеток |
|
Ферменты |
Участвуют в метаболизме белков, жиров, углеводов, нуклеотидов |
Механизмы действия короткоцепочечных жирных кислот (КЦЖК). КЦЖК – это органические жирные кислоты с менее 6 атомами углерода, являющиеся основными метаболитами брожения пищевых волокон в кишечнике [5]. Пищевые волокна, которые проходят через тонкий кишечник, не перевариваясь и не всасываясь, подвергаются ферментации бактериями толстой кишки. В норме производство ацетата, пропионата и бутирата происходит в соотношении 60:20:20 соответственно, при этом до 99% используется в кишечнике [13].
В последние годы многие исследования показали, что КЦЖК могут снижать выработку воспалительных факторов посредством нескольких сигнальных путей. Они ослабляют воспалительную реакцию за счет уменьшения выработки провоспалительных иммуномедиаторов и усиления выработки противовоспалительных. Установлено, что пропионат и бутират способны ингибировать активность ядерного фактора каппа B (NF-kB) и экспрессию интерлейкина (IL)-6, активных форм кислорода, а также усиливать экспрессию IL-10 [7, 13, 17]. Ранее установлено, что бутират уменьшает воспаление, вызванное липополисахаридом (ЛПС), посредством активации IL-10 при септическом шоке. Кроме того, показано, что ацетат эффективно устраняет нейтрофильное воспаление, индуцируя каспаз-зависимый апоптоз нейтрофилов, снижая активность NF-kB и повышая секрецию иммуносупрессивных IL-10, трансформирующего фактора роста-β и аннексина А1 [18, 19].
КЦЖК способны регулировать дифференцировку Т- и В-лимфоцитов, тем самым опосредовать реактивность антиген-специфического адаптивный иммунного ответа. Так, секреция IL-22 CD4+-T-хелперами индуцируется под действием КЦЖК посредством связывания рецептора G-белка 41 и ингибирования гистондеацетилазы (HDAC). Кроме того, бутират стимулирует продукцию IL-22 за счет увеличения связывания фактора, индуцируемого гипоксией 1α, с промотором IL-22 путем модификации гистонов. Показано, что все мажорные КЦЖК могут увеличивать секрецию IL-22 как на уровне мРНК, так и на уровне пептида. Также, КЦЖК способствуют развитию регуляторных Т-клеток и продукции IL-10 CD4+-T-хелперами, CD19+-В2-лимфоцитами [20].
КЦЖК принимают участие в B-клеточной дифференцировке за счет увеличения окислительного фосфорилирования, гликолиза, количества ацетил-коэнзима A и жирных кислот. Стимуляция дифференцировки B-лимфоцитов реализуется путем усиления экспрессии генов Xbp-1, Aicda и Prdm1 [21]. Одним из конечных результатов действия КЦЖК на гуморальный иммунитет является отмеченное при аллергическом воспалении респираторного тракта снижение повышенного уровня иммуноглобулина E [22].
Установлено, что КЦЖК оказывают протективный эффект в отношении эпителиоцитов кишечника и предотвращают развитие ВЗК [23]. Также обнаружено, что пропионат может способствовать миграции эпителиальных клеток кишечника, усиливая их распространение, поляризацию и устойчивость. Этот механизм реализуется посредством ингибирования HDAC I класса, рецептора, связанного с G-белком (GPR43), и сигнального белка и активатора транскрипции 3 (STAT3). Установлено, что таким образом пропионат может усиливать миграцию эпителиоцитов вверх по оси «крипта – ворсинка» и защищать от ульцерогенеза кишечника [24]. В другом исследовании установлено, что бутират способствует морфофункциональной целостности и гомеостазу кишечника, влияя на метаболизм и барьерную функцию кишечника [25]. Имеются данные, что белки теплового шока (HSP) в значительной мере обеспечивают цитопротекцию эпителиоцитов кишечника, в свою очередь, пропионат способствует гомеостазу кишечника за счет повышения уровня Hspa1a (мРНК HSP70) и активации HSP70 [26]. Установлено, что ацетат может индуцировать продукцию муцина бокаловидными клетками толстого кишечника, тем самым улучшая защитную функцию кишечного эпителия [27]. Также имеются данные, что ацетат, пропионат и бутират способны увеличивать трансэпителиальное электрическое сопротивление и образование плотных контактов, ингибировать индуцированные ЛПС увеличение парацеллюлярной проницаемости, активацию инфламмасомы белка 3 NOD (Nucleotide-oligomerizing domain)-подобного рецептора и аутофагию, уменьшая воспалительную реакцию и протектируя морфофункциональную целостность кишечника [28].
Органы-мишени действия микробных метаболитов кишечника. Проведенные экспериментальные и клинические научные исследования [7, 12, 19] свидетельствуют о многогранной роли микробных метаболитов кишечника как в поддержании здоровья, так и в патогенезе, регуляции течения заболеваний желудочно-кишечного тракта, сердечно-сосудистой, нервной, эндокринной систем, ответе на терапию (рисунок).
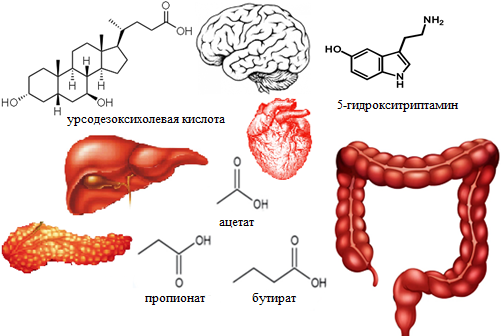
Органы-мишени действия микробных метаболитов кишечника
В ряде исследований продемонстрирована способность кишечной микробиоты и ее метаболитов оказывать гепатопротекторное действие за счет регуляции обмена липидов, подавления воспалительной реакции и увеличения митохондриальной эффективности с модуляцией энергетического обмена [4, 19, 29].
У больных циррозом печени (ЦП) и печеночной энцефалопатией (ПЭ) обнаружено снижение видового разнообразия кишечного микробиома и продукции КЦЖК при сравнении со здоровыми лицами. С тяжестью ЦП и ПЭ ассоциировалось накопление Enterococcus spp., Streptococcus spp., снижение Bacteroides spp. Выявлены средней силы отрицательные корреляционные связи количества бактерий рода Enterococcus с уровнями ацетата, бутирата, пропионата, валерата, никотиновой кислоты в фекалиях. Распространенность стрептококков была обратно взаимосвязана с концентрацией фекальной уксусной кислоты. Малое содержание КЦЖК может способствовать развитию ПЭ за счет повышения проницаемости барьера кишечника, усиления транслокации нейротоксинов, гипераммониемии. У больных ЦП отмечена отрицательная корреляция уровня триптамина в сыворотке с наличием асцита и количеством С-реактивного белка (СРБ), в фекалиях концентрация ацетата была обратно взаимосвязана с СРБ [29].
У больных ВЗК в ряде исследовании наблюдалось снижение разнообразия микробного профиля фекалий и метаболитов по сравнению со здоровыми лицами. Имеются данные, что у больных с БК при биологической терапии позитивный ответ развивался на фоне увеличения валерата, негативный – при накоплении лизина [12].
КЦЖК участвуют в регуляции двигательной активности кишечника и, соответственно, весьма эффективны при лечении запора, способствуя секреции кишечных гормонов/метаболитов и протектируя морфофункциональную целостность кишечного барьера [30]. Применение пробиотических препаратов сопровождается нивелированием дисбиоза кишечника, нормализацией уровня метаболитов, в частности КЦЖК, и, соответственно, увеличением подвижности «ленивого» кишечника и сокращением времени транзита [12].
Показано, что КЦЖК обладают антидиабетической активностью: повышают чувствительность тканевых рецепторов к инсулину, уменьшают глюконеогенез в печени, регулируют гомеостаз глюкозы. Перечисленные механизмы потенцируются снижением аппетита, липогенеза, трансформацией адипоцитов [19].
В свою очередь, желчные кислоты регулируют энергетический обмен несколькими механизмами, такими как: разобщение окислительного фосфорилирования митохондрий; активация дифференцировки преадипоцитов, термогенеза, β-окисления жирных кислот; повышение чувствительности к инсулину; супрессия липогенеза и синтеза липопротеидов низкой плотности (ЛПНП). Следовательно, нарушение метаболизма желчных кислот способствует развитию патологического процесса, клиническими примерами которого являются ожирение, сахарный диабет, сердечно-сосудистые заболевания. Установлено, что при ожирении нарушается конъюгация желчных кислот со специфическими рецепторами [15].
Имеются данные о противоопухолевой активности КЦЖК за счет супрессии пролиферации малигнизированных клеток, воспалительного процесса, метастазирования, стимуляции дифференцировки клеток [19].
Кардиопротективная активность КЦЖК осуществляется посредством модуляции липидного баланса (снижение ЛПНП), уменьшения артериального давления, антигипоксического, антиоксидантного и противовоспалительного действия.
Заключение. Оценка спектра микробных метаболитов позволяет уточнять патофизиологические механизмы многих соматических заболеваний и имеет высокую диагностическую ценность. Перспективы коррекции метаболической активности микробиоты кишечника путем применения про-/метабиотиков, трансплантации фекальной микробиоты и/или селективной деконтаминации неоднозначны, что обосновывает необходимость дальнейших исследований.
Библиографическая ссылка
Матвеева Л.В., Мосина Л.М., Киловатая О.А., Трохина И.Е., Савкина Н.В. МИКРОБНЫЕ МЕТАБОЛИТЫ КИШЕЧНИКА: СПЕКТР И ЭФФЕКТЫ ДЕЙСТВИЯ // Современные проблемы науки и образования. 2024. № 5. ;URL: https://science-education.ru/ru/article/view?id=33664 (дата обращения: 25.02.2026).
DOI: https://doi.org/10.17513/spno.33664



