Введение
В иммунопатогенезе коронавирусной инфекции COVID-19 одним из ведущих механизмов является дисфункция иммунного ответа на вирус SARS-CoV-2 с аберрантной цитокиновой регуляцией, дефицитом интерферонов при инициации заболевания и гиперпродукцией провоспалительных пептидов в острый период болезни [1, 2, 3]. Одним из определяющих характеристики и направления развития воспалительного ответа цитокинов является фактор некроза опухолей альфа (TNF-α). Последний участвует в регуляции продукции провоспалительных цитокинов, вызывает активацию иммунных клеток и фагоцитоз [4]. Функциональные полиморфизмы генотипов цитокинов выступают в качестве важных факторов, влияющих на выраженные индивидуальные различия иммунного ответа, восприимчивости и исходов вирусных инфекций, модулирующих тяжесть течения болезни [5, 6]. Эффекты фактора некроза опухолей альфа, продуцируемого во время острого воспаления, зависят от его уровня выработки в организме. В малых количествах, при показателях в пределах референтных интервалов, TNF-α оказывает защитное действие, активируя эндотелиальные клетки и лейкоциты, индуцируя синтез воспалительных цитокинов и рекрутирование иммунокомпетентных клеток, а гиперпродукция TNF-α инициирует системное воспаление и повреждение жизненно важных органов [3, 7].
В литературных источниках представлены разноречивые данные о встречаемости полиморфизмов генов, динамике продукции TNF-α и взаимосвязи с тяжестью патологического процесса при коронавирусной инфекции. Авторами работы были выявлены высокие уровни TNF-α в сыворотке крови у пациентов в острый период COVID-19 при тяжелом течении болезни [8]. Однако в работе иных авторов было отмечено, что в период разгара COVID-19 тяжелого клинического течения уровни провоспалительных цитокинов, включая фактор некроза опухоли альфа, остаются в пределах референсных значений [9]. C. Huang с соавторами и E. Mortaz с соавторами отмечают, что у пациентов тяжелое клиническое течение новой коронавирусной инфекции сопровождается гиперпродукцией TNF-α [5, 10].
Разнонаправленность и вариативность генотипов и продукции TNF-α при реализации коронавирусной инфекции COVID-19 различной тяжести заболевания, представленные в литературных источниках, определили актуальность и цель настоящего исследования.
Цель исследования оценка структуры, встречаемости полиморфизма генов фактора некроза опухолей альфа во взаимосвязи с содержанием цитокина в сыворотке крови у взрослых пациентов при коронавирусной инфекции COVID-19 различной тяжести клинического течения.
Материал и методы исследования. Группы наблюдения включали 59 взрослых пациентов с верифицированным диагнозом коронавирусной инфекции с разными степенью тяжести и объемом поражения легочной ткани и 94 здоровых донора без коронавирусной инфекции в анамнезе. Средней тяжести клиническое течение диагностировано у 28 человек, тяжелое – у 31 человека. В группе наблюдения по данным компьютерной томографии у 9 пациентов с новой коронавирусной инфекцией не зафиксировано поражения легочной ткани (КТ-0), у 17 – поражение легочной ткани не превышало 25% (КТ-1), у 20 человек достигало 50% (КТ-2),и у 13 человек – до 75% (КТ-3). Возрастной диапазон пациентов варьировал от 18 до 70 лет, среди них преобладали женщины (n=31). При проведении данного исследования всеми участниками были подписаны информированные согласия и соблюдались этические принципы Хельсинкской Декларации Всемирной Медицинской Ассоциации и Правил клинической практики в Российской Федерации, приказа Минздрава РФ № 266 от 19.06.2003 г.
В качестве материалов исследования для оценки параметров, согласно цели и задачам данной работы, применялись медицинская документация и различные биологические материалы. Сыворотку крови использовали при определении уровня антител IgG к антигену SARS-CoV-2 и содержания TNF-α, а с выделенной из лейкоцитов периферической венозной крови с помощью коммерческого набора реагентов ДНК-сорб-B («AmpliSens», Россия) геномной ДНК (гДНК) проводили молекулярно-генетический анализ.
Анализ антител IgG к антигену SARS-CoV-2 и содержания TNF-α проводили иммуноферментным твердофазным методом тест-системами и наборами реактивов ЗАО «Вектор-Бест» (г. Новосибирск). Содержание TNF-α учитывали в пикограммах в миллилитре (пг/мл) при пороге чувствительности 1 пг/мл.
Измеряя оптическую плотность ДНК-содержащих растворов при длине волны 260 и 280 нм против ТЕ на спектрофотометре NanoDrop 2000 (США), анализировали концентрацию и чистоту выделенной ДНК. Далее в аллель-специфичной ПЦР с использованием набора реагентов для АС-ПЦР методом «SNP экспресс» ЭФ (НПФ «Литех», Россия) проводили генотипирование образцов по мутациям 308 G/A в гене TNF-α (rs1800629) в промоторном регионе гена TNF-α rs1800629 308G/A в соответствии с инструкцией производителя. Продукты оценивали при помощи горизонтального гель-электрфореза в 3%-ном агарозном геле («Литех», Россия) с использованием электрофоретической камеры в ТАЕ буфере и визуализацией VersaDoc MP 4000 Imaging System («Bio-Rad», США) красителем – 1%-ным раствором бромистого этидия. Результаты анализа интерпретировали в трех вариантах: гетерозигота, гомозигота по аллели 1 или по аллели 2. Все исследования проводили согласно инструкциям производителей.
Цифровые данные статистически обрабатывали с использованием пакета программ Microsoft Exсel 2018 (Microsoft Inc., США) и STATISTICA 12. Используя критерии вариации Шапиро–Уилка, Колмогорова, Омега-квадрат, согласия Пирсона χ², оценивали нормальности распределения значений признака с дополнительной проверкой гипотезы нормальности распределения значений визуализировали по графику кривой Гаусса. Критерием существенного отклонения от нормального распределения считали значение р<0,05. Применяли методы параметрической статистики при коэффициенте вариации меньше 30% и непараметрической статистики при коэффициенте вариации больше 30%. При нормальном распределении значений дескриптивные статистики рассчитывали M±m (М – среднее, m – стандартная ошибка средней величины); при распределении, не соответствующем нормальному, рассчитывали Me (Нкв; Вкв) (Me – медиана, Нкв – нижний и Вкв – верхний квартили). При сравнении средних значений количественных признаков в нескольких группах применяли параметрический t-критерий Стьюдента или критерий Манна–Уитни. Статистически значимыми различия считали при уровне значимости 5% или p<0,05. При определении различий между несколькими группами применяли критерий Краскела–Уоллиса. При попарном сравнении групп при ненормальном распределении использовали критерий Манна–Уитни с поправкой Бонферрони и при нормальном распределении – критерий Стьюдента с поправкой Бонферрони. Используя равновесие Харди–Вайнберга, проводили оценку соответствия распределений генотипов ожидаемым значениям. В оценке развития событий рассчитывали коэффициент отношения шансов (ОШ) и доверительный интервал (ДИ 95%). Статистически значимость различий в распределении частот аллелей между группами выявляли, используя критерий χ2. Статистически значимыми считали различия при p<0,05. Проводили корреляционный анализ для выявления связи с использованием коэффициента корреляции Спирмена. Оценку интенсивности корреляционной связи проводили в соответствии со следующими значениями коэффициента корреляции r: от 0 до ±0,199 – очень слабая; от ±0,2 до ±0,499 – слабая; от ±0,5 до ±0,699 – средняя; от ±0,7 до ±0,899 – сильная; от ±0,9 до 1 – очень сильная. Критерий уровня статистической значимости (p) при проверке нулевых гипотез принимался равным 0,05.
Результаты исследования и их обсуждение. У пациентов с новой коронавирусной инфекцией при разных объемах поражения легких не было выявлено статистически значимых различий в уровнях титра IgG к антигену SARS-CoV-2, средние показатели которых составили 1:2000±1398,01 при отсутствии поражения легких КТ-0, 1:2576,47±1192,12 при степени поражения легких КТ-1, 1:3455±1128,8 при степени поражения легких КТ-2 и 1:3592,31±1477,28 при степени поражения легких КТ-3 соответственно при p>0,05.
У пациентов с COVID-19 при исследовании в сыворотке крови содержания TNF-α медианы с верхним и нижним квартилями составили 2,86 (2,56; 4,12) пг/мл и статистически значимо превышали таковые в группе здоровых доноров – 1,48 (1,33; 1,63) пг/мл соответственно при p<0,01. В данном исследовании сопоставление показателей содержания TNF-α в сыворотке крови пациентов с разной тяжестью течения болезни и различающимся объемом поражения легочной ткани определило достоверную разницу показателей. Так, у пациентов при тяжелом клиническом течении COVID-19 показатели медианы с верхними и нижними квартилями содержания TNF-α определены в пределах 3,57 (2,79; 5,26) пг/мл, а у пациентов со среднетяжелым клиническим течением болезни – 2,6 (2,37; 2,84) пг/мл соответственно при p<0,01. Высокие показатели содержание TNF-α в сыворотке крови у пациентов при тяжелом и среднетяжелом клиническом течении болезни статистически значимо отличались от данных здоровых доноров (p<0,01) и отражали аберрантную продукцию TNF-α, сопровождающую утяжеление течения патологического процесса. В подгруппе пациентов с верифицированным диагнозом коронавирусной инфекцией и отсутствием поражения легочной ткани (по данным компьютерной томографии) зафиксирован статистически значимо более низкий уровень TNF-α в сыворотке крови по сравнению с показателями у пациентов с поражением легочной ткани от пятидесяти и более процентов (КТ-2 и КТ-3 при p<0,05 и p<0,01 соответственно). У пациентов с COVID-19 и разной степенью поражения легочной ткани медианы с верхними и нижними квартилями содержания TNF-α в сыворотке крови составили при КТ-0, КТ-1, КТ-2 и КТ-3 – 2,6 (2,27; 2,66) пг/мл, 2,73 (2,4; 3,64) пг/мл, 3,47 (2,66; 4,84) пг/мл и 3,05 (2,53; 4,09) пг/мл соответственно.
У пациентов с коронавирусной инфекцией по сравнению с группой здоровых доноров было выявлено статистически значимое отличие структуры полиморфизма и частоты аллелей в промоторном регионе гена TNF-α rs1800629 308G/A. Зафиксированы достоверные различия встречаемости функционально неблагоприятной аллели А и дикой аллели G среди пациентов определены в 49,15% и 50,85% случаев против 16,49% и 83,51% у здоровых доноров соответственно при χ2=37,500 p<0,001. Полученные данные о распределении частот иллюстрируют, что шанс развития новой коронавирусной инфекции в 4,9 раза статистически значимо выше у пациентов при носительстве мутантной аллели А (ОШ (95 % ДИ) = 4,9 (2,88; 8,3)) (табл. 1).
Таблица 1
Встречаемость аллелей полиморфизма гена TNF-α у пациентов с новой коронавирусной инфекцией и здоровых доноров
|
Частота аллели |
Группы наблюдения |
|
|
Пациенты с новой коронавирусной инфекцией (n=59) |
Группа контроля (здоровые доноры) (n=94) |
|
|
G |
60 (50,85%) |
157 (83,51%) |
|
A |
58 (49,15%) |
31 (16,49%) |
|
ОШ (ДИ 95%) |
4,9 (2,88; 8,3) |
|
|
Критерий χ2 |
37,500 p<0,001 |
|
Среди пациентов с COVID-19 встречаемость гомозиготных генотипов G/G и A/A зафиксирована в 18,64% и 16,95% случаев соответственно, а гетерозиготного генотипа G/A – в 64,41% случаев. В то же время среди здоровых доноров частота определения генотипов была иной и составила: G/G – 67,02%, G/A – 32,98%, а носительства гомозиготного генотипа А/А в данной группе выявлено не было (рис. 1).
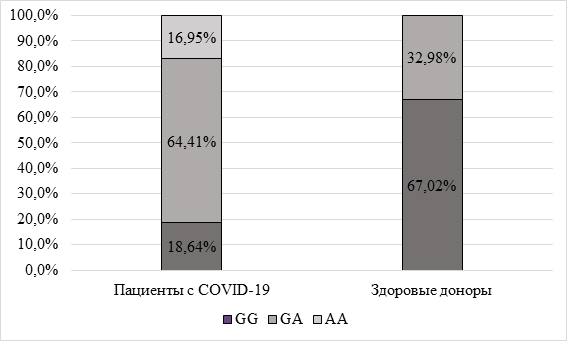
Рис. 1. Частота генотипов полиморфизма гена TNF-α 308 G/A среди пациентов с коронавирусной инфекцией и здоровых доноров
Проведенные исследования зафиксировали различия частоты наличия полиморфных вариантов гена TNF-α 308 G/A среди пациентов с разной тяжестью течения патологического процесса коронавирусной инфекции и такового в группе здоровых доноров. Встречаемость функционально неблагоприятной аллели А и дикой аллели G среди пациентов со среднетяжелым клиническим течением и здоровых доноров была равна 42,86% против 16,49% и 57,14% против 83,51% соответственно (χ2=17,181, p<0,001). При этом риск развития коронавирусной инфекции был в 3,8 раза статистически значимо выше при носительстве мутантной аллели А (ОШ (95 % ДИ) =3,8 (1,97; 7,31)). У пациентов с тяжелым клиническим течением болезни встречаемость мутантной аллели A была выше, чем у здоровых доноров, и составила 54,84% против 16,49%, а частота нормальной аллели G показала более низкие значения, чем у здоровых доноров (45,16% против 83,51%) (χ2=35,639, p<0,001). Шанс развития новой коронавирусной инфекции в 6,15 раза статистически значимо выше при носительстве мутантной аллели А (ОШ (95 % ДИ) = 6,15 (3,27; 11,56)). При анализе структуры распределения аллелей среди пациентов со среднетяжелым и тяжелым течением болезни не было выявлено статистически значимых различий (χ2=1,690, p>0,05). У пациентов со среднетяжелым клиническим течением новой коронавирусной инфекции гетерозиготный генотип G/A выявлен в 64,29% случаев, гомозиготный G/G и A/A – в 25% и в 10,71% соответственно. У пациентов с тяжелым клиническим течением болезни генотип G/A встречался в 64,52% случаев, генотипы A/A и G/G – в 22,58% и в 12,90% соответственно.
В ходе исследования было установлено, что среди пациентов с новой коронавирусной инфекцией с разным объемом поражения легочной ткани частота полиморфных вариантов гена TNF-α 308 G/A статистически значимо отличалась от встречаемости у здоровых доноров. Проведенные исследования зафиксировали наличие функционально неблагоприятной аллели А у 47,06%, 60% и 46,15% пациентов с различным объемом поражения легочной ткани при КТ-1, КТ-2 и КТ-3 соответственно, что статистически значимо превышает встречаемость у здоровых доноров. При этом дикая аллель G выявлена в 52,94% случаев у пациентов при коронавирусной инфекции с поражением легочной ткани КТ-1, в 40% – при КТ-2 и в 53,85% – при КТ-3, что статистически значимо реже, чем у здоровых доноров (χ2=16,122, p<0,001; χ2=34,11,p<0,001; χ2=12,519, p<0,001). Шанс развития новой коронавирусной инфекции при носительстве мутантной аллели А среди пациентов с КТ-1 в 4,5 раза, с КТ-2 в 3,92 раза и с КТ-3 в 4,34 раза статистически значимо выше (ОШ (95% ДИ)=4,5 (2,07; 9,78); ОШ (95% ДИ)=7,6 (3,62; 15,93); OШ (95% ДИ)=4,34 (1,83; 10,28)). Гетерозиготный генотип G/A встречался с частотой 66,66% у пациентов с КТ-0, 58,82% – с КТ-1, 70% – с КТ-2 и 61,54% – с КТ-3. Гомозиготный генотип G/G при КТ-0, КТ-1, КТ-2 и КТ-3 степенями поражения легких был отмечен у 33,33%, 23,53%, 5% и 23,08% пациентов соответственно. Не выявлен генотип А/А у пациентов с коронавирусной инфекцией с КТ-0 (отсутствовали данные поражения легочной ткани при КТ), в то же время отмечены различия встречаемости генотипа А/А среди пациентов с поражением легочной ткани: при КТ-1 – 17,65%, при КТ-2 – 25% и при КТ-3 – 15,38% соответственно.
Исследуемый полиморфизм rs1800629 гена TNF-α расположен в промоторном регионе. Нами была установлена значимая корреляционная связь вариантов генотипов и уровня продукции (содержания в сыворотке крови) TNF-α (p<0,01). При носительстве генотипа G/G у пациентов с новой коронавирусной инфекцией уровни TNF-α в сыворотке крови определены в пределах 2,27 (2,18; 2,44) пг/мл, которые были статистически значимо ниже показателей у носителей генотипов G/A и A/A (2,92 (2,61; 3,62) пг/мл и 9,26 (7,14; 11,74) пг/мл соответственно, при p<0,01). У пациентов при генотипе G/G и среднетяжелым клиническим течением болезни медианы с нижним и верхним квартилями содержания TNF-α в сыворотке крови составили 2,21 (2,11; 2,24) пг/мл и были статистически значимо ниже, чем у обладателей генотипов G/A и A/A с показателями 2,66 (2,6; 2,78) пг/мл и 6,4 (5,67; 10,05) пг/мл соответственно, (p<0,01).
Подобная тенденция отмечена и у пациентов с тяжелым течением. Уровень TNF-α у носителей гомозиготного генотипа G/G статистически значимо ниже, чем при гетерозиготном генотипе G/A и гомозиготном A/A (p<0,01). Медианы с нижним и верхним квартилями при данных генотипах определялись в диапазонах: 2,5 (2,45; 2,53) пг/мл, 3,38 (2,95; 4,10) пг/мл и 10,81 (7,64; 11,67) пг/мл соответственно
При исследовании структуры и распространенности полиморфизма гена TNF-α было выявлено преобладание носительства мутантной аллели А у пациентов с новой коронавирусной инфекцией. При этом у здоровых доноров чаще отмечались нормальные аллели G. При оценке влияния SNP на продукцию TNF-α было установлено, что наиболее высокие уровни сывороточного содержания данного цитокина наблюдались у пациентов при носительстве гомозиготного генотипа А/А, а более низкие – при гомозиготном генотипе G/G, что согласуется с исследованием A. Saleh с соавторами (2022) и свидетельствует о генетической детерминированности продукции TNF-α [6] и позволяет расценивать аллель А как дополнительный предиктор риска развития и тяжелого клинического течения новой коронавирусной инфекции.
Проведенные исследования зафиксировали при реализации коронавирусной инфекции COVID-19 генетически опосредованные нарушения в иммунном ответе с дисбалансом в системе цитокинов, гиперпродукцией TNF-α, что согласуется с исследованиями M. S. Diamond с соавторами (2022) [8]. Определены взаимосвязь носительства гомозиготного генотипа мутантной аллели А/А с высоким шансом реализации гиперпродукции фактора некроза опухолей альфа и достоверная прямая корреляция содержания данного цитокина – с тяжестью клинического течения патологического процесса при COVID-19, что позволяет рекомендовать данные показатели как дополнительные биомаркеры риска развития и тяжелого течения коронавирусной инфекции. Выявленные изменения в системе цитокинов согласуются с данными исследований C. Huang с соавторами (2020), E. Mortaz с соавторами (2021) и различаются с результатами F. Jia с соавторами (2021) [5, 9, 10].
Выводы. У пациентов с новой коронавирусной инфекцией выявлена аберрантная продукция TNF-α, нарастающая при утяжелении клинического течения заболевания с увеличением объема поражения легочной ткани.
По структуре и распространенности полиморфизма гена TNF-α у пациентов с новой коронавирусной инфекцией статистически значимо чаще определялись аллель А и генотип АА, реже – аллель G и генотип GG в сравнении со здоровыми донорами.
Выявлена взаимосвязь уровня TNF-α и тяжести клинического течения новой коронавирусной инфекции в зависимости от генотипа данного цитокина. Наиболее высокое содержание TNF-α и тяжелое течение болезни зафиксировано у пациентов с генотипом АА, у пациентов с генотипом GG уровень цитокина соответствовал границам здоровых доноров и отсутствовало поражение легочной ткани.
Заключение. По данным исследования структуры полиморфизма гена TNF-α среди пациентов с новой коронавирусной инфекцией выявлены высокая встречаемость мутантного аллеля А и низкая частота нормального аллеля G, зафиксирована значимая корреляция структуры генотипа с уровнем содержания TNF-α в сыворотке крови. Носительство аллели G сопровождалось наименьшим содержанием TNF-α в сыворотке крови, высокие показатели исследуемого в сыворотке крови цитокина были зафиксированы при носительстве гомозиготы А/А, у пациентов с гомозиготным генотипом G/G уровни TNF-α определялись в пределах референтных интервалов, что позволяет рекомендовать определение аллеля А в качестве биомаркера риска развития и тяжести течения патологического процесса при коронавирусной инфекции.
Библиографическая ссылка
Просекова Е.В., Долгополов М.С., Сабыныч В.А., Турянская А.И., Кондрашова Н.М. ПОЛИМОРФИЗМ ГЕНОВ И СОДЕРЖАНИЕ ФАКТОРА НЕКРОЗА ОПУХОЛЕЙ АЛЬФА В СЫВОРОТКЕ КРОВИ ПРИ РАЗЛИЧНОЙ ТЯЖЕСТИ КЛИНИЧЕСКОГО ТЕЧЕНИЯ КОРОНАВИРУСНОЙ ИНФЕКЦИИ, ВЫЗВАННОЙ COVID-19 // Современные проблемы науки и образования. 2024. № 5. ;URL: https://science-education.ru/ru/article/view?id=33655 (дата обращения: 25.02.2026).
DOI: https://doi.org/10.17513/spno.33655



