Введение. В настоящее время особое внимание привлекает проблема поиска предикторов инсульта, это связано с сохранением высоких показателей смертности и инвалидизации, несмотря на достижения в диагностике и лечении этого клинического синдрома [1]. В Российской Федерации выявляется около полумиллиона случаев инсульта в год, при этом ишемический инсульт (ИИ) встречается в 4 раза чаще, чем геморрагический [2]. При условии сохранения текущих тенденций уже к 2050 г. можно ожидать, что в мире будет не менее 200 млн пациентов с перенесенным инсультом [3]. Кроме того, учитывая высокую распространенность инсульта, тенденции к старению населения, крайне важно понимать, как можно повлиять на профилактику цереброваскулярной патологии и изменение демографической ситуации. Совершенствование методов оказания медицинской помощи при инсульте не может быть достигнуто без выяснения этиопатогенетических механизмов его развития. Выявление патофизиологических процессов, лежащих в основе возникновения острых цереброваскулярных событий, имеет ключевое значение для осуществления мероприятий, направленных на вторичную профилактику инсульта. В настоящее время с клинико-патогенетической позиции определяют следующие подтипы ИИ: атеротромботический, кардиоэмболический (КЭ), лакунарный, неопределенный [4, 5]. В связи с высокой распространенностью сердечно-сосудистой патологии особого внимания специалистов требуют особенности развития КЭ подтипа ИИ. Причины и источники эмболий при КЭ подтипе ИИ представлены различной сердечно-сосудистой патологией, прежде всего фибрилляцией предсердий и клапанными пороками [6]. Во многом предпосылкой к развитию некоторых из этих патологических состояний является эндотелиальная дисфункция (ЭД) [7]. Известно, что эндотелий сосудов выполняет важные функции, такие как: управление гемостазом, поддержание нормальной проницаемости сосудов, регуляция иммунологических реакций и пролиферации гладкомышечных клеток сосудов, контроль сосудистого тонуса [8]. При этом регуляция этих функций, прежде всего, связана с метаболизмом оксида азота (NO) и эндотелина-1 (Э-1) [9, 10, 11]. Нарушения, связанные с расстройством гомеостаза в эндотелии, называются «эндотелиальная дисфункция» (ЭД). Несмотря на определенные достижения в современной эндотелиологии при различной соматической патологии, в настоящее время недостаточно информации о роли изменений функций эндотелия при развитии КЭ подтипа ИИ.
Цель исследования. Выявить изменения уровней Э-1 и стабильных метаболитов оксида азота (NOx) и соотнести полученные результаты с выраженностью неврологической симптоматики у пациентов с КЭ подтипом ИИ.
Материалы и методы исследования
Для исследования были отобраны 33 пациента в остром периоде КЭ подтипа ИИ, которые находились на лечении в первичном сосудистом неврологическом отделении. При поступлении в стационар пациентам проводилось исследование согласно действующим стандартам и клиническим рекомендациям. КЭ подтип ИИ устанавливался согласно критериям международной классификации патогенетических подтипов ИИ (SSS-TOAST):
1) имеется источник эмболии из сердца с высоким или средним риском;
2) по данным нейровизуализации (КТ головного мозга или МРТ головного мозга) выявляется повреждение коры головного мозга, мозжечка или обнаруживается субкортикальный полушарный инфаркт более 1,5 см в диаметре;
3) имеются предшествующие транзиторные ишемические атаки (ТИА) или ИИ в более чем одном артериальном бассейне;
4) исключена потенциальная артерио-артериальная эмболия;
5) ИИ у пациентов со средним риском кардиальной эмболии при отсутствии других причин расценивался как кардиоэмболический патогенетический подтип [12].
В исследование не включали пациентов со следующими заболеваниями и состояниями: ТИА; внутричерепное кровоизлияние; геморрагическая трансформация ИИ; поздняя госпитализация пациента (более чем через 24 часа от начала развития симптоматики); применение тромболитической терапии; опухоли головного мозга; нейродегенеративные заболевания; инфаркт миокарда; тромбоэмболия легочной артерии; злокачественная артериальная гипертензия; декомпенсация соматической патологии; тяжелые формы гематологических, онкологических и эндокринных заболеваний, а также тяжелые психические расстройства; острые и хронические инфекционные болезни в стадии обострения, женщин до наступления менопаузы. От всех участников было получено письменное информированное согласие на проведение исследования. В контрольную группу включены 20 пациентов с хронической недостаточностью мозгового кровообращения без инсульта в анамнезе, сопоставимых по возрасту и половому составу. Неврологический статус оценивали в ходе клинического осмотра, степень неврологического дефицита определяли с помощью шкалы инсульта Национального института здоровья США (NIHSS). Неврологический статус оценивали при поступлении и на 2-е сутки госпитализации. С учетом выраженности неврологической симптоматики вся исследуемая группа больных была подразделена на три подгруппы. В подгруппу с легким неврологическим дефицитом вошли пациенты, имевшие от 3 до 7 баллов по шкале NIHSS; с умеренным – пациенты с 8–12 баллами по шкале NIHSS; с выраженным – пациенты с 13 и более баллами по шкале NIHSS. Для определения Э-1 в плазме крови у пациентов использовали набор для количественного определения эндотелина 1–21 в биологических жидкостях Endothelin 1–21 (RnD Systems) методом иммуноферментного анализа (ИФА)[13]. Для оценки уровня оксида азота (NO) использовали метод определения в плазме крови суммарной концентрации NOx – по реакции их восстановления в присутствии хлорида ванадия (VCl3) и реакции диазотирования сульфаниламида (с реактивом Грисса) при предварительном восстановлении нитрат-ионов в нитрит [14]. Для ограничения влияния поступления экзогенных нитратов с пищей всем пациентам предварительно назначалась низконитратная диета. Все полученные результаты были обработаны с помощью программы Microsoft Excel 2019. Данные представлены как средняя арифметическая величина и стандартная ошибка средней (M±m), со статистически значимыми различиями при p≤0,05.
Результаты исследования и их обсуждение
Основную группу составляли 23 мужчины и 10 женщин в возрасте от 40 до 79 лет, средний возраст составил 61±5,53 года. При анализе неврологического статуса пациентов с КЭ подтипом ИИ выявлено преобладание симптоматики со стороны пирамидной системы в виде центральных парезов и параличей, которые наблюдались у 25 пациентов. Расстройство речи в виде моторной, сенсорной или смешанной форм афазии и дизартрии обнаруживалось у 9 больных; бульбарный синдром – у 5 пациентов; псевдобульбарный синдром – у 4 пациентов; расстройство чувствительности в виде гемигипестезии или альтернирующей гемигипестезии – у 21 пациента; мозжечковая атаксия – у 4 пациентов; нарушение сознания в виде оглушения или сопора – у 3 пациентов; нарушения полей зрения в виде гомонимной гемианопсии – у 3 больных. Проведен анализ сердечно-сосудистых факторов риска, при этом выявлено, что наиболее часто встречалась артериальная гипертензия – у 28 пациентов, нестенозирующий атеросклероз – у 27 пациентов, фибрилляция предсердий – у 26 пациентов, митральный порок сердца – у 8 пациентов, кардиомиопатия – у 3 пациентов, аортальный стеноз – у 2 пациентов. Оценка выраженности неврологической симптоматики показала, что средний балл по шкале NIHSS в подгруппе с легким неврологическим дефицитом составил 5±0,47, в подгруппе с умеренным неврологическим дефицитом средний балл – 10,3±0,28, а в подгруппе с выраженной симптоматикой средний балл составил 17,5±042. В подгруппе с легким неврологическим дефицитом неврологический статус характеризовался наличием легкого гемипареза или монопареза и нарушения чувствительности в виде геми- или моноаналгезии, а также изолированной или сочетанной с другими расстройствами дизартрией. В подгруппе пациентов с умеренным неврологическим дефицитом неврологический статус характеризовался наличием симптоматики в виде различных сочетаний умеренного гемипареза, гемигипестезии, гемианопсии, афазии, дизартрии, атаксии, псевдобульбарного синдрома и геминеглекта. В подгруппе пациентов с выраженным неврологическим дефицитом выявлены грубые нарушения неврологического статуса в виде симптоматики глубокого гемипареза или гемиплегии, тотальной афазии, бульбарного синдрома, дезориентации в собственной личности и нарушения сознания. Кроме того, в подгруппе пациентов с выраженным неврологическим дефицитом определялось большее количество различных комбинаций сердечно-сосудистых факторов риска и ассоциированных клинических состояний по сравнению с подгруппами пациентов с легким и умеренным неврологическим дефицитом.
Результаты исследования показали, что при КЭ подтипе ИИ наблюдаются нарушения гомеостаза в эндотелии сосудов, характеризующиеся изменением уровня NOx. На рисунке1 представлены данные изменения уровня NOx у пациентов с КЭ подтипом ИИ с различной степенью выраженности неврологической симптоматики.
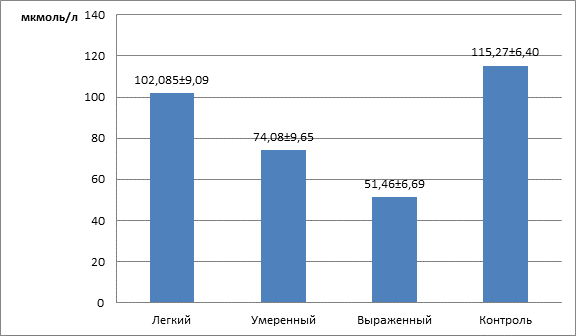
Рис. 1. Уровень NOx у пациентов с кардиоэмболическим подтипом ишемического инсульта в зависимости от степени выраженности неврологического дефицита
У пациентов с КЭ подтипом ИИ с легкой степенью неврологической симптоматики выявлялось статистически значимое по сравнению с контрольной группой снижение уровня NOx – на 11,4% (p=0,04), что свидетельствует о развитии эндотелиальной дисфункции в этой подгруппе. У пациентов с умеренным неврологическим дефицитом отмечалось более выраженное снижение уровня NOx – на 35,7% (p=0,036) – по сравнению с контрольной группой, что демонстрирует нарастание нарушений в метаболизме NO и усугубление дисрегуляции эндотелиальной функции в данной группе пациентов. Механизмы, связанные с расстройством управления сосудистым тонусом, лежащие в основе патогенеза ИИ, претерпевают существенные изменения. Так, у пациентов с тяжелым течением КЭ подтипа ИИ наблюдаются ограничения вазодилататорного потенциала эндотелия в поддержании церебрального кровотока. Это связано с дефицитом выработки NO в эндотелии, что подтверждается полученными результатами – более значительное падение уровня NOx (на 55,7% (p=0,0018)) по сравнению с контрольной группой. В целом дефицит выработки NO приводит к увеличению зоны недостаточной перфузии и нарастанию ишемического повреждения мозговой ткани. Одновременно с выявленным дефицитом вазодилататорного маркера ЭД у пациентов с КЭ подтипом ИИ обнаруживаются повышение в вазоконстрикторных реакциях, опосредованных увеличением синтеза Э-1, что способствует прогрессированию неврологической симптоматики и увеличению развившегося очага ишемии. На рисунке2 представлены изменения уровня Э-1 при кардиоэмболическом подтипе ИИ с различной степенью выраженности неврологического дефицита.
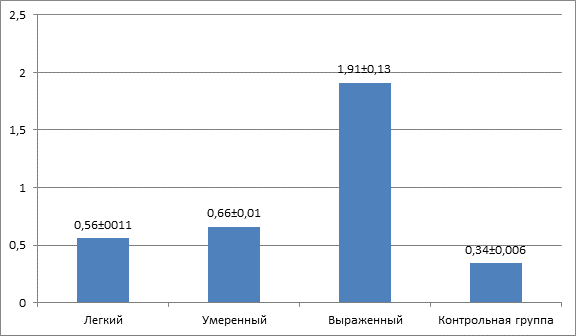
Рис. 2. Уровень Э-1 у пациентов с кардиоэмболическим подтипом ишемического инсульта в зависимости от степени выраженности неврологического дефицита
У пациентов с КЭ подтипом ИИ с легким неврологическим дефицитом выявлено статистически значимое повышение уровня Э-1 (на 64,7%) по сравнению с контрольной группой (p=0,027), свидетельствующее о наличии ангиоспастических реакций, которые ограничивают компенсаторные возможности ауторегуляции мозгового кровотока. В подгруппе пациентов с умеренным неврологическим дефицитом выявлено еще более статистически значимое повышение уровня Э-1 (на 94,1%), чем в контрольной группе (p=0,015), что отражается в расширении зоны ишемии и увеличении неврологического дефицита. Уровень Э-1 в подгруппе пациентов с КЭ инсультом с выраженным неврологическим дефицитом был более чем в 5,6 раза выше, чем в контрольной группе (p=0,039), что в конечном итоге приводит к развитию стойкого вазоспазма, повлекшего за собой нарастание неврологического дефицита. Все это свидетельствует, что при КЭ подтипе ИИ, помимо основного механизма развития ишемического повреждения в виде кардиоэмболии, возникают вазоконстрикторные реакции, которые способствуют расширению зоны ишемического повреждения и нарастанию выраженности неврологической симптоматики. Выявленные разнонаправленные изменения уровня маркеров ЭД в виде снижения уровня NOx и повышение Э-1 по мере нарастания неврологического дефицита демонстрируют развитие дисбаланса в регуляции сосудистого тонуса у пациентов в остром периоде ИИ КЭ подтипа. Обнаруженное при исследовании снижение уровня NO в крови способствует ограничению вазодилататорного потенциала мозговых сосудов, повышает миграцию и пролиферацию гладкомышечных клеток (ГМК) сосудов, ограничивает ангиогенез и способствует развитию атеросклероза в магистральных сосудах, как в головном мозге, так и в других органах, и, таким образом, потенцирует развитие церебральной ишемии. Повышение концентрации Э-1 в крови приводит к вазоконстрикции, усилению процессов митогенеза, пролиферации ГМК и фиброзу интимы, что вызывает стойкое ремоделирование церебральных артерий и таким способом способствует увеличению зоны ишемического поражения головного мозга и соответственно прогрессированию неврологической симптоматики у пациентов с КЭ подтипом ИИ.
Заключение. Авторами было обнаружено достоверное по сравнению с контрольной группой снижение стабильных метаболитов оксида азота, наиболее выраженное у пациентов с тяжелым неврологическим дефицитом, ограничивающее вазодилататорные реакции эндотелия. Было выявлено достоверное по сравнению с контрольной группой повышение уровня Э-1, более значимое при тяжелом течении КЭ подтипа ИИ, отражающее преобладание вазоконстрикторных реакций. Таким образом, развивающаяся ЭД играет ключевую роль в прогрессировании неврологической симптоматики при КЭ подтипе ИИ и является основополагающим механизмом формирования коморбидности сердечно-сосудистого континуума.
Библиографическая ссылка
Рябченко А.Ю., Долгов А.М., Денисов Е.Н. КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ БИОМАРКЕРОВ ЭНДОТЕЛИАЛЬНОЙ ДИСФУНКЦИИ ПРИ КАРДИОЭМБОЛИЧЕСКОМ ПОДТИПЕ ИШЕМИЧЕСКОГО ИНСУЛЬТА // Современные проблемы науки и образования. 2024. № 5. ;URL: https://science-education.ru/ru/article/view?id=33648 (дата обращения: 25.02.2026).
DOI: https://doi.org/10.17513/spno.33648



