Введение
Характерными чертами текущего Т2-воспаления дыхательных путей (ДП) при бронхиальной астме (БА) в настоящее время считаются уровни эозинофилов периферической крови (ЭОЗ) более 150 кл/мкл и/или мокроты 2% и более, повышение фракции оксида азота выдыхаемого воздуха (FeNO) выше 20 ppb и развитие клинически значимой гиперчувствительности к аллергенам (аллергии) [1, 2]. Измерение ЭОЗ крови является легко выполнимым в клинической практике. Их уровень коррелирует с тяжестью болезни, функцией легких, применяется при фенотипировании больных и определении ответа на лечение, в том числе препаратами генно-инженерной биологической терапии (ГИБТ). Однако существуют ограничения для использования этого маркера, прежде всего его низкая специфичность, так как ЭОЗ могут повышаться при паразитозах, аутоиммунных заболеваниях, новообразованиях и при других аллергических заболеваниях. Измерение FeNO представляет собой достаточно простой, быстровыполнимый, неинвазивный и при этом воспроизводимый метод, который отражает выраженность эозинофильного воспаления в ДП, стандартизованный для применения в лечении БА [2]. В практической работе FeNO, с одной стороны, позволяет оценить приверженность пациентов к терапии ингаляционными кортикостероидами (ИГКС), с другой – дает возможность выявить пациентов с рефрактерным к ИГКС воспалением в ДП и своевременно рассмотреть другой вид лечения, включая ГИБТ.
Уровни маркеров могут меняться с течением времени и от воздействия разных причин, в том числе применяемого лечения тяжелой БА (ТБА). Оценка динамики уровней ЭОЗ и FeNO при разных вариантах терапии ТБА представляется актуальной.
Цель исследования. Оценить динамику уровней маркеров Т2-воспаления (ЭОЗ крови, FeNO) при стандартном лечении и при дополнительном использовании ГИБТ у пациентов с ТБА.
Материал и методы исследования
В проспективное 5-летнее (с января 2017 г. по июнь 2022 г.) одноцентровое исследование были включены больные ТБА (n=129), распределенные в 2 группы (табл.). Пациенты первой группы (n=85) получали стандартную терапию: высокие дозы ИГКС / длительно действующие b2-адреноагонисты (ДДБА), у части больных применялись длительно действующие холинолитики, монтелукаст, системные глюкокортикоиды (СГКС). Во второй группе (44 пациента) применялась аналогичная стандартная терапия и дополнительно к ней – таргетные иммунобиологические препараты: анти-IgE (омализумаб, n=9), анти-интерлейкин (ИЛ)-5 (меполизумаб, n=8), анти-ИЛ-5-рецептор (бенрализумаб, n=11) и анти-ИЛ-4,13 (дупилумаб, n=16). Препараты моноклональных антител против основных цитокинов Т2-воспаления в течение 1–2 лет получали 13 пациентов с ТБА, у 31 больного срок лечения составил 2–5 лет. Протокол исследования получил одобрение локального Этического комитета СЗГМУ им. И.И. Мечникова. Пациентов включали в исследование после подписания информированного согласия. Атопический статус оценивали при помощи тестов уколом (размер волдыря более 3 мм) и/или уровня специфического IgE в сыворотке крови (более 0,35 КЕ/л; Phadia AB, Швеция) к основным ингаляционным аллергенам. Каждые 3–6 месяцев на автоматическом гемоанализаторе импедансным методом определяли количество ЭОЗ периферической крови, уровень FeNO оценивали на хемилюминесцентном газоанализаторе Logan-4100, Великобритания. Статистический анализ полученных данных осуществляли с применением стандартных параметрических и непараметрических методов. При сравнительном анализе групп для количественных данных использованы непараметрические критерии Манна–Уитни и χ2-тест для качественных данных. Различия считались статистически значимыми при p<0,05.
Результаты исследования и их обсуждение
В таблице представлена характеристика обследованных больных ТБА. Включенные пациенты переносили примерно 2 обострения тяжелой астмы за 12 предшествующих месяцев. Наличие атопического статуса подтверждено у 64% больных ТБА; наиболее частым аллергеном были клещи домашней пыли. У 70% пациентов с тяжелой астмой имелся сопутствующий АР, более половины (54%) страдали от хронического риносинусита (с полипами или без них). Исходно у пациентов с ТБА медиана ОФВ1 составила 52% от должного. У всех больных применялись высокие дозы ИГКС, 21% пациентов регулярно использовали пероральные СГКС. Получавшие дополнительную ГИБТ пациенты были моложе, имели худший контроль астмы, среди них чаще встречались астма с поздним дебютом и зависимость от СГКС; они применяли более высокую ежедневную дозу ИГКС, СГКС и чаще испытывали обострения ТБА за предшествующие 12 месяцев по сравнению с получавшими только стандартную терапию больными.
Характеристика пациентов с тяжелой бронхиальной астмой, включенных в 5-летнее исследование
|
Показатель |
Тяжелая БА (n=129) |
Группа 1 (n=85) (1) |
Группа 2 (n=44) (2) |
р1-2 |
|
Пол, мужчины/женщины, % |
29/71 |
28/72 |
32/68 |
0,742 |
|
Возраст, годы |
58 (48–64) |
59 (52–65) |
51 (44–60) |
0,006 |
|
Индекс массы тела, кг/м2 |
27,7 (24,7–31,8) |
28,1 (24,8–31,9) |
26,8 (22,8–31,6) |
0,251 |
|
Длительность астмы, годы |
13 (6–21) |
10 (4–20) |
14 (10–23) |
0,040 |
|
Фенотипы БА: Атопическая, n (%) Аспириновая, n (%) Гормонозависимая, n (%) С поздним дебютом (≥40 лет), n (%) С ожирением (ИМТ≥30 кг/м2), n (%) С фиксированной обструкцией, n (%) В сочетании с ХОБЛ, n (%) |
83 (64) 29 (22) 27 (21) 107 (83) 48 (37) 102 (79) 36 (28) |
56 (66) 20 (24) 12 (14) 75 (88) 34 (40) 68 (80) 26 (31) |
27 (61) 9 (21) 15 (34) 32 (73) 14 (32) 34 (77) 10 (23) |
0,676 0,776 0,008 0,032 0,373 0,803 0,468 |
|
Контроль астмы ACQ-5, средний балл |
2,75 (2,00–3,17) |
3,0 (2,33–3,60) |
2,43 (1,82–3,00) |
0,008 |
|
Качество жизни SGRQ, общий балл |
50 (35–62) |
41 (35–59) |
54 (40–67) |
0,109 |
|
ОФВ1, % должного |
52 (42–62) |
53 (43–63) |
50 (41–60) |
0,450 |
|
Число обострений астмы в течение предшествующего года, n |
2,0 (1,0–2,0) |
2,0 (1,0–2,0) |
2,0 (2,0–3,0) |
0,000 |
|
Число госпитализаций ввиду обострений БА в течение жизни, n (%) |
4,0 (1,0–8,0) |
3,0 (1,0–6,0) |
5,0 (2,0–10,0) |
0,006 |
|
Пациенты, госпитализированные в ОРИТ ввиду обострений БА в течение жизни, n (%) |
29 (22) От 1 до 7 ОРИТ |
26 (31) От 1 до 3 ОРИТ |
9 (20) От 1 до 7 ОРИТ |
0,836 |
|
Пациенты, интубированные по поводу обострений БА в течение жизни, n (%) |
9 (7) От 1 до 5 интубаций |
5 (6) От 1 до 2 интубаций |
4 (9) От 1 до 5 интубаций |
0,776 |
|
Курение в настоящее время, n (%) |
28 (22) |
21 (25) |
7 (16) |
0,502 |
|
Индекс курящего человека, пачко-годы |
25 (10–42) |
30 (14–45) |
21 (10–30) |
0,182 |
|
Пассивное курение, n (%) |
40 (31) |
27 (32) |
13 (30) |
0,728 |
|
Вредные условия на производстве, n (%) |
36 (28) |
28 (33) |
8 (18) |
0,180 |
|
Наличие животных дома, n (%) |
53 (41) |
37 (44) |
16 (36) |
0,553 |
|
Наличие плесневых грибов дома или на работе, n (%) |
6 (5) |
2 (2) |
4 (9) |
0,513 |
|
Аллергический ринит, n (%) |
94 (73) |
61 (72) |
33 (75) |
0,803 |
|
Хронический риносинусит без полипоза, n (%) |
37 (29) |
19 (22) |
18 (41) |
0,023 |
|
Хронический риносинусит с полипозом, n (%) |
32 (25) |
22 (26) |
10 (23) |
0,772 |
|
ИГКС, суточная доза, мкг* |
1264±46 |
1159±101 |
1466±42 |
0,020 |
|
СГКС, суточная доза, мг* |
14±2 |
13±2 |
15±3 |
0,016 |
|
Приверженность лечению, n (%) |
103 (80) |
65 (77) |
38 (86) |
0,301 |
Примечание: расшифровка использованных сокращений приведена в тексте
Количественные данные представлены в виде Me (Q1-Q3), где Me – медиана, Q1 – 25-й перцентиль, Q3 – 75-й перцентиль. Качественные переменные представлены в виде абсолютных и относительных частот (проценты).
*Дозы ИГКС представлены в микрограммах в пересчете на беклометазона дипропионат [1], СГКС – в пересчете на преднизолон (мг) и представлены в виде M±m
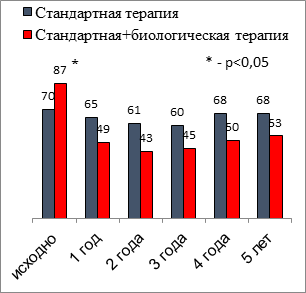
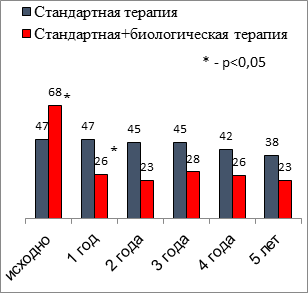
Информация о выраженности Т2-ответа важна для каждого конкретного пациента с ТБА, так как это в перспективе может помочь с выбором возможной биологической терапии (анти-IgE, анти-ИЛ-5 или анти-ИЛ-5-рецептор, анти-ИЛ-4/ИЛ-13 и другие препараты). Было получено, что у подавляющего числа (94%) больных ТБА, несмотря на проводимую терапию ИГКС, исходно имелись один или более критериев Т2-воспаления: в группе 1 – у 91%, в группе 2 – у 100%. Наиболее частым повышенным маркером были ЭОЗ более 150 кл/мкл. В ходе лечения доля пациентов с ТБА, имеющих повышенные маркеры Т2-воспаления, менялась незначительно в первой группе. Выраженное снижение ЭОЗ (р<0,001) и FeNO (р<0,001) было отмечено во второй группе в течение первого года использования препаратов ГИБТ, в последующем достигнутые уровни сохранялись (рис.). Абсолютные значения ЭОЗ периферической крови (медиана 231 кл/мкл и 336 кл/мкл, p<0,001) исходно были выше у пациентов, получавших биологическую терапию, в последующем различий между группами не выявлено. Значения FeNO пациентов первой и второй групп отличались исходно (18 ppb и 31ppb, p<0,05) и через 1 год (18 ppb и 13 ppb, p<0,05), далее значимых различий не отмечено [4].
|
Доля пациентов с ЭОЗ≥150 кл/мкл |
Доля пациентов с FeNO≥20 ppb |
|
|
|
Динамика маркеров Т2-воспаления у больных ТБА в течение 5 лет, %
ЭОЗ крови являются прогностическим фактором развития последующих обострений БА. Их уровень 400 кл/мкл и более повышает этот риск в 1,5 раза, а также значимо снижает вероятность достижения контроля [5, 6]. При ТБА эозинофилы крови более 300 кл/мкл служат диагностическим критерием ее эозинофильного фенотипа, который также характеризуется частыми (2 и более) обострениями в течение предшествующего года и зависимостью от СГКС [7]. Нередко такая астма дебютирует во взрослом возрасте, при ней может выявляться хронический риносинусит с полипозом носа или без него, отмечается повышение прочих маркеров эозинофильного воспаления (в том числе FeNO) и имеется фиксированная бронхиальная обструкция [7]. В международном руководстве GINA на основании полученных в клинических исследованиях (КИ) данных при ТБА высокие уровни ЭОЗ включены в показания к назначению таких препаратов биологической терапии, как меполизумаб, реслизумаб, бенрализумаб и дупилумаб, а также обозначены в качестве предикторов ответа на все зарегистрированные ГИБТ, включая тезепелумаб [1]. В то же время чувствительность ЭОЗ как маркера уменьшается в ходе лечения препаратами против ИЛ-5 или ИЛ-5-рецептора, так как в крови количество клеток выраженно снижается, но часть пациентов продолжают испытывать симптомы, что может потребовать изменения терапии, в том числе замены иммунобиологического препарата [8].
В ранее выполненных КИ была показана связь высокого значения FeNO (более 47 ppb) с хорошим клиническим ответом на ИГКС. В то же время повышенный FeNO представляет собой фактор риска развития последующих обострений астмы [8, 10]. В КИ и в условиях реальной практики более высокий FeNO был ассоциирован с высокой эффективностью омализумаба, дупилумаба и анти-ИЛ-5 препаратов [11, 12, 13]. В то же время есть работы, в которых результаты использования FeNO для подбора терапии БА противоречивы. Возможно, это было связано с высокой вариабельностью данного маркера и зависимостью от ряда факторов, таких как курение, перенесенные респираторные вирусные инфекции, использование ИГКС и др. ИГКС показаны всем пациентам с астмой независимо от высоких или низких значений ЭОЗ или FeNO. В то же время вероятность развития последующих обострений при использовании высоких доз ИГКС значимо снижается у пациентов, исходно имеющих более высокий FeNO и ЭОЗ [14]. В случаях, когда на фоне базисной терапии средними/высокими дозами ИГКС астма сохраняет неконтролируемое течение, выявляемые повышенные уровни ЭОЗ и FeNO связаны с более высоким риском тяжелых обострений и должны учитываться при выборе лечения.
В данной работе оценивать динамику уровней биологических маркеров, в частности ЭОЗ крови, в группе биологической терапии было затруднительно, поскольку препараты против ИЛ-5 и его рецепторов понижали уровень ЭОЗ, а препарат против ИЛ-4/ИЛ-13 в ряде случаев повышал. Среди 16 больных, в лечении которых использовался дупилумаб, в течение первых 3–6 месяцев терапии у 1 пациента уровень ЭОЗ превысил 2000 кл/мкл, у 1 больного был более 1500 кл/мкл и у 3 пациентов был выше 1000 кл/мкл. Данное повышение уровня ЭОЗ не сопровождалось новыми жалобами или симптомами, в последующем количество ЭОЗ постепенно понижалось, что согласуется с данными, полученными в РКИ. Представлялось интересным оценить частоту развития деплеции ЭОЗ (менее 50 кл/мкл), характерную для бенрализумаба. В течение первых 3–6 месяцев уровень ЭОЗ менее 50 кл/мкл был отмечен у 7 пациентов (64%) из 11 получавших данный препарат, у остальных уровень ЭОЗ также понижался, но сохранялся выше 50 кл/мкл. Признанным маркером Т2-воспаления является гиперчувствительность к ингаляционным аллергенам. Авторами ранее было показано, что у подавляющего большинства (81%) пациентов с ТБА на протяжении 5 лет атопический статус выявлялся стабильно, особенно у имевших сопутствующий аллергический ринит и сенсибилизацию к круглогодичным аллергенам [15]. В целом, на фоне проводимой ГИБТ уровни ЭОЗ и FeNO быстро понижались и оставались стабильно невысокими в течение времени применения биологических препаратов, а при использовании только стандартной терапии маркеры менялись медленно и, как правило, незначительно.
В течение 5 лет лечения и наблюдения количество ежегодных обострений ТБА уменьшилось в обеих группах, и через 5 лет доля больных без обострений составила 22% в первой группе и 41% – во второй (р<0,05). При использовании ГИБТ отмечены также выраженное улучшение контроля, качества жизни, показателей функции легких и снижение суточной дозы СГКС у гормонозависимых пациентов по сравнению с пациентами, получавшими только стандартную терапию [4].
Заключение. У подавляющей части больных тяжелой астмой определялись повышенные маркеры Т2-воспаления. Во время длительного лечения доля больных ТБА с повышенными биомаркерами Т2-воспаления среди получавших только стандартную терапию менялась незначительно. Выраженное стабильное снижение уровней маркеров было отмечено в группе больных с дополнительной таргетной биологической терапией. Положительная динамика изученных маркеров в большинстве случаев была ассоциирована с улучшением клинического течения ТБА.
Библиографическая ссылка
Емельянов А.В., Сергеева Г.Р. ДИНАМИКА МАРКЕРОВ Т2-ВОСПАЛЕНИЯ В ПРОЦЕССЕ ЛЕЧЕНИЯ У БОЛЬНЫХ ТЯЖЕЛОЙ БРОНХИАЛЬНОЙ АСТМОЙ // Современные проблемы науки и образования. 2024. № 4. ;URL: https://science-education.ru/ru/article/view?id=33636 (дата обращения: 16.01.2026).
DOI: https://doi.org/10.17513/spno.33636