Рак щитовидной железы (ЩЖ) составляет около 1% от всех злокачественных новообразований, но среди онкологической эндокринной патологии занимает первое место по распространенности с частотой более 90% [1]. Известными факторами риска развития рака ЩЖ являются ионизирующее излучение, дефицит или избыток йода, высокие уровни тиреотропного гормона и генетическая предрасположенность [2]. Причинами трансформации эпителиальных клеток ЩЖ в опухолевые являются изменения в генах, кодирующих клеточные сигнальные пути, приводящие к дисбалансу между клеточной пролиферацией и апоптозом [3, 4]. Ультразвуковое исследование, тонкоигольная аспирационная биопсия (ТАБ) с цитологией, гистопатологическое исследование ткани ЩЖ и лабораторные тесты с определением концентрации тиреоглобулина и кальцитонина являются основными диагностическими инструментами при выявлении рака ЩЖ [5, 6]. Молекулярно-генетическое тестирование аспирата, полученного при ТАБ, становится все более распространенным в лечебно-профилактических учреждениях [7]. Специфичные мутации характерны для определенных типов карцином [8]. Их выявление способствует диагностике рака ЩЖ в предоперационном периоде, что особенно важно для уточнения диагноза при цитологических неопределенных результатах (категории по системе Bethesda III–V) [9]. Таким образом, выявление генетических изменений становится диагностическим и прогностическим инструментом, а также фактом, определяющим объем хирургического и нехирургического лечения. Однако для большинства генетических изменений не установлены четкие алгоритмы действий после их выявления. Кроме того, этапность и продолжительность наблюдения при отрицательных результатах мутационного скрининга также четко не обозначены. Стоит ли углубить молекулярно-генетическое или лабораторное исследование при мутационно-негативных узлах ЩЖ? Чтобы ответить на этот вопрос, проводят многочисленные исследования по изучению экспрессии тканевых микроРНК (миРНК) [10, 11], циркулирующих миРНК [12], белков и других маркеров в различных биологических средах на предоперационном этапе [13].
Целью работы явилось определить оптимальную и эффективную комбинацию лабораторных тестов для углубления молекулярно-генетического исследования в трудных диагностических условиях и выявления рака ЩЖ на предоперационном этапе.
Материалы и методы исследования
Исследование было разделено на два этапа. На начальном этапе формировали диспансерную группу из пациентов с узловыми образованиями ЩЖ, сопоставляли результаты цитологического и гистологического исследований. Из диспансерной группы отбирали пациентов в клиническую группу с трудными условиями для постановки диагноза рака ЩЖ.
Критерии включения пациентов в диспансерную группу:
- пациенты с узловыми образованиями ЩЖ по итогам ультразвукового исследования категории TI-RADS 3-5;
- проведение ТАБ узла ЩЖ с формированием цитологического заключения по системе Bethesda;
- гистологическое исследование операционных образцов при хирургическом лечении заболевания;
- проведение молекулярно-генетического исследования на онкогенные мутации при Bethesda III–V.
Критерии включения пациентов в клиническую группу из диспансерной:
- категория узлов ЩЖ по результатам ультразвукового исследования TI-RADS 3–4;
- класс цитологического заключения по Bethesda III–V;
- проведение генетического исследования на выявление точечных мутаций в генах BRAF, RAS, TERT, RET и TP53, а также транслокаций в генах RET/PTC, PAX8/PPAR-γ и NTRK;
- наличие гистологического исследования операционных образцов как золотого стандарта диагностики.
Критерии исключения пациентов:
- декомпенсация тяжелых соматических заболеваний с формированием сердечно-легочной, печеночной или хронической почечной недостаточности;
- онкологические заболевания иной локализации.
Все больные подписывали добровольное информированное согласие для участия в исследовании. Исследование одобрено Локальным этическим комитетом ФГБОУ «Ростовский государственный медицинский университет» Минздрава России.
Диспансерная группа включала 477 больных с узловыми образованиями ЩЖ после ультразвукового исследования (категория TI-RADS 3 (n=81) и 4–5 (n=396)). Всем 477 больным проводили ТАБ с цитологией. У 339 больных после ТАБ выявлена клиническая ситуация с ясным заключением: категория II по Bethesda (n=252) и категория VI (n=85). У пациентов с заключением Bethesda II (доброкачественное образование) хирургическое удаление доли железы осуществлялось только у 13 человек, а у 239 отсутствовало. Таким образом, гистологическое исследование операционных образцов осуществлялось у 238 больных. У этих больных сопоставляли результаты цитологического и гистологического исследований, рассчитывали риск выявления злокачественного образования для каждого класса по Bethesda. Использовали 5-е издание гистологической классификации опухолей ЩЖ, рекомендованное ВОЗ (2022) [14], и пересмотренную классификацию цитологических заключений по Bethesda (2017) [15].
Клиническая группа включала 138 больных с узлами ЩЖ категории TI-RADS 3–4 после УЗИ, неопределенной цитологией – III–V класс по Bethesda (III–IV (n=124) и V (n=14)). Всем 138 больным проводили развернутое молекулярно-генетическое исследование онкогенных мутаций в цитологическом материале. У 55 больных мутации обнаружены, у 83 больных – нет.
Для оптимизации дооперационной диагностики злокачественных заболеваний ЩЖ в трудных диагностических ситуациях у 138 больных клинической группы в клетках узловых образований ЩЖ, полученных при ТАБ, методом ПЦР в режиме реального времени определяли экспрессионную активность миРНК-146b, -455-3р, -221, -574-3р, -885-5р относительно референсной молекулы миРНК-7a с помощью термоциклера LightCycler 480 (Roche Diagnostics, Германия) и набора специфических праймеров (ООО «Альгимед-Техно, Беларусь). Кроме того, в смыве аспирата из иглы измеряли концентрацию белков фибронектина 1 и секретируемого белка 1 SFRP1 (Secreted frizzled-related protein 1) посредством иммуноферментного анализа, диагностических наборов Fibronectin ELISA Kit (Technoclone, США) Human Secreted Frizzled-Related Protein 1 (SFRP1) ELISA Kit (Cloud-Clone Corp., США).
В клинической группе рассчитывали абсолютный и относительный риск выявления злокачественного образования для III–IV класса по Bethesda с учетом результатов основного и дополнительного молекулярно-генетического исследований.
С помощью статистического метода «Деревья решений» одноименного модуля программы STATISTICA 12 (StatSoft, США) выявляли аналитические зависимости между показателями и формировали диагностические правила по комбинации лабораторных тестов для классификации пациентов клинической группы в зависимости от риска злокачественного происхождения узлов ЩЖ.
Результаты исследования и их обсуждение
Сопоставление цитологического заключения после ТАБ железы, выполненное на дооперационном этапе, и гистологического заключения операционных образцов в диспансерной группе отражено в таблице 1.
Таблица 1
Сопоставление цитологического заключения после ТАБ и гистологического заключения операционных образцов при диагностике опухолей ЩЖ (n (%)) в диспансерной группе
|
Bethesda (ТАБ) |
Гистологическое заключение |
Всего |
|||||||
|
ДО 8330/0 |
WDT UMP 8348/1 |
НФО ЯПТ 8349/1 |
ИИПКФС 8343/3 |
ПК 8260/3 |
ФК 8330/3 |
ОК 8290/3 |
МК 8345/3 |
||
|
I |
– |
1 (0,4) |
1 (0,4) |
– |
– |
– |
– |
– |
2 (0,8) |
|
II |
– |
1 (0,4) |
11 (4,6) |
– |
– |
– |
1 (0,4) |
– |
13 (5,5) |
|
III |
34 (14,3) |
– |
– |
3 (1,3) |
17 (7,1) |
– |
– |
2 (0,8) |
56 (23,5) |
|
IV |
41 (17,2) |
– |
– |
9 (3,8) |
12 (5,0) |
6 (2,5) |
– |
– |
68 (28,6) |
|
V |
– |
– |
– |
– |
3 (1,3) |
7 (2,9) |
– |
4 (1,7) |
14 (5,9) |
|
VI |
– |
– |
2 (0,8) |
5 (2,1) |
58 (24,4) |
14 (5,9) |
1 (0,4) |
5 (2,1) |
85 (35,7) |
|
Всего |
75 (31,5) |
2 (0,8) |
14 (5,9) |
17 (7,1) |
90 (37,8) |
27 (11,3) |
2 (0,8) |
11 (4,6) |
238 (100) |
Примечание: ДО – доброкачественные опухоли, WDT UMP – опухоли неясного злокачественного потенциала, НФО ЯПТ – неинвазивная фолликулярная опухоль с ядрами папиллярного типа, ИИПК ФС – инвазивная инкапсулированная папиллярная карцинома фолликулярного строения, ПК – папиллярная карцинома, ФК – фолликулярная карцинома, ОК – онкоцитарная карцинома, МК – медуллярная карцинома. Классы по Bethesda: I – неинформативный материал, II – доброкачественный узел, III – атипия неясного значения / фолликулярное поражение неясного значения, IV – фолликулярная опухоль / подозрение на фолликулярную опухоль, V – подозрение на злокачественное новообразование, VI – злокачественное новообразование.
Как известно, цитологические заключения аспирата, полученные после тонкоигольной биопсии, по системе Bethesda ранжируются с помощью шести диагностических категорий [15]. Цитологическое заключение на дооперационном этапе позволяет уверенно сформировать прогноз заболевания и выработать тактику лечения только при II и VI классах по Bethesda. При III–V классах по Bethesda в соответствии с рекомендациями Американской ассоциации щитовидной железы начиная с 2015 года рекомендовано проведение молекулярно-генетического исследования на предмет выявления онкогенных мутаций. Выявление мутаций в генах TERTp, BRAF и RAS (NRAS, HRAS и KRAS) свидетельствует в пользу опухолевой природы узла. Отрицательный результат является основанием для рекомендации динамического наблюдения с повторным проведением ТАБ.
В соответствии с классификацией Bethesda среди 477 пациентов цитологические заключения были распределены следующим образом: I – 2 (0,4%), II – 252 (52,8%), III – 56 (11,7%), IV – 68 (14,3%), V – 14 (2,9%), VI – 85 (17,8%). II класс Bethesda был установлен у 252 пациентов, но только 13 из них были прооперированы. Поэтому в таблице 1 сопоставление с гистологическим исследованием, осуществляемым после операции, осуществлено для общего количества прооперированных больных – 238 человек. Неопределенные результаты цитологии в диспансерной группе (Bethesda III–V) встречались у 138 (28,9%) больных.
Риск выявления злокачественного поражения ЩЖ при Bethesda III составлял 39,3%, при Bethesda IV – 39,7%, а при Bethesda V – 100%. Риск выявления злокачественного поражения ЩЖ после цитологии и выявления онкогенных мутаций повышался при Bethesda III до 60%, при Bethesda IV – до 73,1% и при Bethesda V составлял 100%.
На следующем этапе у пациентов клинической группы как с положительными, так и с отрицательными результатами стандартного генетического тестирования в клетках, полученных при ТАБ, определяли экспрессию миРНК-146b, -455-3р, -221, -574-3р, -885-5р и в смыве аспирата из иглы измеряли концентрацию белков фибронектина 1 и SFRP1. Информативность определения данных молекулярных маркеров по отдельности была доказана в предыдущих наших исследованиях [16, 17]. В таблице 2 отражены параметры экспрессии миРНК и концентрации белков в аспирате у пациентов с доброкачественными (n=75) и злокачественными образованиями ЩЖ (n=63).
Таблица 2
Параметры экспрессии миРНК и концентрации белков в аспирате у пациентов с доброкачественными (ДО) (n=75) и злокачественными образованиями (ЗО) ЩЖ (n=63)
|
Показатель |
Величина |
Пациенты с ДО |
Пациенты со ЗО |
р |
|
Е миРНК146b |
Me |
0,82 |
9,56 |
<0,001 |
|
[25–75] |
0,72–0,91 |
8,54–10,16 |
||
|
Е миРНК574-3р |
Me |
1,32 |
0,16 |
<0,001 |
|
[25–75] |
1,05–1,7 |
0,14–0,2 |
||
|
Е миРНК221 |
Me |
1,47 |
11,35 |
<0,001 |
|
[25–75] |
1,26–1,73 |
10,38–12,09 |
||
|
Е миРНК455-3р |
Me |
1,17 |
0,47 |
<0,001 |
|
[25–75] |
0,98–1,36 |
0,42–0,64 |
||
|
Е миРНК885-5р |
Me |
1,32 |
22,87 |
<0,001 |
|
[25–75] |
1,16–1,48 |
20,74–23,44 |
||
|
Фибронектин1 (FN1), нг/мл |
Me |
33,8 |
92,9 |
<0,001 |
|
[25–75] |
21,4–50,5 |
74,1–115,4 |
||
|
SFRP1, пг/мл |
Me |
111,7 |
72,1 |
<0,001 |
|
[25–75] |
91,4–133,6 |
45,3–93,5 |
Экспрессия миРНК-146b, -221 и -885-5р в клетках узловых образований ЩЖ при злокачественных опухолях ЩЖ, а также концентрация фибронектина 1 в аспирате были статистически значимо выше (p<0,001), а экспрессия миРНК-455-3р, -574-3р и концентрация SFRP1 – ниже (p<0,001) по сравнению с пациентами с доброкачественными образованиями железы.
С помощью метода построения деревьев классификации были отобраны наиболее информативные маркеры и определены их пороговые уровни для формирования заключения о высоком риске злокачественного поражения ЩЖ. Комплекс наиболее значимых по диагностической информативности факторов, на основе которого построено классификационное дерево, включал уровень экспрессии в клетках аспирата миРНК-146b, -574-3р, -221, -455-3р, а также содержание фибронектина 1 в смыве иглы после ТАБ. Кроме того, были разработаны диагностические правила, согласно которым при оценке предикторов в нужной последовательности и комбинации факторов поэтапно возрастал риск выявления рака ЩЖ при предоперационном обследовании.
По итогам многомерного статистического анализа результатов система оптимизации дооперационной диагностики злокачественных заболеваний ЩЖ включала три диагностических решения.
Если экспрессия миРНК-146b≥1,17 и экспрессия миРНК-574-3р£0,26, и концентрация FN1≥57,4 нг/мл
или
если экспрессия миРНК-146b ≥1,17 и экспрессия миРНК-574-3р£0,26, и концентрация FN1<57,4 нг/мл, и экспрессия миРНК-221≥2,06, и экспрессия миРНК-455-3р£0,74, то прогнозируем высокий риск злокачественного поражения железы.
Если экспрессия миРНК-146b<1,17 и экспрессия миРНК-574-3р>0,26, и концентрация FN1<57,4 нг/мл, и экспрессия миРНК-221<2,06, и экспрессия миРНК-455-3р>0,74, то прогнозируем низкий риск злокачественного поражения железы.
Граф диагностического дерева представлен на рисунке.
Риск выявления злокачественного поражения ЩЖ после ТАБ, молекулярно-генетического исследования и дополнительного лабораторного обследования с применением диагностического дерева решений при Bethesda III составлял 73,3%, при Bethesda IV – 88,5% и при Bethesda V – 100%.
Выявление онкогенных мутаций при Bethesda III сопровождалось повышением риска выявления злокачественного поражения ЩЖ в 1,95 раза (р=0,003), а при Bethesda IV – в 4,1 раза (p<0,001). По итогам дополнительного молекулярного исследования и применения разработанных диагностических правил на фоне положительных результатов мутационного скрининга наблюдалось повышение риска выявления злокачественного поражения ЩЖ при Bethesda III в 4,2 раза (p<0,001), а при Bethesda IV – в 11,7 раза (p<0,001). При мутационно- негативных узлах после дополнительного лабораторного исследования число ложноположительных случаев снизилось при Bethesda III с 17,6% до 11,8% (р=0,061), а при Bethesda IV – с 17,1% до 7,3% (р=0,037).
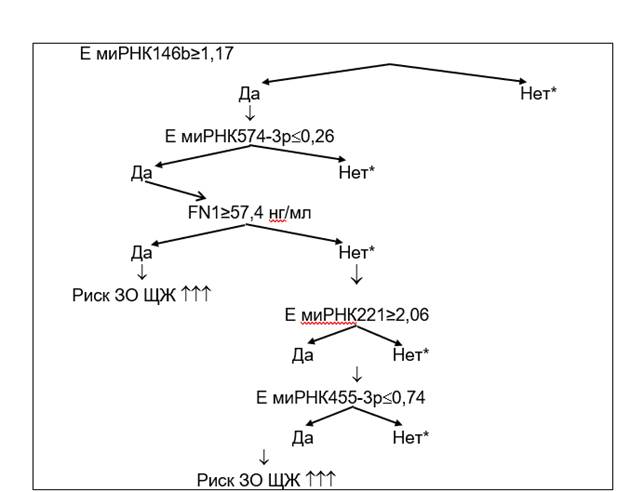
Граф диагностического дерева, позволяющего сформировать заключение о высоком риске выявления злокачественного образования (ЗО) ЩЖ по итогам дополнительного молекулярного исследования на дооперационном этапе. * – ветви диагностического дерева, соответствующие низкому риску. FN1 – фибронектин 1
Таким образом, дополнительное молекулярное исследование экспрессии миРНК в клетках узловых образований ЩЖ и концентрации биомаркера в аспирате после цитологического и ультразвукового обследования с применением разработанной прогностической шкалы позволяет повысить эффективность дооперационного обследования при неопределенных результатах ТАБ как при положительных, так и при отрицательных результатах мутационного скрининга.
Выводы
1. При неопределенных результатах цитологического, ультразвукового исследования узловых образований ЩЖ, отрицательных результатах мутационного скрининга рекомендуется провести оценку экспрессии миРНК-146b, -574-3р, -221, -455-3р, концентрации фибронектина 1 в аспирате, полученном при тонкоигольной биопсии, и по разработанным диагностическим правилам определить риск выявления злокачественного образования.
2. Предложенная оптимизация молекулярно-генетического исследования позволяет на предоперационном этапе повысить эффективность диагностики злокачественного образования ЩЖ как при положительных, так и при отрицательных результатах мутационного скрининга.
Библиографическая ссылка
Альникин А.Б. КОМБИНИРОВАННАЯ ОЦЕНКА ПРОГНОСТИЧЕСКИХ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИХ МАРКЕРОВ РАННЕГО ВЫЯВЛЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОБРАЗОВАНИЙ ЩИТОВИДНОЙ ЖЕЛЕЗЫ В ТРУДНЫХ ДИАГНОСТИЧЕСКИХ УСЛОВИЯХ // Современные проблемы науки и образования. 2024. № 4. ;URL: https://science-education.ru/ru/article/view?id=33615 (дата обращения: 20.02.2026).
DOI: https://doi.org/10.17513/spno.33615



