Введение
Растущий детский организм сталкивается с возникновением ряда проблем, например с развитием деформации позвоночника, что оказывает многообразное влияние на состояние практически всех органов и систем [Ошибка! Источник ссылки не найден.], в том числе и на взаимоотношение вегетативной и сенсомоторной нервной системы. В отдельности состояние сенсомоторной и вегетативной нервной системы в условиях деформации осевого скелета неплохо изучены. Но характер их взаимодействия остаётся за рамками внимания врачей и исследователей ввиду ряда методологических сложностей. Однако данная физиологическая проблема становится крайне важной в случае возникновения комплексных послеоперационных неврологических осложнений в результате хирургической коррекции деформации позвоночника [Ошибка! Источник ссылки не найден.-Ошибка! Источник ссылки не найден.]. Соответствующая информация может быть весьма полезной для проведения эффективных реабилитационных мероприятий. В качестве основы клинической модели изучения вегетосоматических отношений может быть использовано хорошо изученное взаимодействие систем терморецепции и тонической регуляции мышечной активности в рамках общей терморегуляции [5-6]. Установочный уровень активности терморегуляторной системы отражается в порогах восприятия тепла и боли от горячего, которые можно оценить методом эстезиометрии [7]. Однако прямое сопоставление данных эстезиометрии и тонической активности мышц пациентов со сколиозом затруднено тем, что в послеоперационном периоде тоническая активность мышц во многом определяется последствиями перенесённой анестезии. В связи с этим мы сопоставляли пороги восприятия тепла с амплитудой электрической активности мышцы при максимальном произвольном напряжении при условии, что её спинальный моторный центр локализован в том же сегменте, что и соответствующее рецептивное поле.
Целью исследования было выявление характера влияния состояния вегетативной нервной системы на функцию спинальных моторных центров в условиях оперативной коррекции деформации позвоночника.
Материалы и методы исследования
Исследование выполнено на 87 больных (30 мужского, 57 женского пола), в возрасте 6-43 лет (15,6±0,6 года) с деформациями позвоночника (20-105° по сколиотическому и 15-134° - по кифотическому компоненту) различной этиологии до и после их оперативной коррекции. Методом эстезиометрии [7] регистрировали пороги ощущения тепла кожного дерматома, иннервируемого спинальными корешками L5. Пациенты распределялись на две группы сравнения: 1) с нарушенным восприятием тепла (NO), когда тепловые пороги зарегистрировать не удалось; 2) с сохранённым восприятием тепла (YES), когда тепловые пороги регистрируются с помощью эстезиометрии.
Методом электромиографии (ЭМГ) получали электрическую активность m. tibialis anterior при её максимальном произвольном напряжении. Из анализа исключались записи ЭМГ с паттернами ненасыщенной активности, в которых колебания биопотенциалов чередовались с периодами молчания разной длительности.
Для групп сравнения (NO) и (YES) строились скатерограммы, так что ось абсцисс была шкалой частоты ЭМГ, а по оси ординат откладывалась её амплитуда. Оценивалось совпадение/расхождение территорий, занимаемых множеством наблюдений сравниваемых групп. С помощью средств аппроксимации Excel2010 выбиралось уравнение с максимальным значением коэффициента детерминации (R2). Обследования проводились до и через две недели после хирургической коррекции деформации позвоночника.
Локальный этический комитет ФГБУ «НМИЦ травматологии и ортопедии имени академика Г.А. Илизарова» Министерства здравоохранения Российской Федерации одобрил данное исследование (протокол № 2(70) от 21.10.2021). Его выполнение соответствует этическим стандартам, которые изложены в Хельсинкской декларации с последующими изменениями. Совершеннолетние пациенты, родители детей или их законные представители дали письменное информированное добровольное согласие на проведение диагностических исследований и публикацию полученных данных без идентификации личности.
Результаты исследования и их обсуждение
В виде скатерограммы (рис. 1) представлено распределение значений амплитуды ЭМГ при максимальном произвольном напряжении передней большеберцовой мышцы в зависимости от частоты колебаний биопотенциалов в группе с нарушенным (NO) и ненарушенным (YES) восприятием тепла для кожного рецептивного поля, иннервационно связанного со спинальным сегментом L5.
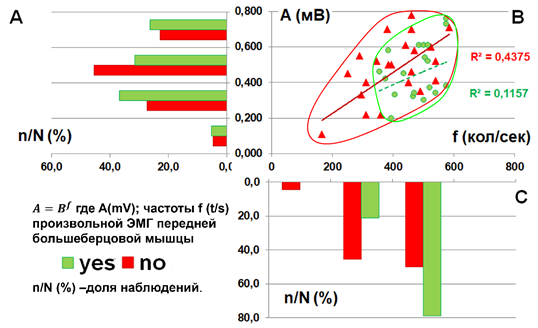
Рис. 1. Характер взаимосвязи амплитуды A(мВ) и частоты f (кол./сек.) произвольной ЭМГ передней большеберцовой мышцы в зависимости от наличия (YES) или отсутствия (NO) порогов ощущения тепла рецептивного поля спинального сегмента L5. Статистическое распределение значений (А) амплитуды, (C) – частоты колебаний ЭМГ. N – общее количество наблюдений, n – количество наблюдений в i-том заданном диапазоне; n/N (%) –доля наблюдений
При этом множество точек «YES» полностью находится внутри территории, занимаемой множеством точек «NO» (рис. 1B), занимая центральную и правую часть диаграммы (области средних и высоких значений амплитудно-частотного диапазона ЭМГ). Для подгруппы NO количество наблюдений между средними и высокими частотами распределяется более равномерно, чем для подгруппы YES (рис. 1C). В последнем случае преобладает высокочастотная ЭМГ. Значения амплитуды ЭМГ (рис. 1A) для сравниваемых групп распределяются сходным образом с максимумами в области средних значений, однако на фоне нарушения восприятия тепла максимум распределения амплитуд более выражен, чем в группе YES.
Из набора аппроксимационных уравнений Excel-10 максимальный коэффициент детерминации R2 соответствует степенной функции 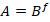 ; где A – амплитуда ЭМГ, B – некоторый эмпирический коэффициент связи, f – частота колебаний ЭМГ. Однако, судя по значениям R2, для подгруппы NO (рис. 1) он достигает лишь пограничного уровня, между плохой и приемлемой аппроксимацией. Для подгруппы YES связь между параметрами «A» и «f» практически отсутствует.
; где A – амплитуда ЭМГ, B – некоторый эмпирический коэффициент связи, f – частота колебаний ЭМГ. Однако, судя по значениям R2, для подгруппы NO (рис. 1) он достигает лишь пограничного уровня, между плохой и приемлемой аппроксимацией. Для подгруппы YES связь между параметрами «A» и «f» практически отсутствует.
В группе пациентов с нарушением восприятия тепла после оперативной коррекции деформации позвоночника отмечается заметное смещение всей области данных в нижнюю часть диаграммы (рис. 2B), что связано с послеоперационным снижением амплитуды ЭМГ.
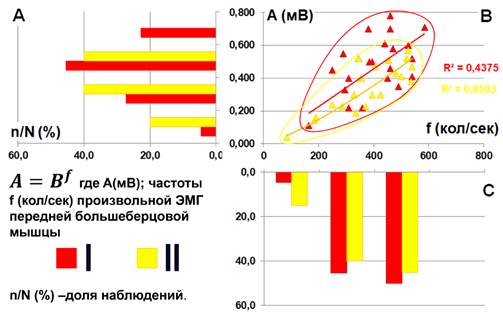
Рис. 2. Изменение характера взаимосвязи амплитуды A(мВ) и частоты f (кол./сек.) произвольной ЭМГ передней большеберцовой мышцы на фоне отсутствия (NO) порогов ощущения тепла рецептивного поля спинального сегмента L5 I – до и II - после оперативного вмешательства. Статистическое распределение значений (А) амплитуды, (C) частоты колебаний ЭМГ. n/N (%) - доля наблюдений
При этом характер распределения амплитуд ЭМГ становится более плавным, сглаженным по сравнению с дооперационным периодом (рис. 1A). Изменения в распределении параметра f практически отсутствуют (рис. 2C).
Максимальные значения коэффициентов детерминации по-прежнему сохраняются для степенной функции. Однако сам данный параметр значительно увеличивается и достигает уровня высокого соответствия распределения данных выбранному уравнению.
В группе пациентов с сохранением восприятия тепла после оперативной коррекции деформации позвоночника данные группируются практически в той же области диаграммы, что и до операции (рис. 3B).
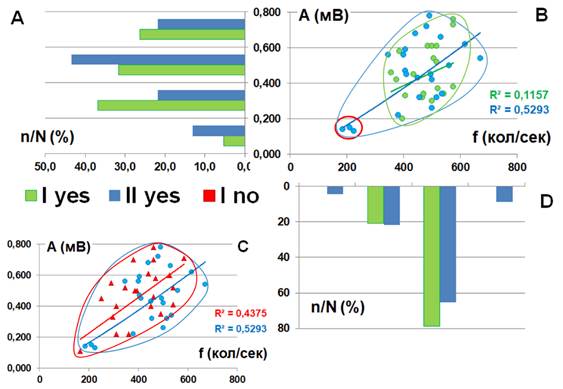
Рис. 3. Изменение характера взаимосвязи амплитуды A(мВ) и частоты f (кол./сек.) произвольной ЭМГ m.tibialis anterior на фоне сохранения (YES) порогов ощущения тепла рецептивного поля спинального сегмента L5 I – до и II – после оперативного вмешательства. Статистическое распределение значений (А) амплитуды, (D) – частоты колебаний ЭМГ. n/N (%) - доля наблюдений. С - совпадение территорий, занимаемых группами наблюдений с сохранённым восприятием тепла в послеоперационном периоде и с нарушением восприятия тепла перед операцией в фазовом пространстве ЭМГ-параметров
Но если в дооперационном периоде значения амплитуды ЭМГ были сконцентрированы в диапазоне 400-600 мВ, то после операции они относительно равномерно распределились в диапазоне от 200 до 800 мВ (рис. 3A), т.е. пространственное распределение наблюдений стало похоже на конфигурацию, соответствующую группе NO в предоперационном периоде (рис. 3С), за исключением небольшого количества наблюдений в левом нижнем углу диаграммы. При этом максимальные значения амплитуды ЭМГ в обеих группах сконцентрированы в частотном диапазоне 400-600 колебаний в секунду (рис. 3D). Следует отметить, что в послеоперационном периоде появились единичные наблюдения низкочастотной низкоамплитудной ЭМГ (на рисунке обведено красным). Последнее является причиной повышения коэффициента детерминации от уровня случайного шума в дооперационном периоде до уровня приемлемой аппроксимации после операции.
Таким образом, в послеоперационном периоде для всего множества наблюдений имеет место высокое (для группы NO) и среднее (для группы YES) качество аппроксимации с помощью степенной функции зависимости амплитуды произвольной ЭМГ от её частоты (рис. 4B).
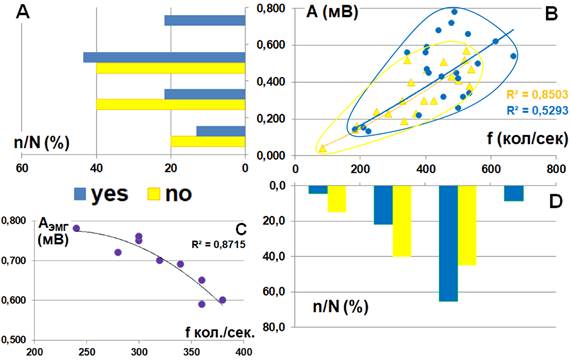
Рис. 4. Характер взаимосвязи амплитуды A(мВ) и частоты f (кол./сек.) произвольной ЭМГ передней большеберцовой мышцы в зависимости от наличия (YES) или отсутствия (NO) порогов ощущения тепла рецептивного поля спинального сегмента L5 в послеоперационном периоде. Статистическое распределение значений (А) амплитуды, (D) – частоты колебаний ЭМГ. (С) – амплитудно-частотные паттерны ЭМГ здорового испытуемого. n/N (%) – доля наблюдений
При этом множество наблюдений в группе NO смещено относительно множества наблюдений группы YES в область низких частот и низких амплитуд.
Сочетание определённых значений амплитуды и частоты ЭМГ, регистрируемой при максимальном произвольном напряжении, детерминировано параллельной работой двух физиологических механизмов (рис. 5), обеспечивающих поддержание заданного уровня усилия.
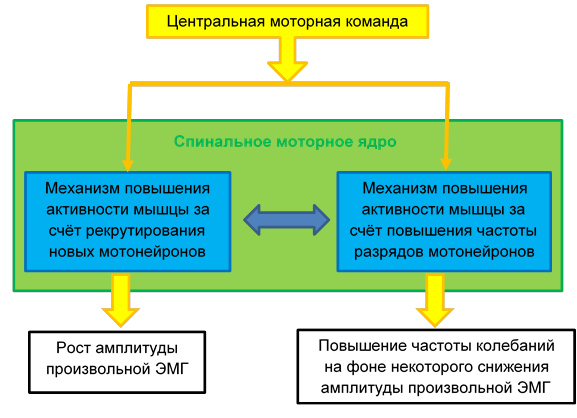
Рис. 5. Механизмы управления степенью активации мышцы
Это увеличение частоты импульсации активных α-мотонейронов и рекрутирование дополнительных двигательных единиц. Их взаимодействие модулируется рядом факторов: типом рекрутируемых двигательных единиц [8, с. 22], включением интрасегментарных механизмов синхронизации активности двигательных единиц, сенсорным фоном, на котором происходит развитие мышечного напряжения, в особенности присутствием в нём ноцицептивного компонента [9].
Для соматически здорового человека многократное повторение теста на максимальное произвольное напряжение демонстрирует умеренную обратную зависимость амплитуды ЭМГ при максимальном произвольном напряжении от её частоты (рис. 4С). Это связано с тем, что увеличение частоты импульсации мотонейронов ведёт к учащению наложения друг на друга противоположных по знаку фаз их потенциалов действия [8, с. 96]. В целом такой характер взаимосвязи сохраняется и для ЭМГ группы здоровых испытуемых, близких по возрасту и соматическому статусу. Но качество аппроксимации при этом заметно снижается по сравнению с данными одного человека, что видно на рисунке 1Б для группы NO, за счёт того, что двигательные единицы тестируемой мышцы при её максимальном напряжении у разных людей могут заметно различаться по занимаемой территории, электрофизиологическим свойствам и т.п. [10, с. 57], что отражается на характере суммации их потенциалов действия при регистрации ЭМГ. При высокой неоднородности группы испытуемых или под действием факторов, повышающих неоднородность, качество аппроксимации может снизиться до уровня случайного шума. Примером этому служит группа YES в предоперационном периоде (рис. 1Б). Поэтому взаимное расположение территорий, занимаемых множеством наблюдений сравниваемых групп, и соотношение их коэффициентов детерминации позволяет предположить, что нарушение восприятия тепла отражается на характере рекрутирования двигательных единиц. То есть нарушение термочувствительности маркирует некий механизм, унифицирующий их активацию.
Смещение на диаграмме множества наблюдений обеих групп (рис. 2Б, 3Б) влево вниз относительно исходного состояния (область низких амплитуд и частот) обусловлено действием центрального охранительного торможения [9], обычно наблюдаемого в послеоперационном периоде [11]. Поскольку это смещение более выражено на фоне термоанестезии (рис. 4Б), можно констатировать, что у пациентов с нарушением восприятия тепла более интенсивно спинальное торможение мышечной активности по сравнению с ситуацией сохранения восприятия тепла. Видимо, спинальное торможение α-мотонейронов в послеоперационном периоде усиливается на фоне инактивации термочувствительности. Наблюдаемое при этом усиление степени сопряжения частоты ЭМГ и её амплитуды, более выраженное на фоне нарушения восприятия тепла, можно объяснить тем, что остаточные эффекты анестезии [12-14], носящие генерализованный характер [15-17], а также отсроченные эффекты повышенной ноцицептивной активности [9] во взаимодействии друг с другом так меняют режим функционирования спинального моторного центра, что оба механизма генерации произвольной ЭМГ (рис. 5) начинают функционировать в режиме синергии. Данный феномен требует дополнительных объяснений и проведения дальнейших исследований.
Заключение
Таким образом, состояние термоанестезии усиливает тормозные влияния на спинальные двигательные центры и изменяет характер взаимосопряжённости амплитуды и частоты ЭМГ при максимальном произвольном напряжении после хирургической коррекции деформации позвоночника.
Библиографическая ссылка
Богатырев М.А., Сайфутдинов М.С., Щурова Е.Н., Очирова П.В. ВЛИЯНИЕ ТЕРМОАНЕСТЕЗИИ НА СОСТОЯНИЕ СПИНАЛЬНОГО ДВИГАТЕЛЬНОГО ЦЕНТРА НА ФОНЕ ДЕФОРМАЦИИ ПОЗВОНОЧНИКА // Современные проблемы науки и образования. 2024. № 4. ;URL: https://science-education.ru/ru/article/view?id=33610 (дата обращения: 24.02.2026).
DOI: https://doi.org/10.17513/spno.33610



