Введение
Все больше оперативных вмешательств, выполняемых в гинекологической практике, проводятся посредством малоинвазивных технологий. После лапароскопии выраженность послеоперационной боли обычно ниже, чем после лапаротомии [1], однако как во время операции, так и в ранний послеоперационный период возможно возникновение болевого синдрома, значительно влияющего не только на удовлетворенность пациенток и качество периоперационного периода, но и на выраженность воспалительных реакций, увеличивающих вероятность развития осложнений [2]. Женщины, как правило, более чувствительны к боли по сравнению с мужчинами [3], и около 32% пациенток после гистерэктомии сталкиваются с хронической болью, сохраняющейся на протяжении года [4]. Таким образом, проблема послеоперационной боли в лапароскопической гинекологии не теряет своей актуальности.
Дексмедетомидин, высокоселективный агонист α2-адренорецепторов центральной нервной системы, обладает седативным, анксиолитическим, анальгетическим и анестезирующим эффектами [5–7]. Кроме того, дексмедетомидин известен своей способностью снижать воспалительные и стрессовые реакции, что было подтверждено метаанализом, выявившим значительное снижение уровня воспалительных маркеров в сыворотке [8]. Применение его в различных дозах показало значительный эффект, в том числе и после лапароскопических операций [9–11]. С учетом потенциальных побочных эффектов высоких доз в виде брадикардии, гипотензии и избыточной седации, в литературе предложен метод применения низких доз без нагрузочной инфузии, демонстрирующий высокую эффективность [12].
Проведенные исследования показали, что популяция пациенток, подвергающихся лапароскопическим операциям, неоднородна, и существуют различные факторы риска, увеличивающие вероятность интенсивной послеоперационной боли. К таким факторам относят исходный уровень тревожности, субъективную оценку боли, травматичность операции и др. [13–15]. Именно у пациенток высокого риска применение методов индивидуализации терапии может дать наиболее выраженный клинический эффект.
Гипотеза состоит в том, что непрерывная инфузия дексмедетомидина без нагрузочной дозы может быть эффективной у пациенток с высоким риском без увеличения частоты побочных эффектов.
Цель исследования
Изучить влияние интраоперационной инфузии низких доз дексмедетомидина на выраженность послеоперационного болевого синдрома после гинекологических лапароскопических операций у пациенток высокого риска.
Материалы и методы исследования
Настоящее рандомизированное контролируемое исследование проведено в Клинике ФГБОУ ВО «Кубанский государственный медицинский университет» Минздрава России, Краснодар, с 1 февраля 2024 г. по 31 мая 2024 г. Проведен анализ течения периоперационного периода у 117 пациенток гинекологического профиля, подвергшихся лапароскопическим операциям.
Исследование одобрено локальным этическим комитетом ФГБОУ ВО КубГМУ Минздрава России, все пациентки подписали информированное добровольное согласие на участие в нем. При разработке дизайна и формировании рукописи авторы руководствовались контрольным листом CONSORT 2010.
В исследование включались пациентки гинекологического отделения (старше 18 лет), которым в плановом порядке выполнялись оперативные вмешательства на органах малого таза и которые соответствовали высокому риску, который определялся перед операцией совокупностью таких критериев, как [16]: длительность произвольного порогового апноэ после глубокого вдоха, баллы по шкале катастрофизации боли, баллы по шкале тревоги, предполагаемая длительность оперативного вмешательства и наличие эндометриоза. Физический статус по классификации American Society of Anesthesiologists (ASA) соответствует 1–2-му классу.
Критериями исключения были: пациентки с низким риском выраженного болевого синдрома [16], пациенты с индексом массы тела (ИМТ) >30 кг/м2; наличие аллергии на исследуемые препараты; наличие сердечно-сосудистых, легочных, почечных, цереброваскулярных или психиатрических заболеваний; синусовая брадикардия; хроническая тазовая боль; хроническое употребление опиоидов; беременные или кормящие грудью; наличие сахарного диабета; признаки инфекции (лихорадка в течение 1 недели); переход на открытую операцию; физический статус ASA III или более. Распределение в группу контроля и группу лечения осуществлялось с помощью генератора случайных чисел блоками по 10 пациентов до начала операции.
У всех пациенток внутривенно применяли кетопрофен 100 мг за 20 мин до разреза и внутривенно 8 мг дексаметазона перед индукцией. Интраоперационно использовалась общая анестезия с искусственной вентиляцией легких с протективными параметрами и поддержанием нормовентиляции. Осуществляли местную анестезию точек стояния троакаров, за 30 мин до операции применяли ондансетрон для профилактики послеоперационной тошноты и рвоты (ПОТР). В обеих группах послеоперационное обезболивание состояло из парацетамола (1 г, в/в инфузия в течение 15 мин каждые 6 ч) и пациент-контролируемой анальгезии (ПКА) 0,05%-ным раствором морфина (болюс 2 мл (1 мг), локаут 10 мин, инфузия 1 мл/ч (0,5 мг/ч)). Дополнительное обезболивание применялось по решению лечащего врача и фиксировалось как экстренное обезболивание.
Рандомизация осуществлялась накануне операции. В группе лечения после индукции анестезии начинали инфузию дексмедетомидина в дозе 0,4 мкг/кг/ч (группа Д), а в контрольной группе – того же объема 0,9%-ного физиологического раствора (группа К). Шприцы, содержащие дексмедетомидин или 0,9%-ный физиологический раствор, были неразличимы и не имели этикетки с названием лекарственного средства. При удалении троакара у пациента прекращали постоянную инфузию дексмедетомидина или физиологического раствора.
Первичный исход – интенсивность болевого синдрома. Пациенток оценивали по числовой рейтинговой шкале боли (ЧРШ) в следующие моменты времени: в палате пробуждения (ЧРШ 0), через 30 мин после поступления (ЧРШ 0,5), через 2 ч (ЧРШ 2), через 6 ч (ЧРШ 6) и в ознакомительный визит в первый послеоперационный день (ЧРШ 24).
Вторичные исходы. Оценивали потребность в наркотических анальгетиках, внеплановое купирование выраженного болевого синдрома. Изучали частоту интраоперационных и послеоперационных гемодинамических и респираторных критических инцидентов (гипоксемии (снижение SpO2 менее 95%), артериальной гипотензии (снижение среднего артериального давления ниже 20% от исходного или менее 70 мм рт. ст.), брадикардии (снижение частоты сердечных сокращений менее 50 в мин)), ПОТР (по 4-балльной вербальной шкале [17], наличие послеоперационных осложнений и их тяжесть, потребность в дополнительной терапии ПОТР.
У всех пациентов оценивали предоперационный уровень тревоги (шкала из 7 пунктов генерализованного тревожного расстройства (GAD7) [18] и шкала катастрофизации боли (шкала PCS) [19]).
Параметры гемодинамики (артериальное давление и частоту сердечных сокращений) во время анестезии и операции оценивали на следующих этапах: Т0 – исходный уровень; Т1 – до интубации трахеи; Т2 – разрез; Т3 – через 10 мин после инсуффляции СО2; Т4 – окончание операции; Т5 – после экстубации.
Уровень седации в послеоперационный период оценивали с использованием шкалы седации Ramsay, чрезмерную седацию определяли как оценку ≥4 [20]. Возбуждение оценивали с использованием шкалы седации–возбуждения Riker, ажитацию при пробуждении определяли как балл ≥5 [21].
Удовлетворенность пациентов послеоперационным обезболиванием оценивали по 5-балльной шкале [22].
Статистический анализ
Расчет выборки был произведен исходя из анализа выраженности послеоперационного болевого синдрома в клинике: средний балл по ЧРШ составил 4 (стандартное отклонение 1,4). Анализ мощности показал, что для выявления значимых различий в показателях ЧРШ более чем на 1 балл между группами (мощность 90% и α=0,05) для каждой группы необходим объем выборки в 42 пациентки на группу. Таким образом, всего в исследование планируется набрать 120 пациенток (по 60 в каждой группе) с учетом риска потери данных. Для оценки характера распределения использовался критерий Колмогорова–Смирнова. Данные представлены в виде средних ± стандартное отклонение (m±s) или медианных значений и межквартильных диапазонов. Дихотомические переменные анализировались с помощью точного критерия Фишера или критерия χ2. Непрерывные переменные оценивались с помощью U-критерия Манна–Уитни. Дисперсионный анализ повторных измерений (ANOVA) использовался для оценки различий в интенсивности боли в разные моменты времени.
Исследование одобрено локальным этическим комитетом ФГБОУ ВО КубГМУ Минздрава России.
Результаты исследования и их обсуждение
Из 245 пациенток, оцененных на предмет включения в исследование, в итоговый анализ включены данные 117 пациенток (58 в группе Д и 59 в группе К) (рис. 1).
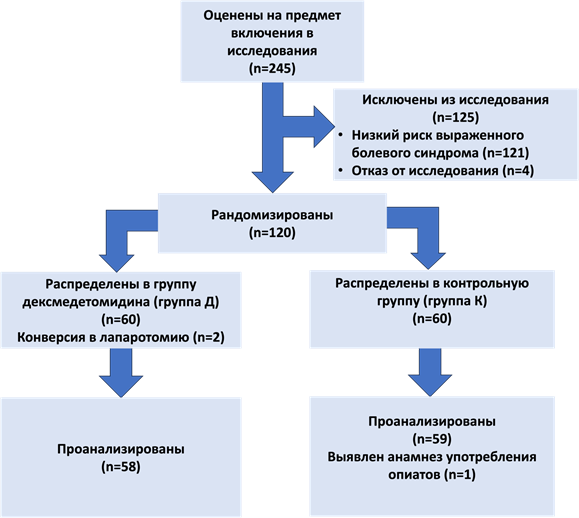
Рис. 1. Блок-схема дизайна исследования
Достоверных различий по предоперационным характеристикам между исследуемыми группами выявлено не было (табл. 1). Следует отметить статистически значимое снижение дозы фентанила в группе дексмедетомидина.
Таблица 1
Предоперационные характеристики в изучаемых группах
|
Параметр |
Группа Д |
Группа К |
p |
|
Возраст, лет (М (р25–р75)) |
38 (31–44) |
37 (32–47) |
0,55 |
|
Вес, кг (М (р25–р75)) |
58 (52–75) |
57 (51–73) |
0,41 |
|
ИМТ, кг/м2 (М (р25–р75)) |
24 (22–26) |
25 (23–27) |
0,43 |
|
ASA, класс (М (р25–р75)) |
1 (1–1) |
1 (1–1) |
0,84 |
|
Длительность произвольного порогового апноэ, сек |
34(38-41) |
33 (28-40) |
0,67 |
|
GAD7, балл (М (р25–р75)) |
3 (0–6) |
4 (0–6) |
0,24 |
|
PSC, балл (М (р25–р75)) |
11 (9–16) |
11 (9–17) |
0,49 |
|
Длительность операции, мин (М (р25–р75)) |
75 (40–110) |
70 (35–100) |
0,21 |
|
Шкала Apfel, балл (М (р25–р75)) |
3 (3–4) |
3 (3–4) |
0,37 |
|
Процедуры |
|||
|
Гистерэктомия, n |
17 |
18 |
0,88 |
|
Операции по поводу эндометриоза, n |
16 |
15 |
0,79 |
|
Аднексэктомия, n |
7 |
10 |
0,74 |
|
Миомэктомия, n |
14 |
13 |
0,78 |
|
Другие, n |
4 |
3 |
0,67 |
|
Интраоперационные факторы |
|||
|
Объем инфузии, мл/кг (М (р25–р75)) |
7,3 (6,5–9,4) |
7,8 (6,3–9,6) |
0,51 |
|
Доза фентанила, мг/кг/ч (М (р25–р75)) |
2,3 (2,1–3,1) |
2,9 (2,4–3,8) |
0,04 |
|
Apfel — шкала риска развития тошноты и рвоты; ASA (Американское общество анестезиологов) – физический статус пациентов; GAD7 (Generalized Anxiety Disorder 7) – шкала тяжести генерализованного тревожного расстройства из 7 пунктов; PHQ-9 (Patient Healthcare Questionnaire for Depression) – анкета здоровья пациента при депрессии; PSC (The Pain Catastrophizing Scale) – шкала катастрофизации боли. |
|||
Уже при первом определении интенсивности болевого синдрома выявлена статистически значимая разница (табл. 2). Следует отметить, что выраженность боли по ЧРШ была ниже в группе Д на всех этапах регистрации в течение первых суток послеоперационного периода. Потребность в наркотических анальгетиках также на всех этапах исследования была выше в группе К, что в результате привело и к статистически значимой разнице в общей потребности в морфине за первые 24 часа, а также к более частой потребности в дополнительном экстренном обезболивании (табл. 2).
Таблица 2
Уровень болевого синдрома и потребность в наркотических анальгетиках в группах
|
Этап |
Группа Д |
Группа К |
р |
|
Уровень болевого синдрома, баллы ЧРШ (m±s) |
|||
|
ЧРШ 0 |
4,67±1,03 |
6,11±1,33 |
<0,0001 |
|
ЧРШ 0,5 |
4,56±0,91 |
5,56±1,21 |
<0,0001 |
|
ЧРШ 2 |
3,31±0,83 |
4,56±1,06 |
<0,0001 |
|
ЧРШ 6 |
3,25±0,76 |
4,67±0,95 |
<0,0001 |
|
ЧРШ 24 |
2,92±0,63 |
3,98±0,82 |
<0,0001 |
|
Потребность в наркотических анальгетиках, мг морфина (m±s) |
|||
|
0–2 ч после операции |
2,98±1,15 |
3,31±1,45 |
0,01 |
|
2–6 ч после операции |
3,61±1,00 |
4,56±1,29 |
0,004 |
|
6–24 ч после операции |
12,45±2,24 |
15,19±2,98 |
<0,0001 |
|
0–24 ч после операции |
19,65±4,56 |
24,13±6,53 |
<0,0001 |
|
Экстренное обезболивание, % |
23 (39%) |
45 (78%) |
0,002 |
|
m±s – среднее ± стандартное отклонение; ЧРШ — числовая рейтинговая шкала боли. |
|||
Интраоперационные гемодинамические параметры отражены на рисунках 2 и 3. Частота сердечных сокращений в обеих группах увеличилась после разреза, однако степень увеличения была выше в группе К, после этого ЧСС в обеих группах снижалась и на всех этапах была при этом ниже в группе пациентов, получавших инфузию дексмедетомидина. После экстубации ЧСС ожидаемо увеличилась и стала выше исходного значения, однако также степень этого увеличения была выше в контрольной группе. Среднее артериальное давление характеризовалось схожим трендом в обеих группах – снижением после индукции анестезии и увеличением после разреза, хотя это увеличение также было менее выражено в группе дексмедетомидина. В последующем динамика артериального давления была стабильной с тенденцией к увеличению после экстубации, более выраженной в контрольной группе.
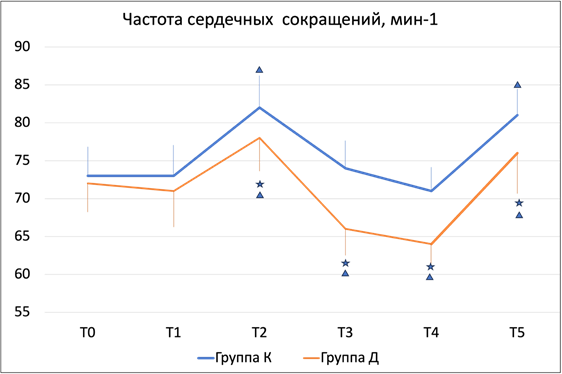
Рис. 2. Динамика частоты сердечных сокращений на этапах анестезии. Звездами отмечена разница между группами (p<0,05), треугольниками отмечена разница по сравнению с исходными значениями (p<0,05)
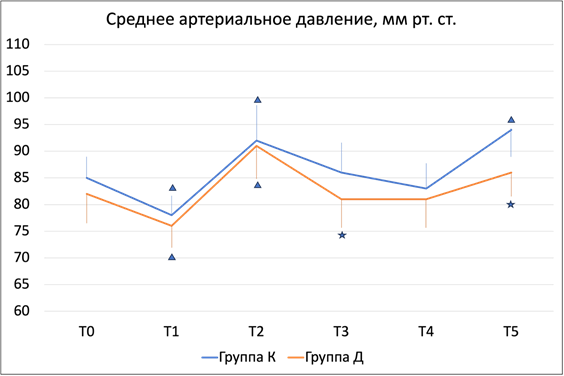
Рис. 3. Динамика среднего артериального давления на этапах анестезии. Звездами отмечена разница между группами (p<0,05), треугольниками отмечена разница по сравнению с исходными значениями (p<0,05)
В целом статистически значимых различий в частоте ПОТР в целом и в частоте ПОТР различной выраженности отмечено не было, как и в потребности в дополнительной антиэметической терапии (табл. 3).
Таблица 3
Частота и выраженность ПОТР
|
Выраженность ПОТР |
Группа Д |
Группа К |
р |
|
Всего ПОТР, n |
26 |
34 |
0,11 |
|
ПОТР 1 балл, n |
5 |
10 |
0,15 |
|
ПОТР 2 балла, n |
6 |
8 |
0,59 |
|
ПОТР 3 балла, n |
7 |
6 |
0,74 |
|
ПОТР 4 балла, n |
8 |
10 |
0,63 |
|
Потребность в экстренной антиэметической терапии, n |
16 |
26 |
0,06 |
|
ПОТР – послеоперационная тошнота и рвота. |
|||
Среди нежелательных явлений статистически значимых различий не выявлено (табл.4).
Таблица 4
Нежелательные явления
|
Нежелательное явление, % |
Группа Д |
Группа К |
р |
|
Гипоксемия |
2 |
4 |
0,41 |
|
Гипотензия |
3 |
1 |
0,36 |
|
Избыточная седация |
2 |
7 |
0,16 |
|
Ажитация |
1 |
1 |
1,0 |
|
Брадикардия |
8 |
3 |
0,12 |
Обезболивание как в контрольной группе, так и в группе Д большинством пациенток было признано удовлетворительным, тем не менее, полностью удовлетворенных качеством анестезии пациенток было статистически значимо больше в группе дексмедетомидина (табл.5).
Таблица 5
Удовлетворенность обезболиванием
|
Уровень удовлетворенности, n |
Группа Д |
Группа К |
р |
|
Вполне удовлетворен |
19 |
9 |
0,03 |
|
Скорее удовлетворен |
15 |
18 |
0,45 |
|
Не могу определиться |
15 |
17 |
0,55 |
|
Скорее неудовлетворен |
7 |
9 |
0,61 |
|
Не удовлетворен |
2 |
6 |
0,27 |
Исследование показало, что использование интраоперационной инфузии низких доз дексмедетомидина значительно снижает послеоперационный болевой синдром у пациенток, перенесших гинекологические лапароскопические операции. Эти результаты подчеркивают важность контроля боли в послеоперационный период и подтверждают эффективность дексмедетомидина в этой области.
Выраженность болевого синдрома
Выраженность послеоперационной боли оценивалась с помощью числовой рейтинговой шкалы (ЧРШ). Пациенты, получавшие дексмедетомидин (группа Д), испытывали значительно меньшую боль на всех этапах послеоперационного периода по сравнению с контрольной группой (группа К). Это особенно важно, учитывая, что послеоперационная боль может существенно влиять на качество жизни пациентов и замедлять процесс восстановления.
Роль дексмедетомидина в снижении боли
Дексмедетомидин, являющийся высокоселективным агонистом α2-адренорецепторов, обладает множеством полезных свойств, включая седативное, анксиолитическое и анальгезирующее действие. Эти свойства делают его идеальным кандидатом для управления послеоперационной болью. В исследовании было показано, что дексмедетомидин эффективно снижает уровень боли без значительного увеличения частоты побочных эффектов. Это подтверждается также метаанализом, который выявил снижение уровня воспалительных маркеров при использовании дексмедетомидина [8]. Анальгетическое действие дексмедетомидина связано не только со снижением воспаления. Так, в работе J. Lee (2022) продемонстрирован эффект низких доз дексмедетомидина в обезболивании без влияния на уровень системных маркеров воспаления [12]. Это подчеркивает потенциал дексмедетомидина у пациентов с нарушением модуляции болевых стимулов [23], к которым относятся и пациентки с высоким риском послеоперационного болевого синдрома [13].
Снижение дозы опиоидов
Одним из значимых результатов исследования является снижение потребности в наркотических анальгетиках у пациентов, получавших дексмедетомидин. Это важно, поскольку опиоиды часто вызывают побочные эффекты, такие как тошнота, рвота, нарушение моторики желудочно-кишечного тракта и риск развития зависимости. Исследования показывают, что дексмедетомидин может значительно уменьшить дозу требуемых опиоидов при различных хирургических вмешательствах [9, 11, 12]. В данной работе пациенты из группы Д требовали статистически меньшей дозы фентанила во время операции, при этом, даже после прекращения инфузии, потребность в наркотических анальгетиках после операции в первые 24 часа также была ниже, что подтверждает длительный морфин-сберегающий эффект дексмедетомидина.
Различные дозировки дексмедетомидина
Различные дозировки дексмедетомидина могут оказывать разные эффекты на интенсивность боли и частоту побочных явлений. В большинстве предыдущих исследований использовалась непрерывная инфузия дексмедетомидина в дозах 0,2–0,7 мкг/кг/ч после введения загрузочной дозы 0,5–1 мкг/кг [9]. Тем не менее, было показано, что даже без загрузочной дозы дексмедетомидин в дозах 0,4–0,5 мкг/кг/ч эффективно снижает боль и является гемодинамически стабильным [10, 11], в том числе и в лапароскопической гинекологии [13]. В данном исследовании использовалась доза 0,4 мкг/кг/ч, что позволило достичь значительного снижения боли без значимых побочных эффектов, таких как гипотензия и брадикардия. Определение оптимальной дозировки дексмедетомидина требует дальнейших исследований, чтобы сбалансировать его анальгезирующие свойства и минимизировать потенциальные риски.
Побочные эффекты: брадикардия и остаточная седация
Брадикардия и остаточная седация являются известными побочными эффектами дексмедетомидина [24]. В настоящем исследовании не было выявлено значимых различий в частоте брадикардии между группами, хотя группа Д демонстрировала тенденцию к более высокой частоте этого состояния. Это согласуется с данными литературы, где сообщается о риске развития брадикардии при использовании дексмедетомидина [25]. Однако следует отметить, что брадикардия, вызванная дексмедетомидином, как правило, легко поддается коррекции и редко приводит к серьезным осложнениям.
Результаты исследования остаточной седации показали, что дексмедетомидин не вызывает значимой остаточной седации по сравнению с контрольной группой. Это важный вывод, так как избыточная седация может замедлить процесс восстановления и повысить риск послеоперационных осложнений. Более того, избыточная седация чаще наблюдалась в контрольной группе, хотя и не достигла статистической значимости. Это также может быть следствием большей дозы наркотических анальгетиков. Дексмедетомидин оказывает мягкое седативное действие, которое, как правило, хорошо переносится пациентами [6]. Это подтверждается также другими исследованиями, которые показывают, что дексмедетомидин может быть безопасно использован для седативного эффекта без значительной остаточной седации [7].
Влияние на послеоперационную тошноту и рвоту
В исследовании не было выявлено значимых различий в частоте послеоперационной тошноты и рвоты (ПОТР) между группами. Это согласуется с предыдущими данными, показывающими, что дексмедетомидин не оказывает значительного влияния на частоту ПОТР [10]. Тем не менее, существуют свидетельства, что дексмедетомидин даже в такой дозе снижает частоту ПОТР [26]. Контроль ПОТР остается важным аспектом послеоперационного ухода, и дополнительные исследования могут помочь определить оптимальные стратегии для управления им.
Ограничения исследования
Несмотря на положительные результаты, исследование имеет ряд ограничений. Во-первых, исследование не выявило значимых различий в частоте ПОТР и побочных эффектов, таких как гипотензия и остаточная седация. Эти исходы не были первичными целевыми точками, и, возможно, более мощные исследования могут выявить эти различия. Во-вторых, в исследовании не рассматривались различные дозы дексмедетомидина и стратегии его введения. Вопрос об оптимальной дозировке и режиме введения дексмедетомидина требует дальнейших исследований.
Заключение
Результаты исследования показывают, что использование интраоперационной инфузии дексмедетомидина в низких дозах эффективно снижает послеоперационную боль и потребность в наркотических анальгетиках у пациенток, перенесших гинекологические лапароскопические операции. Это подтверждает важность дексмедетомидина в управлении послеоперационной болью и улучшении качества жизни пациентов, особенно у пациенток с факторами риска интенсивного болевого синдрома. Несмотря на потенциальные побочные эффекты, такие как брадикардия и остаточная седация, дексмедетомидин остается безопасным и эффективным средством для использования в клинической практике.
Библиографическая ссылка
Дмитриев А.А., Долдуров Г.С., Трембач Н.В. ВЛИЯНИЕ ИНТРАОПЕРАЦИОННОЙ ИНФУЗИИ ДЕКСМЕДЕТОМИДИНА НА ПОСЛЕОПЕРАЦИОННЫЙ БОЛЕВОЙ СИНДРОМ ПОСЛЕ ЛАПАРОСКОПИЧЕСКИХ ГИНЕКОЛОГИЧЕСКИХ ОПЕРАЦИЙ У ПАЦИЕНТОВ ВЫСОКОГО РИСКА: РАНДОМИЗИРОВАННОЕ ИССЛЕДОВАНИЕ // Современные проблемы науки и образования. 2024. № 4. ;URL: https://science-education.ru/ru/article/view?id=33603 (дата обращения: 24.02.2026).
DOI: https://doi.org/10.17513/spno.33603



