Введение
Благодаря росту социального благополучия населения и достижениям медицины наш мир преобразуется в общество долгожителей. Растущее пожилое население подвержено разнообразным стрессам, особенно болезням и смерти. С возрастом сосуды морфологически и физиологически дегенерируют, способствуя развитию распространенных сердечно-сосудистых заболеваний (ССЗ) у пожилых людей, таких как артериальная гипертензия, ишемическая болезнь сердца, аневризма и инсульт [1, 2]. По сравнению с лицами в возрасте 65–74 лет смертность от ССЗ увеличивается с 40 до 60% всех смертей у лиц в возрасте старше 80 лет [3]. Эти факты демонстрируют важность учета возрастной ангиопатии для здоровья стареющего общества.
Возрастная ангиопатия – это непрерывный процесс, характеризующийся ухудшением структуры и функции кровеносных сосудов с возрастом. Данные изменения могут произойти и в молодом возрасте у лиц с факторами риска сердечно-сосудистых заболеваний, такими как дислипидемия, гипергликемия, нездоровый образ жизни или артериальная гипертензия, а также перенесенные инфекционные заболевания, повреждающие сосудистую стенку, что приводит к преждевременному старению сосудов, которое инициирует или усугубляет ССЗ [4, 5, 6]. Следовательно, ранняя диагностика и своевременное лечение являются ключом к успеху в профилактике ССЗ [7]. С этой целью были разработаны и предложены несколько методик выявления изменений в структуре и функции сосудов с возрастом. Однако степень чувствительности и специфичности методов, направленных на оценку изменений сосудов, доступность выполнения данных методик еще предстоит оценить [6].
Целью исследования было рассмотреть доступные в литературе способы оценки возрастной ангиопатии, применяемые в клинической практике, предоставляя общие рекомендации о том, как улучшить оценку возрастной ангиопатии.
Материалы и методы исследования
Проведен поиск по базам медицинских литературных данных PubMed, EMBASE, Medline, eLIBRARY.ru оригинальных русско- и англоязычных работ, опубликованных с 1986 по 2024 годы. Дополнительно произведен поиск по референтным ссылкам выявленных статей. Электронный поиск осуществлялся по следующим ключевым словам: «возрастная ангиопатия», «жесткость артерий», «функция эндотелия», «толщина артериальной стенки», «комплекс интима-медиа». Проанализированы 280 источников по данной теме, указаны 40 наиболее актуальных публикаций.
Результаты исследования и их обсуждение
ФУНКЦИОНАЛЬНАЯ ДИАГНОСТИКА ВОЗРАСТНОЙ АНГИОПАТИИ
Структурные изменения сосудов с возрастом, толщина комплекса интима-медиа
Толщина стенки артерии значительно увеличивается с возрастом вследствие увеличения слоя интима, в то время как толщина медиа, несущего основную нагрузку, практически не меняется [8]. Несмотря на то что многие фенотипы сосудов связаны с возрастом, в рутинной клинической практике оценка сосудистого старения проводится с помощью измерения толщины комплекса интима-медиа (ТКИМ) при выполнении ультразвукового исследования [9].
В практике с целью оценки ТКИМ наиболее часто применяется исследование сонной артерии из-за простоты выполнения методики. Показано, что ТКИМ в сегменте, свободном от поражений, линейно увеличивается примерно в 2,5 раза у мужчин с 30 до 90 лет. ТКИМ каротидной артерии увеличивался примерно на 0,04 мм за десятилетие в возрасте от 40 до 80 лет [10], аналогично у молодых испытуемых в возрасте 20–40 лет. Наряду с исследованием сонных артерий нередко для оценки ТКИМ в зависимости от возраста исследуются общие бедренные, поверхностные бедренные, подколенные и плечевые артерии [Ошибка! Источник ссылки не найден.].
В отличие от других параметров, используемых для оценки сосудистого старения, утолщение стенок каротидных артерий без атеросклеротических бляшек соответствует реальному возрасту человека [1010], таким образом, оно потенциально отражает физиологическое старение сосудов [Ошибка! Источник ссылки не найден.].
Диаметр артерий
Есть данные об увеличении диаметра артерий у пожилых людей, вероятно, вследствие постоянного воздействия внутрисосудистого давления, что приводит к растяжению эластичных артерий на протяжении всей жизни из-за постепенного нарушения упругости эластина, и в дальнейшем приводит к разрушению и фрагментации эластина. Потеря эластина способствует увеличению диаметра в основном в проксимальном отделе аорты. Измерение аорты в основном проводится с помощью трансторакальной эхокардиографии. Для получения наиболее точных результатов измерения проводятся в четко предписанных местах: в корне аорты, синотубулярном сочленении и восходящем сегменте аорты [13].
Ранее было установлено референтное значение диаметра корня аорты с помощью эхокардиографии в М-режиме на основе данных большой популяции здоровых людей. Показано, что диаметр корня аорты с возрастом (от 25 до 75 лет) постоянно увеличивался (с 28–33 мм до 33–37 мм), при этом расширение диаметра в зависимости от возраста различается у субъектов с различной площадью поверхности тела (ППТ). Однако в исследовании, основанном на эхокардиографии в В-режиме, ППТ является наиболее важным фактором, определяющим диаметр корня, в то время как возраст оказывает влияние только на размер корня аорты в восходящем сегменте аорты [14]. Другие исследования, в основе которых лежит измерение в В-режиме, показали, что связь между диаметром корня аорты и возрастом оказалась слабой [Ошибка! Источник ссылки не найден.]. Методологически диаметр корня аорты, измеренный с помощью эхокардиографии в В-режиме, оказался больше, чем диаметр, измеренный с помощью эхокардиографии в М-режиме [14]. Следовательно, при сравнении результатов различных исследований крайне важно учитывать влияние различных методик визуализации на величину диаметра корня аорты.
В еще одном исследовании сообщалось об увеличении диаметра синуса Вальсальвы и восходящей аорты на 1,1 мм и 0,9 мм соответственно за десятилетие у людей 15 лет и старше [Ошибка! Источник ссылки не найден.]. Корреляция между возрастом и диаметром корня аорты нелинейная. Возрастная дилатация корня аорты у детей в возрасте до 15 лет происходила быстрее, чем у взрослых: со скоростью почти 10 мм в десятилетие в возрасте с 1 до 15 лет по сравнению с 1,1 мм в десятилетие в возрасте старше 15 лет. Важно отметить, что именно ППТ, а не возраст, являлся наиболее решающим фактором, оказывающим влияние на расширение корня аорты у лиц моложе 15 лет [14]. Данные исследования показали, что диаметр восходящего сегмента аорты, оцененный с помощью эхокардиографии, более тесно связан со старением [15]. Расширение корня аорты, связанное с возрастом, обычно встречается у взрослого населения, поскольку размеры аорты у лиц моложе 15 лет в основном зависят от площади поверхности тела [1414].
Помимо аорты, положительная корреляционная связь между диаметром просвета артерии и возрастом была также показана в периферических артериях, таких как бедренные, подколенные [11] и сонные артерии. Исследователи полагают, что увеличение диаметра артерии является значимым показателем старения сосудов.
Функциональные изменения сосудов с возрастом
Эндотелийзависимая вазодилатация
С возрастом происходит потеря чувствительности эндотелийзависимой вазодилатации артерий к вазодилататорам, таким как ацетилхолин, следовательно, данное изменение можно рассматривать как функциональный параметр степени старения сосудов. Возрастная эндотелиальная дисфункция была задокументирована в коронарных артериях [16], периферических артериях [17]. Лежащие в ее основе механизмы многофакторные, включают повышенный окислительный стресс, воспалительную реакцию и несбалансированное высвобождение вазоконстрикторов и вазодилататоров [17].
Вазодилатация, вызванная ацетилхолином
Интракоронарная инфузия ацетилхолина вызывает расширение здоровых коронарных артерий, стимулируя эндотелиальные клетки к высвобождению оксида азота (NO) [18]. Поэтому количественный ангиографический анализ вызванной ацетилхолином коронарной дилатации предсердий используется в качестве золотого стандарта для определения функции коронарного эндотелия коронарных артерий. Существующие исследования демонстрируют положительную корреляцию между старением и снижением коронарного кровотока при инфузии ацетилхолина в левую главную коронарную артерию. Процентное соотношение изменений кровотока, вызванных ацетилхолином и папаверином, снизилось почти на 80% в возрасте от 20 до 80 лет [16]. Вызванная ацетилхолином вазодилатация зависит от дозы, особенно низкой. Сообщалось, что вазодилатация снижалась на 2,5, 2,6 и 4,1 мм за десятилетие при дозировках 1, 3 и 10 мкг/мин соответственно [1616]. Общая иллюстрация того, что ацетилхолин вызывает расширение, показана на рисунке 1.
Недостатками использования метода интракоронарной инфузии ацетилхолина для оценки дилатации сосудов являются его инвазивный характер и высокая стоимость, поэтому он применяется только у пациентов, проходящих ангиографию. Чаще с данной целью исследуются периферические артерии, в основном плечевые, где изучается кожная микроциркуляция, а не коронарная артерия. Исследование показывает, что функция эндотелия плечевой артерии в ответ на ацетилхолин аналогична функции коронарной артерии. Введение ацетилхолина в плечевую артерию привело к снижению почти на 40% максимального расширения у здоровых испытуемых в возрасте 20–80 лет [17].
Поток-опосредованная вазодилатация
Во время проведения пробы с реактивной гиперемией резкое увеличение артериального кровотока приводит к расширению сосудов. Этот процесс также зависит от повышенного высвобождения NO из эндотелиальных клеток [1919]. Поток-опосредованная вазодилатация (ПОВ), эндотелийзависимая (преимущественно NO-опосредованная) дилатация проводящих артерий в ответ на резкое увеличение кровотока и напряжение сдвига являются широко используемым методом измерения функции эндотелия кондуитных артерий. Вазодилатация, вызванная реактивной гиперемией, также может быть представлена как индекс реактивной гиперемии, измеряемый методом реактивной гиперемии-тонометрии периферических артерий. Как ДОП, так и индекс реактивной гиперемии служат неинвазивными показателями функции эндотелия и старения сосудов [20].
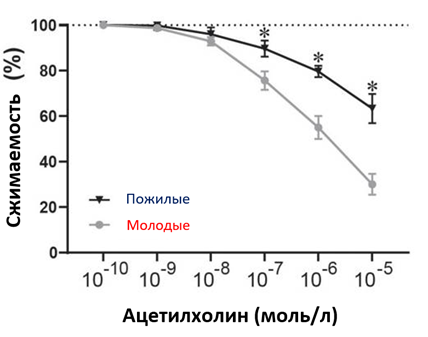
Рис.1.Функциональный сдвиг с увеличением возраста. Эндотелийзависимое расслабление сосудов, индуцируемое ацетилхолином у молодых и пожилых людей. Кривые кумулятивной реакции на концентрацию (статистическая значимость отмечена звездочками (*)). Адаптировано из работы [16]
ПОВ в значительной степени ослаблена у пожилых людей. Исследования показали, что ПОВ у пожилых людей (возраст старше 70 лет) почти на 50% ниже, чем у молодых (младше 30 лет) [2121]. В отличие от ТКИМ или диаметра артерии, рассмотренного выше, возрастное снижение ПОВ не является линейным. Снижение ПОВ становится выраженным у мужчин старше 40 лет и женщин старше 45 лет. Половой диморфизм ПОВ, вероятно, обусловлен вазопротекторным действием эстрогена. Следовательно, лучше использовать ПОВ в качестве предиктора сосудистого старения у мужчин старше 40 и женщин старше 50.
Жесткость артерий
С возрастом артерии становятся жесткими, что объясняется как структурными, так и функциональными изменениями. Эластичность артерий в значительной степени зависит от слоя интимы и медиального слоя сосудистой стенки [22]. Сначала разрушаются эластиновые волокна, несущие нагрузку, и коллагеновые волокна откладываются в медиальном слое, а соотношение эластина и коллагена снижается. Затем повышение давления на сосудистую стенку способствует фенотипическому переключению гладкомышечных клеток, что приводит к чрезмерной пролиферации и миграции гладкомышечных клеток, а также к выработке большего количества внеклеточного матрикса [23]. Наконец, эндотелиальная дисфункция вызывает снижение синтеза и высвобождения вазодилататоров, и эндотелиальные клетки становятся сверхчувствительными к вазоконстрикторам, но не чувствительными к вазодилататорам. Подытожим: эластичность артерий снижается с возрастом, что ухудшает амортизирующую функцию артерий. Жесткие артерии не способны компенсировать сердечный выброс, что вызывает более быстрое распространение и отражение пульсовой волны.
Скорость пульсовой волны
Скорость распространения пульсовой волны (Puls Wave Velocity – PWV) определяет скорость распространения пульсовой волны между двумя участками артерий на основе принципов аппланационной тонометрии. Когда эластичность артерий снижается, пульсовая волна быстро распространяется по сосудистой сети, что проявляется в виде увеличения PWV [24]. Измерение может быть выполнено в различных артериальных сегментах: в каротидно-плечевых, плече-лодыжечных и каротидно-феморальных артериях. Среди них чаще используется каротидно-феморальная PWV (cfPWV), поскольку ее легко измерить, она тесно коррелирует с жесткостью центральной артерии и имеет наибольшее клиническое значение.
Сообщалось, что cfPWV увеличился примерно в 2,5 раза в возрасте от 21 до 96 лет у субъектов, участвовавших в Балтиморском продолжительном исследовании старения [25]. Связь между повышенным уровнем cfPWV и возрастом не является линейной, поскольку уровень cfPWV увеличивается более быстрыми темпами после пятого десятилетия жизни [26Ошибка! Источник ссылки не найден.].
Следует отметить, что возрастная артериальная жесткость неоднородна по регионам и зависит от артериального давления. Также сообщалось, что каротидно-плечевой индекс PWV слабо коррелирует с возрастом [26], но другой индекс артериальной жесткости – плече-лодыжечный PWV (baPWV) – демонстрирует сильную корреляцию с возрастом, аналогичную cfPWV. Для лучшего понимания возрастных изменений PWV на рисунке 2 представлен baPWV у мужчин и женщин в возрасте 60–90 лет [2726].
Индекс аугментации
Индекс аугментации (ИА) определяется по отражению пульсовой волны и представлен как суррогатный параметр жесткости артерии. По мере того как проводящая артерия теряет свою эластичность, отраженная волна от несоответствия импеданса возвращается раньше, достигая центральной аорты в позднем систолическом периоде, и сливается с систолическим артериальным давлением. Этот процесс приводит к увеличению систолического артериального давления в аорте [28]. Соответственно, ИА аорты, который измеряет вклад ранней формы отраженного сигнала в позднее повышение систолического артериального давления в восходящей аорте, считается еще одним показателем системной артериальной жесткости.
Хотя PWV и ИА используются для измерения жесткости артерий, они предоставляют разную информацию о свойствах артерий и не являются взаимозаменяемыми. На ИА в первую очередь влияют два фактора: скорость распространения волны (PWV) и расстояние между корнем аорты и основными участками несоответствия импеданса. Таким образом, ИА – это не только показатель, отражающий жесткость артерий [29]. По этой причине возрастные изменения ИА не полностью согласуются с изменениями PWV.
Как авторы упоминали ранее, cfPWV постоянно увеличивается с возрастом, однако исследования показали, что ИА заметно выше у детей раннего возраста и постепенно снижается с возрастом до подросткового возраста (15–18 лет), в то время как cfPWV увеличивается медленно. Следовательно, более высокий ИА у детей, вероятно, объясняется малой длиной аорты, а не ускоренным отражением волн. Сообщается, что после достижения половой зрелости ИА положительно связан с возрастом. В большой здоровой когорте было показано, что ИА увеличивается почти в 5 раз от молодых людей в возрасте 20 лет до пожилых людей в возрасте 96 лет [29]. Как и при cfPWV, увеличение ИА с возрастом нелинейно.

Рис. 2. Скорость распространения пульсовой волны между плечом и лодыжкой (baPWV) измерялась у мужчин (красный цвет) и женщин (синий цвет) в возрасте от 60 до 95 лет. baPWV увеличивается с возрастом, но не различается у лиц разного пола. Адаптировано из Sang Y. c соавторами [27]
Предыдущие исследования показали, что cfPWV увеличивается значительнее у лиц в возрасте 50 лет и старше, в то время как ИА увеличивается более заметно у лиц моложе 50 лет [26]. Увеличение ИА у пожилых людей, вероятно, замедляется из-за изменения градиента жесткости центральных и периферических артерий. Жесткость центральных артерий последовательно увеличивается с возрастом и в конечном итоге превышает жесткость периферических артерий у пожилых людей [26]. Это изменение смещает отражающую точку дистально, тем самым уменьшая приращения ИА. Существуют две поворотные точки для возрастных изменений в ИА. Сначала это происходит в подростковом возрасте, когда возрастное снижение ИА прекращается и превращается в возрастное увеличение, затем в среднем возрасте, когда скорость увеличения ИА снижается.
Таким образом, ИА с большей вероятностью является показателем возрастной жесткости артерий у людей старше 18 лет, тогда как cfPWV отражает динамику возрастной жесткости артерий на протяжении всей жизни.
Другие методы определения жесткости артерий
Недавние исследования предложили новый ультразвуковой метод в A-режиме, названный оценкой жесткости артерий для неинвазивного скрининга (ARTSENS). Это бесконтактное устройство для измерения толщины артериальной стенки на основе моделирования смесью Гаусса. В более чем десяти опубликованных статьях заявлено о преимуществах ARTSENS в клинических приложениях, включая его портативность, высокую пропускную способность и эффективность при оценке сосудистой стенки и жесткости, но крупное когортное клиническое исследование еще не дало каких-либо окончательных результатов [30].
Лабораторная диагностика возрастной ангиопатии
В дополнение к оценке возрастных структурных и функциональных изменений сосудов с помощью сложных и дорогостоящих методов измерение биомаркеров крови является еще одним способом косвенной оценки возрастной ангиопатии. В следующем разделе авторы выделяют несколько часто используемых биомаркеров.
Эндотелиальные прогениторные клетки
Считается, что эндотелиальная прогениторная клетка (ЭПК), предшественница эндотелиальных клеток, происходит из костного мозга. ЭПК рекрутируются в место повреждения, где они дифференцируются в эндотелиальные клетки, тем самым регенерируя поврежденный эндотелий [3131].
Количество колоний ЭПК было идентифицировано как независимый предиктор поток-опосредованной вазодилатации. Количество колоний ЭПК было примерно в 3 раза выше у субъектов с более высоким уровнем ПОВ, чем у пациентов с низким уровнем ПОВ. Более того, ЭПК коррелируют с жесткостью и эластичностью артерий. Помимо подсчета количества ЭПК, изменения ЭПК в их функциях также связаны со старением сосудов. Пролиферативная и миграционная способность ЭПК линейно снижается с увеличением baPWV. Зависящее от возраста увеличение ТКИМ сонных артерий отрицательно связано с функцией ЭПК, и выживаемость ЭПК у пожилых людей с увеличением ТКИМ сонных артерий значительно снижается в исследовании на основе здоровой популяции. Соответственно, ЭПК, по-видимому, являются суррогатным биологическим маркером для прогнозирования старения сосудов [32].
Длина теломер
Теломера расположена в конце каждой эукариотической хромосомы для поддержания генетической целостности. Когда длина теломер укорачивается до критической области, клетка навсегда теряет способность к делению и вступает в стадию старения. Таким образом, истощение теломер считается признаком репликативного старения или хронологического старения, а также участвует в некоторых случаях преждевременного или ускоренного старения [33].
Длина теломер лейкоцитов (ДТЛ) крови тесно связана с ТКИМ сонных артерий и cfPWV, следовательно, ДТЛ служит косвенным маркером старения сосудов. Корреляция ДТЛ с ТКИМ сонных артерий была протестирована у здоровых пожилых людей, не имеющих сердечно-сосудистых заболеваний, а также у пациентов с гипертонией и сахарным диабетом [34Ошибка! Источник ссылки не найден.]. ДТЛ отрицательно коррелирует с cfPWV после исключения известных сопутствующих факторов, таких как пол, менопаузальный статус, артериальное давление, уровень глюкозы и липидов в крови [35], следовательно, считается лучшим показателем биологического старения сосудистой сети, чем хронологический возраст у пациентов с сердечно-сосудистыми повреждениями.
Конечные продукты гликирования
Конечные продукты гликирования (КПГ) представляют собой гетерогенные соединения, образующиеся в результате неферментативных реакций гликозилирования между восстанавливающими сахарами и аминогруппой белков. Они накапливаются в сосудистой стенке в процессе старения и способствуют повышению жесткости артерий путем сшивания с коллагеновыми волокнами. Однако эндотелиальные клетки экспрессируют рецепторы конечных продуктов (РКПГ). Активированный комплекс КПК-РКПГ вызывает воспаление сосудов и окислительный стресс, что в конечном итоге приводит к эндотелиальной дисфункции. РКПГ может расщепляться до растворимой формы, растворимого РКПГ, у которого отсутствует закрепляющий мембрану домен, следовательно, он циркулирует в крови. Связывание растворимых РКПГ с КПГ действует доминантно-негативно, нейтрализуя вредное воздействие КПГ на сосуды [36]. Повышенный уровень КПГ в крови независимо был связан с повышенной жесткостью артерий как у здоровых людей, так и у больных сахарным диабетом и гипертонической болезнью.
Сообщалось об ускоренном возрастном увеличении cfPWV у людей с низким уровнем циркулирующего растворимого РКПК [37]. Исходя из этих результатов, комбинация растворимого РКПК с оценкой каротидно-феморальной скорости пульсовой волны должна предоставлять более полную информацию, чем отдельный функциональный метод, при оценке возрастной ангиопатии. В подтверждение этого соотношение отложения КПК на коже и растворимого РКПК является лучшим предиктором жесткости артерий, чем показатель в крови [38].
С-реактивный белок
С-реактивный белок (СРБ) является биомаркером воспаления, который линейно коррелирует с cfPWV, кровотоком в предплечье и ИА [39Ошибка! Источник ссылки не найден.Ошибка! Источник ссылки не найден.]. Уровень CРБ в сыворотке крови пожилых людей без ЦССЗ повышается при cfPWV, и ИА увеличивается примерно на 35% – с 0,6 мг/л до 3,6 мг/л СРБ.
Важно знать, что однократная оценка концентрации СРБ вряд ли даст достоверную информацию, поскольку уровень СРБ зависит от других факторов, таких как возраст, пол и наличие инфекции [5, 40]. Однако показано, что совокупный уровень СРБ является надежным маркером в прогнозировании артериальной жесткости [40]. Подводя итог, можно сказать, что те клеточные и молекулярные маркеры, которые ассоциируются со структурными и функциональными изменениями сосудов, связанными с возрастом.
Кровеносные сосуды изменяют свою структуру, функцию и эластичность в процессе старения человека. Эти изменения можно обнаружить и визуализировать для непосредственной оценки степени старения сосудов: 1) структура: увеличиваются как толщина артериальной стенки, так и диаметр; 2) функция: эндотелийзависимая вазодилатация, вызванная ацетилхолином или реактивной гиперемией, становится десенсибилизированной; 3) сосудистая податливость: жесткость, которая измеряется с помощью PWV или ИА, повышается. В дополнение к функциональным измерениям лабораторные исследования могут предоставить множество других косвенных биомаркеров или индикаторов возрастной ангиопатии (например, эндотелиальные клетки-предшественники, лимфоцитарные теломеры, конечные продукты гликирования и С-реактивный белок), поскольку данные биомаркеры хорошо коррелируют с функциональными измерениями.
Заключение
Подводя итог, можно сказать, что возрастная ангиопатия – это многомерный процесс, который требует комплексного набора диагностических параметров для применения в клинической практике.
Библиографическая ссылка
Суржиков П.В., Кицышин В.П., Варавин Н.А., Новиков И.И. ФУНКЦИОНАЛЬНАЯ И ЛАБОРАТОРНАЯ ДИАГНОСТИКА ВОЗРАСТНОЙ АНГИОПАТИИ // Современные проблемы науки и образования. 2024. № 4. ;URL: https://science-education.ru/ru/article/view?id=33573 (дата обращения: 20.02.2026).
DOI: https://doi.org/10.17513/spno.33573



