Введение
Алкогольная кардиомиопатия (АКМП) - это результат злоупотребления алкоголем и связанное с ним поражение сердца и других внутренних органов [1; 2, c. 231]. Диагностика и лечение фибрилляции предсердий (ФП) при АКМП сохраняет свою актуальность в связи с высокой частотой распространения данной патологии и сочетанным поражением проводящих структур сердца [3; 4]. Сюда следует отнести нарушение функции синусового узла и атриовентрикулярной (АВ) проводимости, продольную диссоциацию АВ-узла, наличие аномальных путей проведения и «рваного ритма», а также нарушение тонуса симпатической и парасимпатической нервной системы, электролитного баланса и кислотно-щелочного равновесия [5-7]. Большинство авторов для количественного анализа экстрасистол, частоты пароксизмов ФП, нарушений проводящей системы сердца применяют холтеровское мониторирование электрокардиограммы (ХМЭКГ), однако данная методика имеет низкую чувствительность при оценке ЭФ-показателей проводящей системы сердца [8-10]. Применение чреспищеводного электрофизиологического исследования сердца (ЧпЭФИ) на фоне медикаментозной вегетативной блокады сердца (МВБС) позволяет качественно и количественно оценить состояние проводящей системы сердца у больных с фибрилляцией предсердий (ФП) на фоне АКМП.
Несмотря на множество работ, посвященных данной тематике, до сих пор остаются неизученными электрофизиологические показатели сердца у пациентов с ПФП на фоне алкогольной кардиомиопатии. Не изучены функции СА-узла, состояние АВ-проводимости, не выделены типы кривых АВ-проведения, а также не проводился анализ воздействия антиаритмических препаратов на проводящую систему сердца у данной категории больных.
С учетом изложенного целью настоящего исследования явилось изучение возможностей ХМЭКГ, ЧпЭФИ сердца, медикаментозной вегетативной блокады сердца для оценки функции синусового узла, дискретности проведения возбуждения по атриовентрикулярному узлу, эффективности ААТ у больных с пароксизмами ФП при АКМП.
Материалы и методы исследования
Обследованы 87 больных (25 женщин и 62 мужчины) в возрасте от 32 до 64 лет (в среднем 43,5±1,8 года) с АКМП и ЭКГ-документированной ФП, предсердной экстрасистолией с дискретным проведением возбуждения по АВ-узлу и «рваным» ритмом во время аритмии.
Причиной аритмии у всех пациентов являлось злоупотребление алкоголя. В исследование не включались больные с ИБС, гипертонической болезнью, активным воспалительным процессом в миокарде, клапанными поражениями, выраженной недостаточностью кровообращения и патологией щитовидной железы.
Всем пациентам проводились ХМЭКГ, ЧпЭФИ сердца, медикаментозная вегетативная блокада сердца (МВБС) по A. Jose. Все больные заполняли анкету – опросник «Cage».
По результатам ХМЭКГ оценивалось количество ПФП и экстрасистол. Анализировался интервал P-Q предсердных экстрасистол и рассчитывалось время дискретного проведения возбуждения по АВ-узлу. Вычислялась средняя частота сердечных сокращений (ЧСС) во время ФП и время восстановления синусового узла после прекращения аритмии. Если ЧСС во время ФП уменьшалась более чем в 2-3 раза от среднего значения, то аритмию оценивалась как «рваный» ритм, и для исключения синдрома слабости синусового узла проводилось ЧпЭФИ сердца.
ЧпЭФИ проводилось во внеприступном периоде на фоне полной отмены кардиотропных препаратов (не менее чем за 48 часов). Определялось время восстановления функции синусового узла (ВВФСУ), эффективный рефрактерный период АВ-соединения, предсердий, быстрого (β) и медленного (α) путей. На основании полученных данных рассчитывалось корригированное время восстановления функции синусового узла (КВВФСУ), величина разрыва кривой АВ-проведения и типы кривых АВ-проведения. Если во время программированной стимуляции при уменьшении интервала St1-St2 разовый прирост St2-R2 не превышал 80 мс, диагностировался 1-й (непрерывный) тип кривой АВ-проведения, а если превышал 80 мс, то диагностировался 2-й (прерывистый или дискретный) тип кривой АВ-проведения.
Медикаментозная вегетативная блокада сердца (МВБС) проводилась по методике A. Jose и D. Collison, которая заключалась во внутривенном введении пропранолола в дозе 0,2 мг на 1 кг массы тела, а затем через 10 минут атропина в дозе 0,04 мг на 1 кг массы тела [11, c. 37]. Освобожденные от вегетативных влияний синусовый и АВ-узлы отражали истинную функцию синусового и АВ-узлов, которые оценивали по КВВФСУ, ЭРП β и α каналов и типу кривых АВ-проведения.
ХМЭКГ и полную программу ЧпЭФИ на фоне МВБС повторяли через 1-2 месяца при применении метопролола, пропафенона и метопролола с пропафеноном.
Эффективность проводимой терапии оценивалась по результатам ХМЭКГ, если частота экстрасистол и ПФП снижалась на 70,0% и более.
Математическая обработка полученных данных проводилась в программах Excel (Microsoft Office 2013) и StatSoft Statistica 13. Для характеристики количественных переменных применяли среднее арифметическое значение ± стандартное отклонение (M±m). Для проверки выборок на нормальное распределение использовали критерий Колмогорова-Смирнова. С целью выявления независимых предикторов рецидивирования ФП использовали многофакторный анализ. Для оценки влияния показателей использовали ROC-анализ с площадью под кривой. Пороговые значения для количественных предикторов устанавливали на основе ROC-анализа при оптимальном соотношении чувствительности и специфичности.
Уровень статистической значимости для всех видов анализа расценивали как p<0,05.
Результаты исследования и их обсуждение
Исследование проводилось на фоне антикоагулянтной терапии варфарином в два этапа. На первом этапе проводилась оценка влияния метопролола, пропафенона и комбинации метопролола с пропафеноном на ЭКГ и ЭФ-показатели сердца (табл. 1).
Таблица 1
ЭКГ и ЭФ-показатели сердца у больных с пароксизмами ФП при АКМП (M±m)
|
Показатели |
Исход (n=87) |
В+М (n=87) |
В+П (n=87) |
В+М+П (n=87) |
|
1 |
2 |
3 |
4 |
|
|
ЧСС, мин. |
76,0±1,53 |
74,2±1,62 |
73,0±1,45 |
71,2±1,23 |
|
Зубец P, мс |
80,8±1,2 |
81,7±1,08 |
84,7±1,13 |
90,6±1,27 |
|
Интервал PQ, мс |
153,8±2,8 |
160,5±3,2 |
159,9±3,4 |
164,5±3,9 |
|
Комплекс QRS, мс |
87,5±0,82 |
85,9±0,68 |
86,2±1,02 |
87,4±1,3 |
|
Интервал QT, мс |
420,0±3,9 |
387,4±3,1 |
360,9±3,0 |
330,7±2,9 |
|
КВВФСУ, мс |
243,5±7,47 |
252,8±6,8 |
284,9±9,1 |
311,2±11,5 |
|
ЭРППр, мс |
208,1±8,44 |
223,8±7,1 |
258,8±10,6 |
303,3±12,1 |
|
ЭРП α пути, мс |
216,0±7,8 |
231,8±6,2 |
263,3±9,5 |
296,2±10,3 |
|
ЭРП β пути, мс |
263,5±9,6 |
291,7±9,5 |
322,8±11,4 |
357,3±12,6 |
|
Величина разрыва кривой АВ проведения, мс |
105,7±7,6 |
76,5±6,9 |
69,8±6,5 |
75,7±8,0 |
|
1-й тип кривой АВ проведения, n (%) |
32 (36,8) |
48(55,2) |
50 (57,5) |
53 (60,9) |
|
2-й тип кривой АВ проведения, n (%) |
55 (63,2) |
39 (44,8) |
37 (42,5) |
34 (39,1) |
|
χ2 с поправкой Йетса |
|
χ2=5,21 р=0,023 |
χ2=6,67 |
χ2=9,2 |
|
Количество ЭС, сутки |
530,2±34,3 |
555,3±44,2 |
223,4±19,3 |
161,3±16,7 |
|
Частота ПФП, год |
20,2±0,93 |
17,3±0,91 |
6,1±0,31 |
6,0±0,25 |
|
Время ПФП, мин. |
29,4±0,67 |
20,8±0,80 |
22,8±0,91 |
6,2±0,32 |
Примечания. Достоверность различий средних величин: *-p<0,05, +p<0,01, #-p<0,001. В – варфарин, М – метопролол, П – пропафенон.
Анализ автоматической функции синусового узла показал, что метопролол с пропафеноном уменьшает ЧСС на 6,4% (p<0,05). Пропафенон увеличивает КВВФСУ на 17,0% (p<0,001), метопролол с пропафеноном – на 27,8% (p<0,001).
При изучении состояния предсердной проводимости выявлено, что ширину зубца Р пропафенон увеличивает на 4,8% (p<0,05), метопролол с пропафеноном - на 12,1% (p<0,001), ЭРППр - на 24,4% (p<0,001) и 45,7% (p<0,001), соответственно.
Исследования показали, что интервал QT метопролол уменьшает на 7,8% (p<0,001), пропафенон – на 14,1% (p<0,001), метопролол с пропафеноном – на 21,3% (p<0,001).
При изучении электрофизиологических свойств АВ-соединения выявлено функционирование α и β путей, 1-й и 2-й типы кривых АВ-проведения.
Выявлено, что ЭРП α и β путей пропафенон увеличивает на 21,9% (p<0,001) и 22,2% (p<0,001), метопролол с пропафеноном – на 37,1% (p<0,001) и 35,6% (p<0,001), соответственно. Исходно 1-й тип кривой АВ-проведения был выявлен у 32 (36,8%) больных, 2-й тип – у 55 (63,2%%). Это соотношение на фоне метопролола составило 48(55,2%) и 39 (44,8%) (χ2=5,21, р=0,023), пропафенона – 50 (57,5%) и 37 (42,5%) (χ2=6,67, р=0,0098), метопролола с пропафеноном - 53 (60,9%) и 34 (39,1%) (χ2=9,2, р=0,0024) пациентов соответственно.
Как известно, при синдроме брадикардия – тахикардия наблюдается не только дисфункция синусового узла, но и замедление АВ-проводимости в виде возникновения эпизодов «рваного» ритма. Очевидно, на фоне АВ диссоциации на α и β пути во время синусового ритма возникает дискретное проведение возбуждения по АВ-узлу, а во время ФП в результате распространения волны возбуждения по медленному каналу возникает уменьшение ЧСС в виде «рваного» ритма и увеличение интервала QT. Метопролол и пропафенон, вызывая блокаду проведения возбуждения по α каналу, способствуют трансформации дискретного типа проведения возбуждения в АВ-узле в непрерывный тип во время синусового ритма, исчезновению эпизодов «рваного» ритма, нормализации ЧСС и уменьшению интервала QT при ФП.
Количество пароксизмов ФП на фоне метопролола уменьшилось на 14,2%, пропафенона – на 69,7%, комбинации метопролола с пропафеноном – на 70,4%. Побочные проявления от ААТ не встречались.
На втором этапе исследования для уточнения ЭФ-механизмов дискретного проведения возбуждения по АВ-узлу, «рваного» ритма и нарушения процесса реполяризации у больных с пароксизмами ФП при АКМП проводилась МВБС по A. Jose. По результатам исследования были выделены три типа реакции автоматической функции синусового узла и АВ-проводимости на МВБС. Результаты исследования представлены в таблицах 2-4.
В таблице 2 представлены ЭКГ и ЭФ-показатели сердца у 24 больных (27,6%) с 1-м типом реакции СУ и АВ-проводимости на МВБС.
Таблица 2
ЭКГ и ЭФ-показатели сердца у больных с пароксизмами ФП при АКМП при 1-м типе реакции СУ и АВ-проводимости на МВБС (M±m)
|
Показатели |
1-й тип реакции СУ и АВ-проводимости на МВБС (n=24) |
|||
|
Исход |
В+М |
В+П |
В+М+П |
|
|
5 |
6 |
7 |
8 |
|
|
ЧСС, мин. |
77,6±1,70 |
76,3±1,73 |
73,4±1,25 |
70,3±1,23 |
|
Зубец P, мс |
85,5±1,17 |
85,2±1,33 |
90,6±1,08 |
95,2±1,34 p7-8+ |
|
Интервал PQ, мс |
155,9±3,1 |
156,8±2,6 |
166,4±3,4 |
168,3±3,5 |
|
Комплекс QRS, мс |
87,9±0,76 |
85,0±0,64 |
86,5±0,97 |
86,3±1,2 |
|
Интервал QT, мс |
413,9±3,3 |
381,8±3,2 |
354,4±3,1 |
323,1±2,5 |
|
КВВФСУ, мс |
246,4±8,1 |
246,4±8,1 |
296,1±10,0 |
319,2±10,6 |
|
ЭРППр, мс |
205,6±9,6 |
229,4±8,4 |
253,2±11,0 |
284,9±11,8 |
|
ЭРП α пути, мс |
218,8±7,4 |
235,1±6,5 |
274,4±8,4 |
305,2±10,7 |
|
ЭРП β пути, мс |
258,2±9,0 |
293,2±8,8 |
317,7±11,8 |
376,0±12,8 |
|
Величина разрыва |
95,8±7,2 |
72,9±7,0 |
63,6±6,2 |
65,6±7,5 |
|
1-й тип кривой АВ проведения, n (%) |
6 (25,0) |
17 (70,8) |
17 (70,8) |
18 (75,0) |
|
2-й тип кривой АВ проведения, n (%) |
18 (75,0) |
7 (29,2) |
7 (29,2) |
6 (25,0) |
|
χ2 с поправкой Йетса |
|
χ2=8,35 |
χ2=8,35 |
χ2=10,08 |
|
Количество ЭС, сутки |
702,4±52,0 |
628,1±49,5 |
252,1±17,6 |
191,3±18,3 |
|
Частота ПФП, год |
21,2±0,87 |
16,6±0,89 |
6,3±0,30 |
6,7±0,28 |
|
Время ПФП, мин. |
28,9±0,76 |
21,7±0,95 |
21,9±0,93 |
5,9±0,24 |
Сравнительная оценка полученных данных в таблицах 1, 2 показала, что при МВБС 1-го типа статистически значимых (p>0,05) изменений в ЭКГ и ЭФ-показателях сердца не происходит.
На фоне приема пропафенона, метопролола с пропафеноном уменьшилась ЧСС на 5,4% (p5-7<0,05) и 9,5% (p5-8<0,001), но увеличилось КВВСУ на 20,2% (p5-7<0,001) и 29,5% (p5-8<0,001), ширина зубца Р - на 5,9% (p5-7<0,001) и 11,3% (p5-8<0,001), ЭРППр - на 23,2% (p5-7<0,001) и 38,7% (p5-8<0,001), а также ЭРП α и β путей - на 26,8% (p5-7<0,001), 41,1% (p5-8<0,001) и 23,1% (p5-7<0,001), 45,6% (p5-8<0,001) соответственно.
Величина разрыва кривой АВ-проведения на фоне ААТ уменьшилась от 100 до 75 мс (p<0,05). Исходно непрерывный тип кривой АВ-проведения был у 6 (25,0%) больных, а прерывистый – у 18 (75,0%). На фоне метопролола это отношение составило 17 (70,8%) и 7 (29,2%) (χ2=8,35, р=0,0039), пропанорма - 17 (70,8) и 7 (29,2) (χ2=8,35, р=0,0039), метопролола с пропафеном - 18 (75,0) и 6 (25,0) (χ2=10,08, р=0,0015) соответственно. Частота пароксизмов ФП на фоне пропафена и метопролола с пропафеноном уменьшилась на 70,0% и более, без побочных эффектов препаратов.
2-й тип реакции СУ и АВ-проводимости на МВБС выявлен у 30 (34,5%) больных (табл. 3).
Таблица 3
ЭКГ и ЭФ-показатели сердца у больных с пароксизмами ФП при АКМП при 2-м типе реакции СУ и АВ-проводимости на МВБС (M±m)
|
Показатели |
2-й тип реакции СУ и АВ-проводимости на МВБС (n=30) |
|||
|
Исход |
В+М |
В+П |
В+М+П |
|
|
9 |
10 |
11 |
12 |
|
|
ЧСС, мин. |
84,0±1,8 |
81,1±2,21 p2-10+ |
78,7±1,56 |
75,9±1,80 |
|
Зубец P, мс |
89,3±1,1 |
90,3±1,51 p2-10# |
97,8±1,41 |
99,6±1,24 |
|
Интервал PQ, мс |
149,6±2,6 |
152,4±2,8 |
156,3±3,1 |
158,2±3,6 |
|
Комплекс QRS, мс |
86,2±0,82 |
87,65±0,61 |
88,3±1,1 |
89,1±1,3 |
|
Интервал QT, мс |
422,5±3,3 |
394,0±3,7 |
360,4±3,0 |
330,5±2,5 |
|
КВВФСУ, мс |
218,6±7,7 |
220,8±5,6 |
257,1±8,4 |
272,6±8,6 p9-12#,p11-12# |
|
ЭРППр, мс |
183,3±7,3 |
203,6±7,2 |
227,7±9,3 |
259,4±12,3 p11-12* |
|
ЭРП α пути, мс |
195,7±7,5 |
208,4±7,6 |
237,3±8,4 |
274,5±8,7 |
|
ЭРП β пути, мс |
240,8±8,9 |
266,5±8,2 |
283,0±11,3 |
344,5±12,2 |
|
Величина разрыва |
108,8±5,8 |
73,1±7,5 p9-10# |
61,9±5,7 |
68,4±5,4 |
|
1-й тип кривой АВ проведения, n (%) |
12 (40,0) |
21 (70) |
23 (76,7) |
24 (80) |
|
2-й тип кривой АВ проведения, n (%) |
18 (60,0) |
9 (30) |
7 (23,3) |
6 (20) |
|
χ2 с поправкой Йетса |
|
χ2=4,31 |
χ2=6,86 |
χ2=8,4 |
|
Количество ЭС, |
803,2±52,0 |
710,6±51,8 |
360,4±3,0 |
330,5±2,5 |
|
Частота ПФП, год |
20,6±1,2 |
16,7±0,88 p9-10# |
6,3±0,31 |
6,4±0,27 |
|
Время ПФП, мин. |
30,2±0,87 |
20,5±0,94 p9-10# |
21,6±0,89 |
6,9±0,31 |
При сравнении ЭКГ и ЭФ-показателей в таблицах 1, 3 выявлены следующие различия. Средняя ЧСС была больше на 10,4% (p1-9<0,001), а КВВФСУ меньше на 10,2% (p1-9<0,05).
Ширина зубца Р была больше на 10,5% (p1-9<0,001), ЭРППр короче на 11,9% (p1-9<0,05). В то же время ЭРП α и β путей, величина разрыва кривой АВ-проведения, типы кривых АВ-проведения достоверно не различались (p>0,05).
У больных со 2-м типом реакции (табл. 3) на фоне приема метопролола, пропафенона, метопролола с пропафеноном достоверно (p<0,05) уменьшалась ЧСС и увеличилось КВВФСУ, увеличилась ширина зубца Р и ЭРППр, уменьшился интервал QT, увеличился ЭРП β и α путей. Величина разрыва кривой АВ-проведения в исходе была больше 100 мс, а на фоне ААТ стала меньше 80 мс. В исходе 1-й тип кривой АВ-проведения был у 12 (40,0%) больных, а 2-й тип - у 18 (60,0%), а на фоне метопролола это соотношение составило 21 (70%), 9 (30%) (χ2=4,31, р=0,0379), пропафенона - 23 (76,7%), 7 (23,3%), (χ2=6,86, р=0,0088), метопролола с пропафеноном - 24 (80%), 6 (20%), (χ2=8,4, р=0,0037) соответственно. Частота пароксизмов ФП при приеме пропафенона и метопролола с пропафеноном уменьшилась на 70,0% и более без побочных проявлений.
3-й тип реакции проводящей системы сердца на МВБС выявлен у 33 (37,9%) больных (табл. 4).
Таблица 4
ЭКГ и ЭФ-показатели сердца у больных с пароксизмами ФП при АКМП при 3-м типе реакции СУ и АВ-проводимости на МВБС (M±m)
|
Показатели |
3-й тип реакции СУ и АВ-проводимости на МВБС (n=33) |
|||
|
Исход |
В+М |
В+П |
В+М+П |
|
|
13 |
14 |
15 |
16 |
|
|
ЧСС, мин. |
69,1±1,61 |
68,8±1,39 |
67,4±1,36 |
67,7±1,23 |
|
Зубец P, мс |
93,6±1,24 |
94,4±1,48 |
99,8±1,35 |
106,1±1,44 |
|
Интервал PQ, мс |
138,4±2,3 |
141,9±2,9 |
146,9±2,9 |
150,5±3,4 |
|
Комплекс QRS, мс |
89,0±1,32 |
88,4±1,35 |
92,0±1,5 |
90,4±1,26 |
|
Интервал QT, мс |
424,6±3,8 |
394,4±2,6 |
367,7±2,9 |
333,2±2,5 |
|
КВВФСУ, мс |
273,0±8,1 |
287,4±6,9 |
315,6±11,1 |
356,7±11,3 |
|
ЭРППр, мс |
182,5±7,0 |
194,2±7,3 |
223,7±8,6 |
268,8±10,1 |
|
ЭРП α пути, мс |
235,0±8,7 |
237,6±6,6 |
296,0±9,7 |
327,9±10,9 |
|
ЭРП β пути, мс |
262,1±10,5 |
292,7±9,7 |
338,3±12,8 |
377,8±13,0 |
|
Величина разрыва |
108,5±6,7 |
77,4±7,3 |
65,6±6,1 |
63,6±7,6 |
|
1-й тип кривой АВ проведения, n (%) |
10 (35,7) |
19 (67,9) |
20 (71,4) |
21 (75,0) |
|
2-й тип кривой АВ проведения, n (%) |
18 (64,3) |
9 (32,1) |
8 (28,6) |
7 (25,0) |
|
χ2 с поправкой Йетса |
|
χ2=4,58 |
χ2=5,82 |
χ2=7,23 |
|
Количество ЭС, сутки |
834,2±60,8 |
591,2±57,0 |
268,4±17,2 |
210,8±19,5 |
|
Частота ПФП, год |
21,0±0,90 |
18,2±0,89 |
6,1±0,33 |
5,8±0,36 |
|
Время ПФП, мин. |
29,8±0,82 |
20,0±0,86 |
23,5±1,06 |
6,1±0,35 |
При сравнительной оценке полученных данных в таблицах 1 и 4 выявлено, что при 3-м типе реакции ЧСС была ниже на 9,2% (p1-13<0,001), КВВФСУ было больше на 12,4% (p1-13<0,01). Ширина зубца Р была больше на 15,8% (p1-13<0,001), ЭРППр короче на 12,3% (p1-13<0,05). ЭРП α и β путей, разрывы кривых АВ-проведения, типы кривых АВ-проведения статистически значимо не отличались (p>0,05).
Исходно 1-й тип кривой АВ-проведения наблюдался у 10 (35,7%) больных, 2-й тип - у 18 (64,3%), а на фоне метопролола это соотношение составило 19 (67,9%) и 9 (32,1) (χ2=4,58, р=0,0324), пропафенона – 20 (71,4%) и 8 (28,6%) (χ2=5,82, р=0,0151), метопролола с пропафеноном - 21 (75,0%) и 7 (25,0%) (χ2=7,23, р=0,0072) соответственно. Проводимая терапия пропафеноном и метопролола с пропафеноном привела к уменьшению количества ПФП на 70,0% и более без побочных проявлений.
Многие исследователи указывают, что автоматизм сердца наиболее быстро происходит в синусовом узле (СУ), и это связано со спонтанной диастолической деполяризацией. Вегетативная нервная система через афферентные миелинизированные волокна оказывает модулирующее влияние на СУ. Очевидно, при хронической алкогольной интоксикации в результате демиелинизации волокон симпатической и парасимпатической регуляции сердца формируется 1-й тип реакции СУ на МВБС. Если демиелинизация происходит преимущественно вагусной регуляции сердца, то возникает 2-й тип, а симпатической - 3-й тип реакции СУ на МВБС. Следует отметить, что при всех трех типах реакции СУ на МВБС угнетение автоматической функции СУ мы не выявили, что позволило заключить об отсутствии связи между эпизодами «рваного» ритма с функциональным состоянием СУ.
Полученные данные также указывают, что у больных с ФП при АКМП в результате демиелинизации симпатических и парасимпатических волокон МВБС не влияет на рефрактерные периоды медленного и быстрого путей, величину разрыва и типы кривых АВ-проведения. Следовательно, можно предположить, что у больных с пароксизмами ФП при АКМП продольная диссоциация АВ-узла на быстрый и медленный пути является субстратом возникновения «рваного» ритма с уменьшением ЧСС и удлинения интервала QT. Результаты ААТ подтвердили выявленную закономерность. На фоне ААТ возникла трансформация дискретного проведения возбуждения в непрерывный тип с уменьшением эпизодов «рваного» ритма, увеличением ЧСС и уменьшением интервала QT.
При анализе полученных данных возникает вопрос, есть ли связь между величиной разрыва кривой АВ-проведения, продолжительностью интервала QT и частотой и продолжительностью экстрасистолической аритмии и пароксизмов ФП. Проведенный многофакторный регрессионный анализ показал, что имеется очень тесная взаимосвязь (табл. 5).
Таблица 5
Множественный регрессионный анализ
|
Показатель |
ß |
t |
p |
|
Количество ЭС – зависимая переменная Скорректированное значение R2 = 0,92 |
|||
|
Величина разрыва кривой АВ-проведения, мс |
0,557662 |
4,26898 |
0,000192 |
|
Интервал QT, мс |
0,423663 |
3,24320 |
0,002971 |
|
Частота ПФП – зависимая переменная Скорректированное значение R2 = 0,98 |
|||
|
Величина разрыва кривой АВ-проведения, мс |
0,237778 |
4,0330 |
0,000366 |
|
Интервал QT, мс |
0,768835 |
13,0404 |
0,000000 |
|
Время ПФП – зависимая переменная Скорректированное значение R2 = 0,94 |
|||
|
Величина разрыва кривой АВ-проведения, мс |
0,653537 |
5,994754 |
0,000002 |
|
Интервал QT, мс |
0,337888 |
3,099373 |
0,004285 |
Полученные результаты множественного регрессионного анализа свидетельствуют (табл. 5), что увеличение разрыва кривой АВ-проведения и интервала QT являются факторами возникновения и учащения экстрасистолии и приступов ФП у больных с АКМП.
Для установления порогового значения разрыва кривой АВ-проведения и интервала QT при ФП мы провели ROC-анализ (рис. 1, 2).
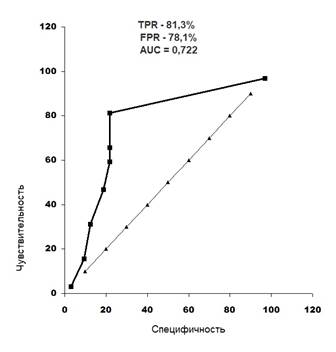
Рис. 1. ROC-кривая, отражающая пороговый характер разрыва кривой АВ-проведения
Выявлено (рис. 1), что повышение разрыва кривой АВ-проведения больше чем 72,3 мс приводит к учащению ПФП при АКМП. TPR – 81,3%, FPR – 78,1%, AUC = 0,722.
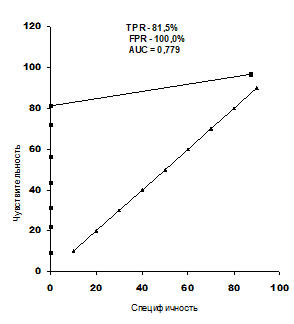
Рис. 2. ROC-кривая, отражающая пороговый характер интервала QT
Полученные результаты ROC–анализа показали, что удлинение интервала QT свыше 394 мс при ЧСС от 74 до 85 мин. вызывает увеличение количества экстрасистол и ПФП у больных с АКМП. TPR – 81,5%, FPR – 100,0%, AUC = 0,779.
Таким образом, в настоящее время патогенетические механизмы фибрилляции предсердий (ФП) у больных с алкогольной кардиомиопатией (АКМП) продолжают обсуждаться. Мы предполагаем, что нарушения атриовентрикулярной (АВ) проводимости и нарушение процессов реполяризации у больных с ФП при АКМП может быть связано с продольной диссоциацией АВ-узла на два канала, разрывом кривой АВ-проведения и удлинением интервала QT, что необходимо учитывать при назначении антиаритмических средств.
Выводы
1. У больных с пароксизмами фибрилляции предсердий (ПФП) на фоне алкогольной кардиомиопатии (АКМП) выявлены нормальная функция синусового узла, дискретное проведения возбуждения по АВ-узлу во время синусового ритма, эпизоды «рваного» ритма во время аритмии, удлинение интервала QT.
2. У больных с ПФП на фоне АКМП возникает три типа ответа синусового узла на медикаментозную блокаду сердца (МВБС). Первый тип возникает в 27,6% и характеризуется отсутствием влияния симпатической и парасимпатической нервной системы на функцию СУ. Второй тип встречается в 34,5% и связан с усилением влияния симпатической нервной системы на СУ. Третий тип выявляется в 37,9% и вызван преобладанием влияния парасимпатической нервной системы на СУ.
3. У больных с ПФП на фоне АКМП МВБС не оказывает влияния на электрофизиологические показатели медленного и быстрого путей, величину разрыва кривой и типы кривых атриовентрикулярного (АВ) проведения во время синусового ритма, на частоту возникновения «рваного» ритма во время ПФП и продолжительность интервала QT.
4. Проведенный многофакторный анализ показал, что между ПФП при АКМП и величиной разрыва кривой АВ-проведения, интервалом QT имеется тесная связь. ROC-анализ выявил, что увеличение разрыва кривой АВ-проведения более чем 72,3 мс приводит к учащению ПФП при АКМП. TPR – 81,3%, FPR – 78,1%, AUC = 0,722. Установлено, что удлинение интервала QT свыше 394 мс вызывает увеличение количества экстрасистол и ПФП у больных с АКМП. TPR – 81,5%, FPR – 100,0%, AUC = 0,779.
5. У больных АКМП, осложненной ПФП и продольной диссоциацией АВ-узла и удлинением интервала QT, к дополнительным критериям эффективности антиаритмических средств относятся трансформация дискретного проведения возбуждения по АВ-узлу в непрерывный тип и уменьшение интервала QT.
Библиографическая ссылка
Рахматуллов Р.Ф., Журавлева Е.Ю., Рахматуллов Ф.К. ОЦЕНКА ПРОВОДЯЩЕЙ СИСТЕМЫ СЕРДЦА И АНТИАРИТМИЧЕСКИХ СРЕДСТВ У БОЛЬНЫХ С ФИБРИЛЛЯЦИЕЙ ПРЕДСЕРДИЙ НА ФОНЕ АЛКОГОЛЬНОЙ КАРДИОМИОПАТИИ // Современные проблемы науки и образования. 2024. № 4. ;URL: https://science-education.ru/ru/article/view?id=33557 (дата обращения: 20.02.2026).
DOI: https://doi.org/10.17513/spno.33557



