Введение
Надпочечники являются частой локализацией как первичных, так и вторичных патологических процессов. Чрескожная биопсия надпочечников стала широко применяемой интервенционной процедурой еще с 1970-х годов. Эта процедура чаще всего проводится пациентам с подозрением на метастатические процессы, где точный патологический диагноз играет важную роль в постановке диагноза и назначении адекватной терапии. Большую роль она играет и при первичной патологии надпочечников, таких как нефункционирующие или функционирующие аденомы, инфекционные заболевания, кровоизлияния в надпочечники или первичные злокачественные опухоли [1-3].
Биопсия под контролем компьютерной томографии (КТ) получила широкое распространение как эффективная, безопасная и высокоточная процедура диагностики во многих клинических случаях [4; 5].
Чрескожная биопсия надпочечника с визуализацией обычно выполняется под контролем КТ различными доступами: передним чреспеченочным, боковым чреспеченочным, задним транспульмональным или трансплевральным, в зависимости от особенностей анатомии [6]. Достижения в области гистопатологии, оборудования для визуализации и устройств для биопсии сделали этот вопрос предметом постоянного интереса в радиологии. Одной из основных проблем данного метода является высокая лучевая нагрузка как на пациента, так и на врача-интервенциониста. Поэтому в настоящее время ведутся разработки различных роботизированных устройств для биопсии с целью сокращения длительности процедуры, с одной стороны, и возможности замены метода «свободных рук» - с другой, то есть отсутствия врача в зоне облучения [7; 8].
Материал и методы исследования. Разработанный авторами роботизированный аппарат представляет собой дугообразный кронштейн, установленный на раме, который может вращаться вместе с зажимом для крепления иглы для биопсии. Аппарат оснащен электроприводом, обеспечивающим перемещение всей системы в различных направлениях. Радиус каркаса держателя соответствует среднему радиусу тела пациента. По внешней окружности каркаса имеются кронштейны для крепления ремней и фиксации их на теле пациента. Описанная система позволяет надежно прикрепить все устройство к телу пациента и обеспечивает быстрое и точное введение иглы в интересующую область [9].
Для навигации использовалась КТ-система Aquilion Lightning (TSX-036A), Canon Medical Systems Corporation, имеющая в своем составе комплект для осуществления интервенционных процедур с контролем в режиме реального времени. Данная КТ-система включает модуль управления в отсеке для оператора, жидкокристаллический монитор, программное обеспечение для визуализации диагностических изображений, устройство для увеличения расстояния между гентри и столом, модуль корректировки скорости вращения гентри (до 0,5 сек.).
В группу исследования с биопсией роботизированным методом авторами было включено 18 пациентов: 14 мужчин и 4 женщины, в ретроспективную группу контроля – 19 пациентов: 16 мужчин и 3 женщины. В контрольной группе биопсия осуществлялась методом «свободной руки», то есть врач, находясь непосредственно рядом с обследуемым, продвигал иглу вручную и производил забор материала под постоянным контролем КТ. Возраст пациентов основной группы составил 55,4±5,5 года, контрольной группы – 57,7±4,8 года (р = 0,25); масса тела пациентов основной группы – 72,6±8,4 кг, пациентов контрольной группы – 75,5±7,6 кг (р=0,26).
Пациенты основной/контрольной групп достоверно не отличались по наличию сопутствующей патологии. Из сопутствующих заболеваний у 10/10 пациентов имелась ишемическая болезнь сердца, у 1/1 – хроническая обструктивная болезнь легких, у 5/7 – сахарный диабет, у 12/12 – гипертоническая болезнь. У 10 пациентов основной группы и у 11 пациентов контрольной группы имелась надпочечниковая недостаточность. У 8 пациентов основной группы и 8 пациентов контрольной группы содержание кортизола в крови соответствовало норме, у них патология надпочечников была диагностирована при обследовании по поводу лихорадки, болей в животе, снижения массы тела, генерализованной отечности, рецидивирующего воспаления мочевыводящей системы, артритов, а также в процессе наблюдения за злокачественными процессами другой локализации.
Исследование было одобрено локальным этическим комитетом медицинского института БелГУ 03.12.2019, протокол № 25. Перед каждым выполнением биопсии пациентами было подписано информированное согласие.
Перед каждой процедурой в обязательном порядке проводилось коагулогическое исследование крови. При двустороннем процессе биопсию проводили на стороне с большим очагом поражения или на той, где был возможен прямой доступ без травмы легкого, плевры или почек, а также чтобы вблизи места введения иглы не располагались крупные сосуды.
Пациент укладывался на компьютерном столе в пропозиции для прямого заднего доступа или на лежа на боку для косого заднего доступа, планировался маршрут введения иглы, который позволял избежать повреждения диафрагмы, почек, артерий и сосудов. Предварительно с этой целью производилась диагностическая КТ, а если поблизости от поражения надпочечника находился кровеносный сосуд, то исследование выполнялось с контрастным усилением. Перед началом исследования пациенту разъясняли правила задержки дыхания, желательно на середине вдоха, так как это снижает «эффект дыхания». Процедуру биопсии проводили под местной анестезией. Продвижение иглы осуществлялось автоматически роботизированным устройством у пациентов основной группы и методом «свободной руки» – у пациентов контрольной группы. КТ выполнялась в последовательном режиме с установленными низкими дозами 100–120 кВ и 30–50 мА с ограничением области визуализации только иглой и несколькими дополнительными срезами над и под ней для снижения дозы облучения.
После установки иглы над проблемным местом при обеих методиках производили забор нескольких образцов ткани в нескольких разных областях, что достигалось различным наклоном иглы. При подозрении на инфекционный процесс, помимо гистопатологии, проводились микробиологические исследования для исключения или подтверждения туберкулеза или грибкового заболевания. Также оценивались результаты КТ при различных видах поражений надпочечников, фиксировались размеры, контуры пораженного надпочечника, наличие кальцификаций и характер накопления контраста.
Статистическая обработка полученных результатов проводилась путем использования программного обеспечения SPSS (версия 20.0; IBM Corp., Армонк, Нью-Йорк, США) с лицензионным прикладным пакетом для статистического анализа Statistica 13. Показателем вариативности изучаемых признаков являлся диапазон (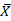 ± σ), при среднем значении
± σ), при среднем значении  и стандартном отклонении σ, что определялось количеством данных n в группе. Статистическая значимость результатов, учитывая малые размеры выборок, оценивалась непараметрическими методами. При этом использовался непараметрический U-критерий Манна - Уитни. Уровень р ≤ 0,05 считался статистически значимым.
и стандартном отклонении σ, что определялось количеством данных n в группе. Статистическая значимость результатов, учитывая малые размеры выборок, оценивалась непараметрическими методами. При этом использовался непараметрический U-критерий Манна - Уитни. Уровень р ≤ 0,05 считался статистически значимым.
Результаты исследования и их обсуждение. Обе группы пациентов не отличались по виду доступов к «зоне интереса» и их соотношению. В основной/контрольной группах биопсия левого надпочечника была произведена у 9/11 пациентов, правого – у 9/8 пациентов. Задний косой доступ использовали у 7/8 пациентов, прямой задний доступ без прохождения через легкое или плевру был возможен у 7/7 пациентов, чреспеченочный доступ использовали у 2/2 пациентов, трансплевральный – у 1/1 пациента и транспульмональный – у 1/1 пациента.
Положение тела на компьютерном столе при проведении биопсии отличалось у разных пациентов. Предпочтение отдавали пропозиции. Различные положения тела пациента при пункции, как и различные доступы к области надпочечников, широко освещены в литературе, и данные авторов совпадают с предыдущими результатами [10; 11].
В ряде случаев было необходимо положение на боку с целью смещения структур, по пути введения иглы, в частности легкого и нижней полой вены. В такой позиции легкое оказывалось в более низком положении и имело меньшую тенденцию к расширению, снижая риск развития пневмоторакса. При биопсии правого надпочечника, когда нижняя полая вена располагается по ходу введения иглы, левое боковое или наклонное положение способствовало ее смещению и облегчало доступ для биопсии.
Авторами приводится пример пункции левого надпочечника из заднего паравертебрального доступа с применением гидродиссекции тканей. На рис. 1. представлен процесс установки разработанного устройства в положении пациента на боку.
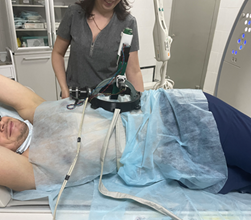
Рис. 1. Подготовка роботизированного устройства для core-биопсии новообразования надпочечника в положении пациента «лежа на боку»
псии авторы производили КТ в боковой наклонной позиции или лежа, от середины грудной клетки до нижнего полюса почки и выбирали направление продвижения иглы. В подкожную клетчатку вводили иглу 21-G и 5,0 мл 2% раствора лидокаина для местной анестезии. Делали небольшое рассечение кожи и с помощью роботизированного устройства проводили в подкожную клетчатку коаксиальную иглу 17-G. На уровне направляющей коаксиальной иглы для дальнейшего планирования процедуры проводили повторную КТ. Кончик коаксиальной иглы без стилета размещали в жировой прослойке между телом позвонка и плеврой и вводили 0,9% раствор натрия хлорида, смещая париетальную плевру и расширяя заднее паравертебральное пространство, одновременно продвигая иглу и контролируя ее ход последовательной КТ. Во время процедуры использовали минимальный объем физиологического раствора, 20–50 мл, необходимый для обеспечения безопасного продвижения иглы через пространство, образованное гидродиссекцией. Метод гидродиссекции не является изобретением авторов и описан в литературных источниках, в том числе и при биопсии надпочечников. Некоторые врачи-интервенционисты предлагают также метод пневмодиссекции [12]. В данном исследовании авторами применен метод гидродиссекции одновременно с использованием роботизированного устройства, о чем ранее в литературе не сообщалось.
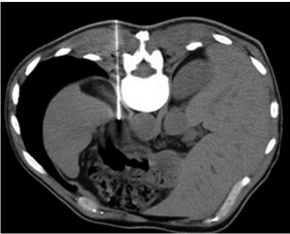
При задержке дыхания коаксиальный кончик иглы проходил диафрагму и располагался в непосредственной близости или внутри надпочечника (рис. 2). Затем, используя иглу 18-G, получали несколько фрагментов ткани. Забирали три фрагмента ткани, наклоняя иглу под разными углами. Количество фрагментов увеличивали, если первые не удовлетворяли по количеству ткани. В описанном выше случае не было отмечено каких-либо осложнений.
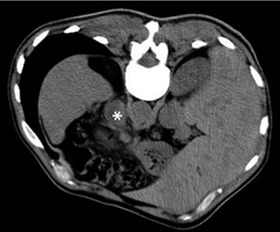
а б
Рис. 2. КТ-визуализация core-биопсии левого надпочечника паравертебральным доступом с использованием роботизированного устройства с применением гидродиссекции: а – аксиальная КТ брюшной полости в правом боковом положении пациента, гиподенсивный очаг в левом надпочечнике указан (*); б – кончик коаксиальной иглы проведен через диафрагму и располагается рядом с левым надпочечником
Ни один из 18 пациентов основной группы и 19 пациентов контрольной группы жалоб на выраженные болевые ощущения во время процедуры, в том числе при введении физиологического раствора, а также после процедуры не предъявляли. Осложнения были отмечены у 2 пациентов основной группы: у одного пациента – локальная гематома по ходу иглы, у другого – умеренный стабильный пневмоторакс. В контрольной группе у 1 пациента было диагностировано внутрибрюшное кровотечение, которое потребовало открытого оперативного вмешательства для его остановки. Это был пациент с обширным новообразованием правого надпочечника, которое инфильтрировало нижнюю полую вену гистопатологически лимфомой.
Размеры новообразований и их гистологическое строение у пациентов основной и контрольной групп достоверно не отличались и соответствовали результатам, представленным в литературе [13]. В основной/контрольной группах пациентов были получены следующие результаты гистологических исследований: туберкулез – у 2/2 пациентов, метастазы – у 4/5 пациентов, лимфома – у 4/3 пациентов, миелолипома – у 2/2 пациентов, доброкачественное новообразование коры надпочечников – у 3/4 пациентов, карцинома коры надпочечников – у 3/1 пациента. Размер образований в основной группе составил 53,1±8,2 мм, в контрольной – 56,5±7,4 мм (р = 0,09). Поэтому результаты роботизированной биопсии, предложенной авторами, корректно могли сравниваться с результатами биопсии методом «свободной руки».
Чувствительность, специфичность и точность метода при использовании роботизированного устройства составили 100% для каждого показателя, поскольку гистологические результаты биопсии позволили верифицировать диагноз у всех 18 пациентов. В контрольной группечувствительность метода составила 94,7%, так как у 1 пациента из 19 потребовалась повторная биопсия, которая показала злокачественный результат. Специфичность и точность составили также 100%. Эти показатели авторов оказались значительно лучше, чем при использовании метода «свободной руки», по данным других исследователей, в том числе в проспективных многоцентровых исследованиях с подробной регистрацией процедур биопсии и результатов определения эффективности диагностики и факторов, определяющих частоту неудачных биопсий и осложнений, связанных с процедурой [10]. Приведенные данные свидетельствует о преимуществах роботизированной биопсии.
Длительность процедуры с момента размещения пациента на компьютерном столе и до извлечения иглы составила в основной группе 26,6±7,4 минуты, в контрольной группе – 38,4±8,7 минуты (р = 0,03). По данным различных литературных источников, биопсия методом «свободной руки» составляет от 40 до 60 минут [14; 15]. Это сказывается на лучевой нагрузке на пациента, которая значительно выше при интервенционных процедурах, чем при диагностической КТ.
Заключение. Достижение оптимального баланса для оптимизации медицинской помощи при одновременном ограничении радиационного облучения пациентов и медицинского персонала во время интервенционных вмешательств под контролем КТ – это задача, которая продолжает оставаться актуальной. Для решения ее авторами разработано роботизированное устройство для биопсии, позволяющее исключить присутствие медицинского персонала в зоне радиационного облучения. Кроме того, авторами показано, что данное устройство не снижает точность манипуляции и сокращает время процедуры. Это ведет к снижению лучевой нагрузки, в том числе и на пациента.
В данном исследовании авторы приводят результаты первого опыта использования разработанного ими роботизированного устройства для биопсии надпочечников, одной из самых сложных манипуляций в интервенционной радиологии. Поражения надпочечников представляют собой гетерогенную группу новообразований, которые могут быть доброкачественными или злокачественными. Если визуализация не позволяет верифицировать поражение как доброкачественное или если требуется гистологическое профилирование, показана чрескожная биопсия под контролем КТ. Биопсию надпочечников следует применять с осторожностью, поскольку эта инвазивная процедура может быть чревата рядом осложнений, которых удалось избежать в результате использования роботизированного метода. Биопсия надпочечников наиболее полезна для диагностики метастазов у пациентов с недавно выявленным поражением и внепочечными злокачественными новообразованиями в анамнезе.
Библиографическая ссылка
Пустовгар А.А., Ярош А.Л., Олейник Н.В., Солошенко А.В. ПЕРВЫЕ РЕЗУЛЬТАТЫ ИСПОЛЬЗОВАНИЯ РАЗРАБОТАННОГО РОБОТИЗИРОВАННОГО УСТРОЙСТВА ПРИ БИОПСИИ НАДПОЧЕЧНИКОВ ПОД КОНТРОЛЕМ КОМПЬЮТЕРНОЙ ТОМОГРАФИИ // Современные проблемы науки и образования. 2024. № 4. ;URL: https://science-education.ru/ru/article/view?id=33531 (дата обращения: 20.02.2026).
DOI: https://doi.org/10.17513/spno.33531



